Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 35 nº 6 - Nov. / Dez. of 2002
Vol. 35 nº 6 - Nov. / Dez. of 2002
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Adilson Cunha Ferreira, Francisco Mauad Filho, Hélio Carrara, Jorge Elias Júnior, Ailton Bento Barbosa Júnior |
|
|
Descritores: Câncer de mama, Ultra-sonografia abdominal, Seguimento |
|
|
Resumo:
INTRODUÇÃO O câncer de mama é a primeira causa de óbito por neoplasias em mulheres no Estado de São Paulo(1). A taxa de incidência no Brasil é similar à dos países desenvolvidos, sendo estimada em 65,5 casos novos/100 mil mulheres/ano(2). Atualmente, excluindo-se o câncer de pele, o câncer de mama constitui a neoplasia maligna de maior freqüência nos EUA. A sua prevalência vem aumentando. Mudanças no estilo de vida, aumento da sobrevida da população, retardo da primeira gravidez, redução do número de filhos, uso da tecnologia e/ou ações de caráter educativo possibilitando o diagnóstico precoce colaboram para essa situação. O incremento dessa prevalência no mundo foi observado mais efetivamente a partir da década de 50, quando dados referentes à sua mortalidade nos EUA e Suíça passaram a ser avaliados(3), caracterizando-se, assim, como uma patologia de grande impacto socioeconômico. A realidade brasileira ainda não permite a realização do rastreamento do câncer de mama em grandes massas populacionais. Segundo o censo do IBGE de 1995, possuímos 19,5 milhões de pacientes em idade acima de 40 anos que se enquadrariam nesses programas(1). À medida que a população envelhece, haverá uma porcentagem crescente nos grupos etários mais velhos e os números totais das mulheres com câncer de mama continuarão a aumentar. A despeito desses dados, é crescente o diagnóstico precoce do câncer de mama, sendo cada vez maior o número de pacientes tratadas e "inseridas" em programas de seguimentos, em diversos serviços especializados. Nesse panorama, deve-se ressaltar a inexistência, até o momento, de diretrizes amplas e unanimemente aceitas para a realização de protocolos de seguimento de pacientes com câncer de mama. Os exames freqüentemente propostos visam analisar os locais mais acometidos. O local mais comum de metástase a distância no câncer primário da mama é o osso, em 51%, seguido do pulmão, em 17%, cérebro, em 16%, e fígado, em 6%(4). Portanto, o fígado constitui-se num dos locais menos comuns de metástase a distância. O tempo médio de sobrevida é de 12 meses para metástase em osso e lesões pulmonares, três meses para lesões no cérebro, e um mês para lesões no fígado(4). Observa-se ampla variedade de condutas, de centro para centro(3). O tema permanece controverso(5), e a abordagem clínico-laboratorial, heterogênea(6). Questiona-se se os programas de seguimento levam, realmente, a uma detecção mais precoce das metástases a distância. A detecção precoce representa um benefício para as pacientes(3)? Quais exames devem ser utilizados nesses programas(7)? A ultra-sonografia abdominal deve ser realizada sistematicamente? Há poucas evidências que mostram vantagens na sobrevida para as pacientes em programas intensivos de seguimento e com metástases diagnosticadas precocemente, ainda na fase assintomática. A presunção de que existe o benefício do seguimento sistemático é a sustentação de muitos programas de seguimento que empregam diversos tipos de marcadores biológicos e exames de imagem, dentre esses a ultra-sonografia abdominal. Há referências, na literatura, de que, apesar das consultas médicas periódicas, a maioria das recaídas será descoberta pelas próprias pacientes, sendo que 75% a 85% delas no intervalo entre as consultas(8). A análise rigorosa dos sinais e sintomas tem sido enfatizada e valorizada. Aproximadamente três quartos das recorrências do câncer mamário são precedidos de sinais e sintomas(6). Intrigados com esses números, alguns autores investigaram o porcentual do aparecimento de sinais e sintomas como primeira manifestação em pacientes que estavam sobre controle clínico rigoroso e realização de exames complementares. Pandya et al.(8) encontraram manifestações clínicas em 74% de suas pacientes. Concluíram que essas manifestações podem ser utilizadas como rastreadores para a solicitação de exames complementares, em particular a ultra-sonografia abdominal. Perda de peso, dor no quadrante superior direito do abdome, hepatomegalia e alteração de enzimas hepáticas devem alertar para a ocorrência de metástase hepática(9). Evidências da literatura demonstram que 25% das pacientes referem alguma história sugestiva de envolvimento hepático, e cerca de 50% têm clínica de tal envolvimento. Schapira e Urban(5) referem que a detecção de recorrência após o tratamento primário do câncer de mama parece ser possível em 74% a 92% dos casos, utilizando-se somente a anamnese e o exame físico. A realização da ultra-sonografia hepática e/ou abdominal visa, principalmente, à detecção de metástases hepáticas. A proposta de rastreamento do comprometimento de órgãos a distância, em particular os abdominais, em pacientes portadoras de câncer primário da mama, vem sendo questionada devido, principalmente, ao seu alto custo, quando se equacionam a sua efetiva contribuição para o prognóstico e as condutas a serem tomadas(3,10). A proposta deste trabalho foi avaliar os achados da ultra-sonografia abdominal, dentre os quais as metástases hepáticas, em pacientes em seguimento após tratamento de câncer de mama.
MATERIAL E MÉTODOS Foram avaliados, retrospectivamente, 100 prontuários de pacientes que realizaram ultra-sonografia abdominal, de janeiro a dezembro de 1997, no Setor de Ultra-sonografia da Divisão de Radiologia do Departamento de Clínica Médica da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, por terem sido tratadas de câncer mamário. Os equipamentos de ecografia utilizados foram: Aloka modelo SSD-1100 Flexus, Acuson modelo 128XP/10 e ATL modelo Ultramark 4 Plus. Esse material foi avaliado quanto a idade, raça, nacionalidade, tipo histológico do câncer analisado na peça operatória, procedimento cirúrgico, tratamento complementar à cirurgia, estadiamento, tempo de acompanhamento, número e resultados das ultra-sonografias realizadas. Foram excluídas, do estudo, as pacientes no estádio IV, por já apresentarem metástase a distância.
RESULTADOS A idade média das pacientes estudadas foi de 55 anos, variando de 21 a 83 anos. As idades das pacientes quando foram diagnosticadas as metástases foram, respectivamente, 48, 45 e 78 anos (Tabela 1). O tipo histológico mais freqüentemente encontrado foi o carcinoma ductal, que representou 89,7% da amostra e 100% dos casos de metástase (Tabela 1). Quanto ao estadiamento, observou-se que foi de 10% para o estadiamento I, de 49% para o estadiamento II, e de 41% para o estadiamento III. O procedimento cirúrgico realizado foi conservador em 31% dos casos e radical em 69%, sendo que os três casos de metástase diagnosticados no seguimento ocorreram em pacientes que realizaram tratamento radical. O tratamento complementar à cirurgia foi a quimioterapia em 13% dos casos, a radioterapia em 13%, a hormonioterapia em 4%, e a associação de tratamentos em 52% (Tabela 2).
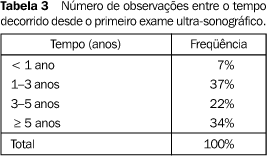
O tempo decorrido entre a cirurgia e os controles evidenciou que o menor intervalo de tempo foi de um mês, sendo o maior de 18 anos e 7 meses (Tabela 3).
Os três casos de metástase hepática foram diagnosticados com 8 anos e 1 mês, 3 anos e 5 meses e 2 anos e 5 meses de seguimento (Tabela 1). Os achados mais freqüentemente encontrados nas ultra-sonografias realizadas foram: em 70% dos casos, sem evidências de anormalidade; em 3%, sugestivo de metástase hepática; em 17%, esteatose; em 10%, litíase vesicular; em 9%, alterações renais; em 4%, alteração ateromatosa da aorta; e em 5%, outros achados. Como houve associação desses achados numa mesma paciente, o somatório final não resulta em 100% (Tabela 4).
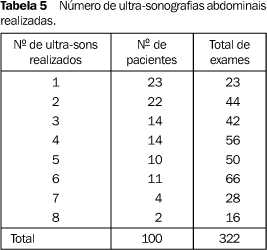
O número total de ultra-sonografias abdominais realizadas foi de 322, sendo a média de 3,2 por paciente. O maior número de ultra-sons realizados em uma única paciente foi de oito exames, e o menor foi de um exame (Tabela 5).
DISCUSSÃO Em relação à idade, nossos dados corroboram os da literatura, em que o câncer de mama é raro antes dos 25 anos e praticamente inexistente antes da menacme, tornando-se mais freqüente a partir dos 35 anos. Cabe ressaltar que esta não é a idade do momento do diagnóstico do câncer primário da mama, visto que algumas pacientes vinham sendo acompanhadas há vários anos. Quanto ao estadiamento, tipo histológico e terapêutica realizada, esta amostra também se revelou semelhante à referida na literatura. O objetivo deste trabalho não foi avaliar todas essas variáveis isoladamente. Entretanto, como se analisou um pequeno número de pacientes, tornou-se pertinente caracterizar a amostra como representativa de pacientes que fazem seguimento após tratamento do câncer de mama. Assim sendo, pode-se considerá-la representativa, visto que o perfil apresentado das variáveis analisadas é compatível com dados da literatura. O seguimento no câncer de mama visa detectar precocemente a recidiva, assim como pesquisar a presença das metástases loco-regional e a distância, norteado principalmente pela idéia de que a terapia iniciada nessa fase é mais efetiva do que após o surgimento dos sintomas, que, em geral, são tardios. Nos casos de metástases a distância, os benefícios do seu diagnóstico numa fase precoce, em pacientes assintomáticas, não foram unanimemente estabelecidos. Não existe, até o momento, evidência incontestável de que o início precoce de qualquer modalidade terapêutica resulte em benefícios na sobrevida das pacientes com câncer de mama, havendo, assim, sempre, questionamento da sua real efetividade(3). Embora se suponha que haja o benefício psíquico dessa prática para um grupo de pacientes, para outros ela pode acrescentar meses ou anos de ansiedade relacionada a diagnósticos adicionais. O GIVIO(11,12) (Interdisciplinary Group for Cancer Care Evaluation) também demonstrou que o seguimento sistemático (tradicional) não melhorou a qualidade de vida. Concluiu que a auto-imagem, integração social e satisfação com cuidados recebidos foram semelhantes em ambos os grupos (o grupo que realizou controle sistemático e o que não realizou). Nesse mesmo estudo, a maioria (70%) de um grupo de mulheres, quando questionadas, referiam sua preferência em estar sendo examinadas em clínicas específicas para tratamento do câncer mamário, assim como consideravam necessária a realização de uma "série de exames". Alguns estudos(6,9,12-14) demonstraram que esta "série de exames" (inclua-se aqui a ultra-sonografia hepática e/ou abdominal), além de onerosa, é ineficaz. Ressalta-se, ainda, que, em função dos diagnósticos que eventualmente aparecem, a utilização sistemática da solicitação de exames pode ser prejudicial, uma vez que pode acarretar alterações psíquicas, afetando as relações pessoais, provocando mudanças de hábitos, cobertura de seguros de vida e do trabalho. Liberati(11), em trabalho prospectivo de 1.320 mulheres em seguimento após tratamento de câncer primário da mama, demonstrou (dentre outros exames) que a ultra-sonografia hepática de rotina não melhorou nem a sobrevida nem a qualidade de vida das pacientes. Uma vez que no levantamento efetuado neste nosso trabalho 70% dos resultados foram considerados normais, a prática rotineira da solicitação da ultra-sonografia abdominal em pacientes sob seguimento por câncer de mama deve ser discutida. Nesse particular, o diálogo do médico com a paciente, ou de sua equipe assistente, assim como a comunicação por um profissional de saúde adequadamente treinado(15), alertando-a para possíveis sinais de disseminação da doença, é de grande importância. O fracasso dessa comunicação freqüentemente leva a uma ansiedade desnecessária da paciente e de toda a equipe médica, a despeito de todos os exames realizados, gerando um alto custo(16) causado por procedimentos diagnósticos adicionais, tratamento, reabilitação e custos ocultos, impedindo que recursos sejam empregados de maneira mais efetiva. Holli e Hakama(17), em estudo prospectivo de 551 pacientes em seguimento após tratamento de câncer da mama, sugerem que o seguimento deve, inclusive, ser discutido com a paciente, adequando-o à sua qualidade de vida. O Steering Committee on Clinical Practice Guidelines for the Care and Treatment of Breast Cancer(18) recomenda que a freqüência do seguimento deve ser ajustada de acordo com a necessidade individual de cada paciente e que exames para rastreamento de metástase hepática não precisam ser realizados. Essas informações, associadas a recentes estudos, poderão prover dados para uma significativa redução de custos diretos e indiretos(6). O porcentual de 30% dos exames ultra-sonográficos anormais, neste estudo, não identificou, em sua grande maioria, alterações relacionadas diretamente ao câncer da mama. Na casuística, foram encontrados 3% de imagens sugestivas de metástase hepática, 17% de esteatose hepática, 10% de litíase vesicular (sendo um caso de vesícula escleroatrófica), 9% de alterações renais (um caso de angiomiolipoma, seis casos de cisto(s) renal simples, um caso de discreta redução do volume renal, dois casos de litíase renal), 4% de ateromatose da aorta (um caso de ectasia da aorta associada) e um caso de "aorta de contornos tortuosos". Como ocorreu associação de alterações — por exemplo, esteatose com litíase vesicular —, o somatório final não resultou em 100%. A incidência de 3% de metástase encontrada em nossa análise corrobora dados da literatura, em que Hoe et al.(19), estudando a ocorrência de metástase hepática num grupo de 912 pacientes pós-tratamento de câncer da mama, entre 1982 e 1987, identificaram 47 pacientes que desenvolveram metástases hepáticas, uma incidência de 5,2%. Patanaphan et al.(4) referem incidência de 6%. Outros autores apontam uma incidência que varia de 1,5% a 20%, dependendo do tipo de paciente, métodos diagnósticos e tempo do seguimento(20). Nesta nossa análise, o tempo decorrido para o diagnóstico da metástase hepática variou de 2 anos e 5 meses a 8 anos e 1 mês após a realização do primeiro ultra-som normal. Na esteatose hepática, o comprometimento difuso é bastante característico, em razão da atenuação do feixe acústico sonoro presente no parênquima. A ultra-sonografia permite a análise prática da esteatose por meio da comparação entre os parênquimas hepático e renal, sendo sua sensibilidade, atualmente, de 100%. Dentre as causas de esteatose, inclui-se a quimioterapia. Entretanto, ressalte-se que o porcentual encontrado pode ser compatível com o habitual na faixa etária analisada. Os demais diagnósticos não podem ser relacionados diretamente com o grupo pesquisado, visto que são compatíveis com dados da literatura para a mesma faixa estudada, independentemente do câncer mamário. Tal evento deve ser considerado como um achado. A realização da ultra-sonografia abdominal poderia ser reservada para aquelas pacientes de maior risco, sintomáticas e/ou com alteração laboratorial(14,21). Embora não haja consenso na literatura em relação a essa proposta, há quem advogue que pacientes com antecedentes familiares fortemente positivos(22), estadiamento mais avançado, tumores mais indiferenciados, bilaterais, multifocais, devido a uma evolução freqüentemente menos favorável, deveriam ser diferenciadas dos demais casos, sendo direcionadas a seguimento mais intensivo. Numa época em que as restrições financeiras aumentam(3), o continuismo do seguimento sistemático tradicional ("follow-up") não pode persistir por muito mais tempo sem uma sólida base científica(13). Dois grandes estudos randomizados sobre seguimento após tratamento primário do câncer mamário(12,23) analisaram o valor dos exames complementares. Dentre esses, a ultra-sonografia abdominal, com ênfase na avaliação hepática, evidenciou que não há melhora na sobrevida das pacientes quando se compara o grupo que realizou seguimento sistemático com o grupo que foi acompanhado através da análise da história e exame clínico. Sumarizando, surge a pergunta inevitável: é possível deixar de realizar ultra-sonografia abdominal de rotina sem detrimento da sobrevida e da qualidade de vida das pacientes? A literatura sugere que sim. Existem, até o presente momento, poucas evidências de que pacientes assintomáticas se beneficiem da realização sistemática da ultra-sonografia abdominal, e uma série de trabalhos propõe que ela não seja realizada. Deve ficar claro que o questionamento não se refere à efetividade do método, já há muito estabelecida na literatura. Questiona-se o impacto do diagnóstico precoce da metástase. Segundo a American Society of Clinical Oncology (ASCO)(24), não há justificativa para exame ultra-sonográfico hepático de rotina. Conclui-se que a contribuição da ultra-sonografia abdominal em um grupo de pacientes em seguimento, após tratamento de câncer primário da mama, diagnosticou alterações em 30% dos casos, destacando-se 3% de metástase. A polêmica persiste, pois se questiona, inclusive, quem e como se deve fazer o seguimento das pacientes tratadas de câncer primário da mama(15,25). Portanto, considera-se esta análise como um processo preliminar para a realização de estudos mais abrangentes, com casuística maior e metodologia prospectiva, com o objetivo de cristalizar o assunto enfocado.
REFERÊNCIAS 1.Ministério da Saúde, Instituto Nacional do Câncer (INCA). Câncer no Brasil. Dados dos registros de base populacional. Rio de Janeiro: INCA/MS, 1991. [ ] 2.Gurgel MSC, Shinzato JY, Arena JFP. Influência da história familiar na evolução do câncer de mama. Rev Bras Mastol 1997;7:51-7. [ ] 3.Tomiak E, Piccart M. Routine follow-up of patients after primary therapy for early breast cancer: changing concepts and challenges for the future. Ann Oncol 1993;4:199-204. [ ] 4.Patanaphan V, Salazar OM, Risco R. Breast cancer: metastatic patterns and their prognosis. South Med J 1988;81:1109-12. [ ] 5.Schapira DV, Urban N. A minimalist policy for breast cancer surveillance. JAMA 1991;265:380-2. [ ] 6.Loomer L, Brockschmidt JK, Muss HB, Saylor G. Postoperative follow-up of patients with early breast cancer. Patterns of care among clinical oncologists and a review of the literature. Cancer 1991; 67:55-60. [ ] 7.Tomiak EM, Piccart MJ. Routine follow-up of patients following primary therapy for early breast cancer: what is useful? Acta Clin Belg Suppl 1993;15:38-42. [ ] 8.Pandya KJ, McFadden ET, Kalish LA, Tormey DC, Taylor SG IV, Falkson G. A retrospective study of earliest indicators of recurrence in patients on Eastern Cooperative Oncology Group adjuvant chemotherapy trials for breast cancer. A preliminary report. Cancer 1985;55:202-5. [ ] 9.Rutgers EJ, van Slooten EA, Kluck HM. Follow-up after treatment of primary breast cancer. Br J Surg 1989;76:187-90. [ ] 10.Marcus JN, Watson P, Page DL, et al. Hereditary breast cancer: pathobiology, prognosis, and BCRA1 and BCRA2 gene linkage. Cancer 1996;77:697-709. [ ] 11.Liberati A. The GIVIO trial on the impact of follow-up care on survival and quality of life in breast cancer patients. Interdisciplinary Group for Cancer Care Evaluation. Ann Oncol 1995;6 Suppl 2:41-6. [ ] 12.Impact of follow-up testing on survival and health-related quality of life in breast cancer patients. A multicenter randomized control trial. The GIVIO Investigators. JAMA 1994;271:1587-92 [ ] 13.Brada M. Is there a need to follow-up cancer patients? Eur J Cancer 1995;31A:655-7. [ ] 14.Kamby C. The pattern of metastases in human breast cancer: methodological aspects and influence of prognostic factors. Cancer Treat Rev 1990;17:37-61. [ ] 15.James ND, Guerrero D, Brada M. Who should follow-up cancer patients? Nurse specialist based outpatient care and the introduction of a phone clinic system. Clin Oncol (R Coll Radiol) 1994; 6:283-7. [ ] 16.Schapira DV. Breast cancer surveillance - a cost-effective strategy. Breast Cancer Res Treat 1993;25: 107-11. [ ] 17.Holli K, Hakama M. Effectiveness of routine and spontaneous follow-up visits for breast cancer. Eur J Cancer Clin Oncol 1989;25:251-4. [ ] 18.Follow-up after treatment for breast cancer. The Steering Committee on Clinical Practice Guidelines for the Care and Treatment of Breast Cancer. CMAJ 1998;158 Suppl 3:S65-70. [ ] 19.Hoe AL, Royle GT, Taylor I. Breast liver metastases - incidence, diagnosis and outcome. J R Soc Med 1991;84:714-6. [ ] 20.De Rivas L, Coombes RC, McCready VR, et al. Tests for liver metastases in breast cancer: evaluation of liver scan and liver ultrasound. Clin Oncol 1980;6:225-30. [ ] 21.Khandekar JD. Recommendations on follow-up of breast cancer patients following primary therapy. Semin Surg Oncol 1996;12:346-51. [ ] 22.Claus EB, Risch NJ, Thompson WD. Age at onset as an indicator of familial risk of breast cancer. Am J Epidemiol 1990;131:961-72. [ ] 23.Rosselli Del Turco M, Palli D, Cariddi A, Ciatto S, Pacini P, Distante V. Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council Project on Breast Cancer Follow-up. JAMA 1994;271:1593-7. [ ] 24.Smith TJ, Davidson NE, Schapira DV, et al. American Society of Clinical Oncology 1998 update of recommended breast cancer surveillance guidelines. J Clin Oncol 1999;17:1080-2. [ ] 25.Wertheimer MD. Against minimalism in breast cancer follow-up. JAMA 1991;265:396-7. [ ]
* Trabalho realizado no Departamento de Clínica Médica, Divisão de Radiologia, da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Ribeirão Preto, SP. Aprovado pelo Comitê de Ética em Pesquisa, processo HCRP no 1710/00. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554