Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 35 nº 4 - Jul. / Ago. of 2002
Vol. 35 nº 4 - Jul. / Ago. of 2002
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Walkyria de Paula Pimenta, Altamir Santos Teixeira, Flávio Ferrari Aragon, Elda Eveline Baptistelli, Adriana Guanaes Moreira, Ana Valéria Barros de Castro, Carlos Roberto Padovani |
|
|
Descritores: Ultra-sonografia do pâncreas, Pâncreas no diabetes, Tamanho do pâncreas, Ecogenicidade pancreática |
|
|
Resumo:
INTRODUÇÃO A classificação de indivíduos adultos com diabetes melito primário (DM) em seus tipos 1 ou 2 tem sido mais difícil nos últimos anos(1). A dosagem do anticorpo antidescarboxilase do ácido glutâmico tem sido de grande auxílio, tendo permitido a Zimmet(2) identificar o diabetes de tipo 1 (DM-1) em 15% a 20% de diabéticos adultos e em 50% de diabéticos previamente classificados como do tipo 2 (DM-2) não-obesos. Todavia, esta metodologia exige tecnologia mais avançada e maiores recursos, nem sempre disponíveis. Por outro lado, o DM caracteriza-se por deficiência absoluta ou relativa de insulina, que resulta de mecanismos patogênicos diversos para o DM-1 e o DM-2(1). No DM-1, um processo auto-imunológico causa destruição quase total das células b pancreáticas(3-5); a velocidade de seu desenvolvimento é variável, sendo mais lenta quando acomete indivíduos mais velhos(1,2,5,6). No DM-2 há uma disfunção das células b pancreáticas, acompanhada de diversos graus de resistência à insulina, de origem genética ainda pouco esclarecida(7,8). Neste tipo de diabetes os resultados são mais controversos; todavia, estudos cuidadosamente conduzidos verificaram redução de 50% a 60% do volume das células b relativamente ao grupo controle(4,9). A insulina exerce efeito trófico sobre a porção exócrina do pâncreas; desse modo, após alguns anos de evolução do DM-1, ocorre uma redução do volume pancreático. No DM-2, além de essa redução ser menor, há fatores interferentes como a deposição de substância amilóide, a infiltração gordurosa e a presença de estimulantes das células b, como a resistência insulínica(7,10). A avaliação morfológica do pâncreas oferece características distintas para ambos os tipos de diabetes e pode ser realizada de forma não-invasiva, desde o advento da ultra-sonografia (US) e da tomografia computadorizada (TC). A primeira técnica tem vantagens em relação à segunda por ser mais simples, menos custosa e não envolver o uso de contrastes radioativos(11). Assim, baseando-se nas evidências de que os comprometimentos funcional e estrutural do pâncreas resultam de processos etiopatogênicos específicos no DM-1 e DM-2, o objetivo deste trabalho foi o de verificar se a US do pâncreas forneceria dados distintos, auxiliares, no diagnóstico destes dois tipos principais do DM, num grupo de pacientes adultos.
CASUÍSTICA E MÉTODOS Oitenta e um diabéticos participaram do estudo, todos sem passado de alcoolismo, pancreatite ou dislipidemia grave, após terem sido devidamente esclarecidos e assinado o consentimento por escrito. Os pacientes foram assim classificados: 20 com DM-1 e 61 com DM-2, dos quais 53 eram inicialmente obesos e oito eram não-obesos(1). As principais características clínicas e laboratoriais encontram-se na Tabela 1.
Dezoito indivíduos saudáveis — dez obesos (quatro homens/seis mulheres; 36 ± 14 anos; índice de massa corporal = 34,8 ± 6,7 kg/m²) e oito não-obesos (dois homens/seis mulheres; 37 ± 17 anos; índice de massa corporal = 23,8 ± 1,6 kg/m²) — constituíram o grupo controle. Os pacientes e os controles foram submetidos a US do abdome às 8h00 da manhã, em posição supina, após 12 horas de jejum, tendo sido observado preparo habitual prévio. Todos os exames de US foram realizados por um dos autores, que desconhecia o grupo a que o paciente pertencia. Utilizou-se aparelho de imagem em tempo real (Toshiba Sonolayer 140 SSH) equipado com transdutor convexo de 3,5 MHz. O pâncreas identificado foi dividido em três regiões: a cabeça e o corpo, como as áreas à direita e à esquerda, respectivamente, da confluência das veias esplênica e mesentérica superior, e a cauda, como a porção que fica anteriormente ao rim esquerdo e estende-se ao interior do hilo esplênico. Como a cauda não foi sempre claramente visualizada e representou somente uma pequena parte da massa pancreática, não foi considerada nas análises. A maior área da secção longitudinal do pâncreas (área) era automaticamente calculada e medidos os diâmetros máximos: a) transversal da cabeça (cabeça), que se considerou da borda externa, contígua à alça duodenal, até a região ístmica; b) ântero-posterior do corpo (corpo), em correspondência ao terço médio da veia esplênica. A ecogenicidade do tecido pancreático foi avaliada por comparação àquela do tecido hepático normal e então classificada em hipo, iso ou hiperecogênica. A comparação das dimensões e da ecogenicidade do pâncreas entre os três grupos de diabéticos e os dois subgrupos controle foi realizada por análise de covariância (Ancova). Esta análise foi complementada com o teste de Tukey para comparação das médias corrigidas(12). A análise de associação foi realizada para o grupo dos pacientes com DM-2 obesos pelos coeficientes de Pearson e Spearman, considerando-se cada sexo individualmente(13). Considerou-se como nível de significância o valor de 5% (P < 0,05). O projeto foi aprovado pelo Comitê de Ética em Pesquisa de nossa Instituição.
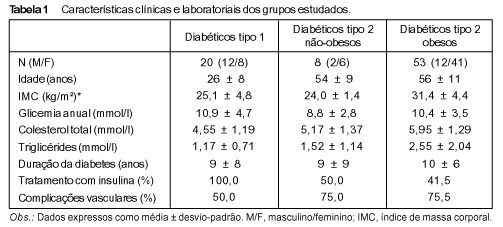
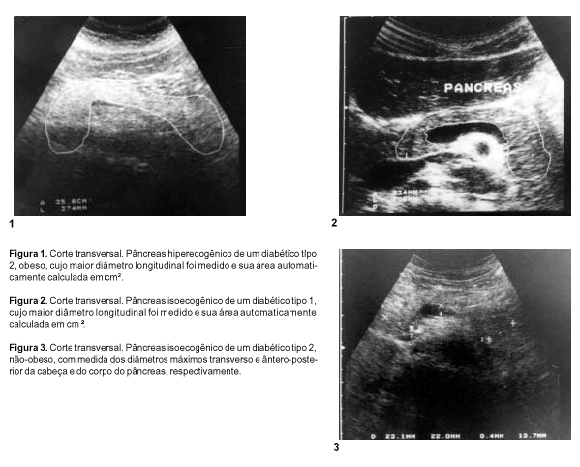
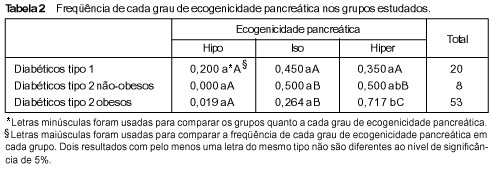
RESULTADOS Os pacientes com DM-2 obesos apresentaram área pancreática (média ± desvio-padrão (DP)) significativamente maior que a dos demais diabéticos: 21,38 ± 7,98 cm² vs. 13,49 ± 4,98 cm² nos pacientes com DM-1 e 15,20 ± 4,57 cm² nos com DM-2 não-obesos (P < 0,05) (Figuras 1 e 2). O mesmo foi observado em relação ao corpo do pâncreas (média ± DP): 1,53 ± 0,43 cm nos pacientes com DM-2 obesos vs. 1,04 ± 0,38 cm nos com DM-1 e 1,24 ± 0,18 cm nos com DM-2 não-obesos (P < 0,05). Os três grupos não foram diferentes em relação à medida da cabeça pancreática (média ± DP): 2,62 ± 0,63 cm, 2,27 ± 0,57 cm e 2,38 ± 0,50 cm nos pacientes com DM-2 obesos, DM-1 e DM-2 não-obesos, respectivamente (P > 0,05) (Figuras 1, 2 e 3).
No grupo controle os indivíduos obesos apresentaram área pancreática (média ± DP) — 19,09 ± 6,23 cm² vs. 14,21 ± 4,25 cm² — e medida do corpo do pâncreas (média ± DP) — 1,34 ± 0,25 cm vs. 1,10 ± 0,30 cm — maiores que os indivíduos não-obesos, a nível de 0,05 < P < 0,10. Os resultados da ecogenicidade relativa do pâncreas dos três grupos estudados encontram-se na Tabela 2. O grupo com DM-2 obesos apresentou pâncreas hiperecogênico mais freqüentemente que o com DM-1 (P < 0,05). O pâncreas dos pacientes com DM-2 obesos mostrou-se principalmente hiperecogênico (72%), menos vezes isoecogênico (26%) e raramente hipoecogênico (2%); os com DM-1 mostraram freqüência semelhante das três categorias de ecogenicidade pancreática: 35% hiperecogênico, 45% isoecogênico e 20% hipoecogênico; o pâncreas dos com DM-2 não-obesos foi hiper ou isoecogênico.
Os indivíduos controles obesos não diferiram dos não-obesos quanto à ecogenicidade do pâncreas, que foi 50% e 75% isoecogênico, e 50% e 25% hiperecogênico, respectivamente. O sexo foi a única variável que interferiu na avaliação ultra-sonográfica do pâncreas, tendo sido considerada em todas as análises. No grupo dos pacientes com DM-2 obesos não houve correlação entre os parâmetros clínico-laboratoriais e as medidas pancreáticas.
DISCUSSÃO Com o evoluir dos conhecimentos sobre a etiopatogenia do DM, os limites entre os tipos clássicos 1 e 2 tornaram-se menos precisos, não sendo raro, hoje, na prática clínica, termos dificuldade em classificar um paciente diabético. São antigos os estudos morfológicos(4,10) e funcionais(8,14) que demonstraram que o comprometimento fundamental no DM é o das células b pancreáticas, com conseqüente menor estimulação da porção exócrina do pâncreas(15). Por processos patogênicos diversos, a lesão das células b é mais intensa nos pacientes com DM-1 que nos com DM-2, além de haver, nestes, concomitante reação de infiltração e degeneração do pâncreas. Dispondo-se de método simples e não-invasivo de avaliação morfológica do pâncreas, como a US, consideramos de interesse verificá-la como um meio auxiliar no diagnóstico diferencial entre pacientes com DM-1 e DM-2 num grupo de diabéticos adultos. Os diabéticos tipo 2 obesos diferenciaram-se dos com DM-1 e com DM-2 não-obesos por apresentarem medidas da área total e do corpo do pâncreas significativamente maiores. Tal achado encontra apoio em estudos com diabéticos, seja da população brasileira(16) ou estrangeira(17-20). O aumento relativo do tamanho do pâncreas decorreria do fato do comprometimento das células b ser principalmente funcional e menos morfológico(21) e do exame de US do pâncreas não diferenciar entre tecido glandular e os depósitos de gordura e de substância amilóide. Neste estudo pudemos verificar efeito expressivo da obesidade em aumentar o tamanho do pâncreas. As dimensões pancreáticas em pacientes com DM-2 não-obesos não foram diferentes das em diabéticos tipo 1. Sabe-se que a deficiência de insulina nestes diabéticos é intermediária entre a apresentada pelos pacientes com DM-1 e a pelos pacientes com DM-2 obesos, o que deveria corresponder a um grau intermediário de redução do tamanho do pâncreas. De fato, em 19 pacientes com DM-2 recebendo insulina, Fonseca et al.(18) verificaram tamanho do pâncreas menor que o dos demais diabéticos tipo 2, mas maior que o dos com DM-1. Ainda, Migdalis et al.(19) e Alzaid et al.(17) encontraram, no grupo dos pacientes com DM-2, uma correlação positiva entre as dimensões pancreáticas e a secreção de peptídio C. Nossos resultados dever-se-iam, então, ao reduzido número destes diabéticos e à possibilidade de estarem incluídos, neste grupo, alguns que na realidade seriam do tipo 1 com evolução mais lenta. O tamanho do pâncreas dos diabéticos tipo 1 foi menor que o dos diabéticos tipo 2, como verificado por outros autores(16-18,20); todavia, esta diferença foi signficativa apenas em relação ao subgrupo obeso, que constitui a maioria dos pacientes com DM-2. Além disso, 50% de nossos pacientes com DM-1 tinham tempo de doença menor que dez anos e o processo auto-imunológico de destruição do pâncreas tem velocidade de evolução variável, exigindo, muitas vezes, tempo maior que aquele para induzir reduções mais acentuadas do volume glandular. O grau de ecogenicidade do pâncreas é determinado principalmente pelo depósito de gordura, que o envolve, e do septo, que o atravessa. Dessa forma, como variáveis independentes, a idade e a obesidade, principalmente do tipo abdominal, aumentam seu poder ecogênico(16,22). Nos pacientes com DM-2 a presença de obesidade, de idade mais avançada e de processos degenerativo e infiltrativo do tecido pancreático faz com que o pâncreas seja predominantemente hiperecogênico, como verificamos, e também Silva et al.(16). Observamos que os indivíduos obesos apresentaram mais vezes pâncreas hiperecogênico que os indivíduos não-obesos, porém tal diferença não foi significativa, provavelmente por causa do número insuficiente de indivíduos estudados. Já os pacientes com DM-2, na ausência de obesidade e por processos degenerativos do pâncreas, possivelmente diversos dos do grupo anterior, apresentaram pâncreas menos vezes hiperecogênico e mais vezes isoecogênico. A maior freqüência de pâncreas hipoecogênico nos pacientes com DM-1 resultaria de serem geralmente jovens não-obesos e terem atrofia do parênquima glandular. O seu valor dependeria das características do grupo populacional estudado, fundamentalmente, da duração do diabetes(20). Entre os diabéticos tipo 2 obesos não encontramos correlação significativa entre as características clínicas e laboratoriais e as medidas do pâncreas. Tal resultado tem sido variável entre os autores, provavelmente na dependência do grupo populacional considerado.
CONCLUSÕES Nossos resultados mostram que o tamanho do pâncreas à US não expressa necessariamente seu estado funcional e constitui metodologia auxiliar no diagnóstico diferencial entre diabéticos de tipo 1 e de tipo 2, embora com menor eficácia quando os últimos não são obesos.
REFERÊNCIAS 1. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997;20:1183-97. [ ] 2. Zimmet PZ. The pathogenesis and prevention of diabetes in adults. Genes, autoimmunity, and demography. Diabetes Care 1995;18:1050-64. [ ] 3. Atkinson MA, Maclaren NK. The pathogenesis of insulin-dependent diabetes mellitus. N Engl J Med 1994;331:1428-36. [ ] 4. Gepts W. Pathologic anatomy of the pancreas in juvenile diabetes mellitus. Diabetes 1965;14:619-33. [ ] 5. Saito K, Yaginuma N, Takahashi T. Differential volumetry of A, B and D cells in the pancreatic islets of diabetic and nondiabetic subjects. Tohoku J Exp Med 1979;129:273-83. [ ] 6. Maclean N, Ogilvie RF. Quantitative estimation of the pancreatic islet tissue in diabetic subjects. Diabetes 1955;4:367-76. [ ] 7. Leahy JL. Natural history of b-cell dysfunction in NIDDM. Diabetes Care 1990;13:992-1010. [ ] 8. Polonsky KS, Sturis J, Bell GI. Non-insulin dependent diabetes mellitus: a genetically programmed failure of the beta cell to compensate for insulin resistance. N Engl J Med 1996;334:777-83. [ ] 9. Klöppel G, Löhr M, Habich K, Oberholzer M, Heitz PU. Islet pathology and the pathogenesis of type 1 and type 2 diabetes mellitus revisited. Surv Synth Pathol Res 1985;4:110-25. [ ] 10. Westermark P, Wilander E. The influence of amyloid deposits on the islet volume in maturity onset diabetes mellitus. Diabetologia 1978;15:417-21. [ ] 11. Guerra MB, Gutiérrez LC, Carrasco RT, Arroyo AP. Tamaño y ecogenicidad del páncreas en adultos chilenos: estudio ecotomográfico em 261 pacientes. Rev Med Chil 1995;123:720-6. [ ] 12. Montgomery DC. Design and analysis of experiments. New York: John Wiley, 1991. [ ] 13. Norman GR, Streiner DL. Biostatistics - the bare essentials. St. Louis: Mosby-Year Book, 1994. [ ] 14. Pfeifer MA, Halter JB, Porte D Jr. Insulin secretion in diabetes mellitus. Am J Med 1981;70:579-88. [ ] 15. Dandona P, Freedman DB, Foo Y, et al. Exocrine pancreatic function in diabetes mellitus. J Clin Pathol 1984;37:302-6. [ ] 16. Silva MER, Vezozzo DP, Ursich MJM, Rocha DM, Cerri GG, Wajchenberg BL. Ultrasonographic abnormalities of the pancreas in IDDM and NIDDM patients. Diabetes Care 1993;16:1296-7. [ ] 17. Alzaid A, Aideyan O, Nawaz S. The size of the pancreas in diabetes mellitus. Diabet Med 1993; 10:759-63. [ ] 18. Fonseca V, Berger LA, Beckett AG, Dandona P. Size of pancreas in diabetes mellitus: a study based on ultrasound. Br Med J 1985;291:1240-1. [ ] 19. Migdalis IN, Voudouris G, Kalogeropoulou K, Iliopoulou V, Koutoulidis K, Samartzis M. Size of the pancreas in non-insulin-dependent diabetic patients. J Med 1991;22:179-86. [ ] 20. Stella SM, Giunta S, Di Cianni G, et al. Il pancreas nel diabete mellito: aspetti ecografici. Radiol Med 1993;85:70-4. [ ] 21. Sempoux C, Guiot Y, Dubois D, Moulin P, Rahier J. Human type 2 diabetes: morphological evidence for abnormal b-cell function. Diabetes 2001;50(Suppl 1):S172-7. [ ] 22. Worthen NJ, Beabeau D. Normal pancreatic echogenicity: relation to age and body fat. AJR 1982;139:1095-8. [ ]
* Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina de Botucatu - Universidade Estadual Paulista Júlio de Mesquita Filho (Unesp), Botucatu, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554