Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 35 nº 2 - Mar. / Abr. of 2002
Vol. 35 nº 2 - Mar. / Abr. of 2002
|
RELATO DE CASO
|
|
|
|
|
Autho(rs): Dante Luiz Escuissato, Jorge Alberto Ledesma, Linei Augusta Brolini Dellê Urban, Cristhian Bau Liu, Jorge Sergio Reis Filho, Adilson Gil Oliveira Filho, Maurício Beller Ferri, Marco Aurelio Hossaka |
|
|
Descritores: Neoplasia gástrica, Metástase pulmonar, Metástase óssea, Tomografia computadorizada |
|
|
Resumo:
INTRODUÇÃO
Apesar do esforço no diagnóstico precoce do câncer gástrico, cerca de 60% dos casos apresentam-se com doença disseminada no momento do diagnóstico(1), que varia com o tipo histológico, sendo a invasão direta e a carcinomatose peritoneal as mais comuns. A disseminação hematogênica é menos freqüente, ocorrendo em 40% dos casos para fígado, 20% para pulmão e 10% para ossos(2). As metástases pulmonares ocorrem, preferencialmente, pela via hematogênica. O envolvimento linfático (linfangite carcinomatosa) e o comprometimento brônquico são menos comuns, principalmente o último(3). É apresentado o caso de um paciente com massa metastática pulmonar de carcinoma gástrico simulando neoplasia primária de pulmão. Este é o primeiro caso relatado da América Latina (Lilacs).
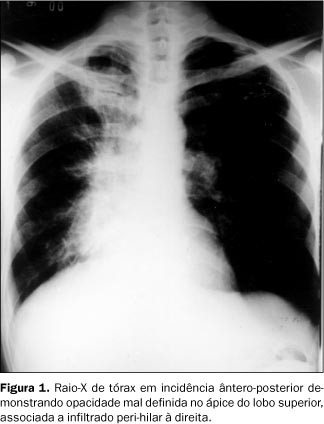
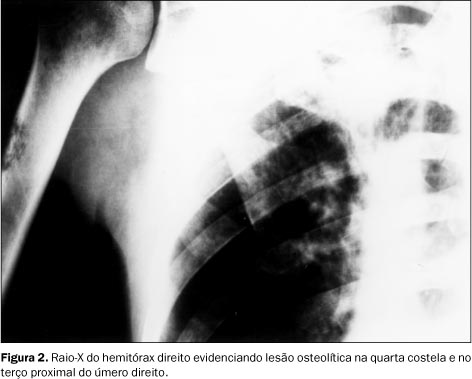
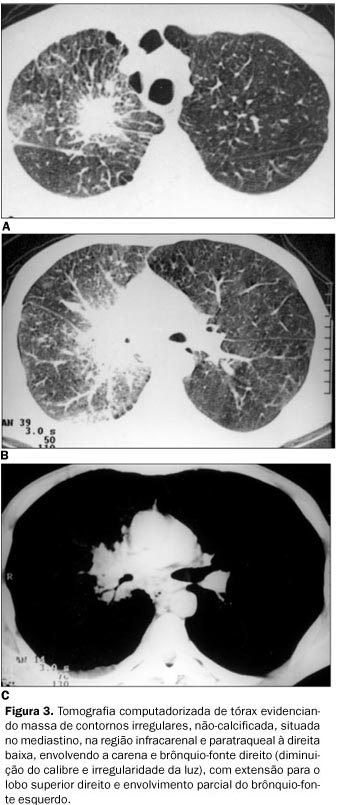
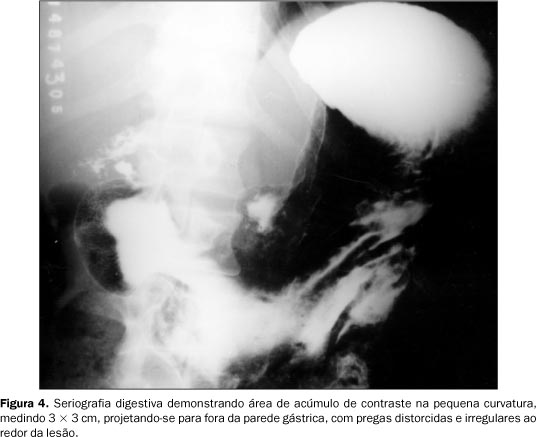
RELATO DO CASO Paciente do sexo masculino, 47 anos de idade, relatando dispnéia aos médios esforços, com piora progressiva nos últimos meses e emagrecimento de 7 kg em quatro meses. História pregressa de epigastralgia de início há 20 anos, sem irradiação, com piora após ingesta de alimentos e melhora após uso de antiácidos. Tabagista de 30 cigarros ao dia por 40 anos e ingerindo álcool com moderação. Ao exame físico apresentava-se emagrecido e hipocorado (+/IV), além de linfonodomegalia supraclavicular bilateral e axilar direita, com linfonodos endurecidos à palpação. O abdome era doloroso à palpação superficial e profunda. A inspeção dos membros mostrava baqueteamento digital. Foi realizada punção aspirativa de linfonodo axilar direito, sendo o resultado positivo para malignidade e compatível com adenocarcinoma pouco diferenciado. O estudo radiográfico de tórax demonstrou massa mal definida de lobo superior direito, com infiltrado peri-hilar à direita (Figura 1). Observou-se também lesão osteolítica na quarta costela e no terço proximal do úmero direito (Figura 2). A tomografia computadorizada (TC) de tórax evidenciou massa de contornos irregulares, não-calcificada, localizada no lobo superior do pulmão direito, envolvendo a carena e o brônquio-fonte direito, com diminuição do calibre e irregularidade da luz deste. Havia ainda estenose do segmento distal da artéria pulmonar direita e espessamento irregular do interstício axial à direita, compatíveis com neoplasia primária de pulmão e com linfangite carcinomatosa ao seu redor (Figura 3). Foi, posteriormente, submetido a estudo radiográfico contrastado do estômago para investigação das queixas abdominais, que mostrou ulceração na pequena curvatura, medindo 3 × 3 cm, apresentando características de malignidade (Figura 4). A endoscopia digestiva alta (EDA) confirmou os achados do exame radiográfico. A biópsia gástrica evidenciou mucosa infiltrada por células neoplásicas isoladas, de citoplasma escasso e microvacuolado, com núcleos ovóides, cromatina grumosa e nucléolos evidentes, compatível com adenocarcinoma gástrico pouco diferenciado, ulcerado e invasor.
Devido ao aspecto bastante característico de neoplasia pulmonar primária encontrada pelos métodos de imagem e haver um diagnóstico histológico de câncer gástrico, foi solicitada fibrobroncoscopia com biópsia transbrônquica, que demonstrou árvore brônquica direita com lesão de aspecto infiltrativo, endurecida, hiperemiada, com estenose quase completa de brônquios segmentares, bem como invasão da carena e traquéia distal. Ao exame histopatológico foram identificadas, no interior de vasos, células com núcleos atípicos, hipercromáticos e citoplasma vacuolizado, por vezes deslocando o núcleo para a periferia, cujo aspecto era sugestivo de adenocarcinoma. As características celulares foram consideradas como sendo semelhantes às da biópsia gástrica, confirmando-se o diagnóstico de metástase pulmonar. O paciente evoluiu com piora do estado geral e óbito no 50º dia de internamento.
DISCUSSÃO O câncer gástrico, apesar do decréscimo na prevalência observado nas últimas quatro décadas, ocupa o segundo lugar em número de óbitos no mundo (11,34%)(4,5) e também no Brasil (9,39%)(6). Incide mais freqüentemente entre 50 e 70 anos de idade(1,5,7¾9), principalmente no sexo masculino (relação homens:mulheres é de 2:1)(2). O tipo histológico mais comum é o adenocarcinoma (85¾90% dos casos), seguido por linfoma (4¾8%) e sarcoma (2%). Os principais sítios são o piloro e antro (30¾65%), corpo (40%), fundo e cárdia (20¾40%). O envolvimento gástrico difuso ocorre em 10% dos casos. Nos últimos anos tem havido aumento progressivo na incidência de câncer gástrico na região do fundo e cárdia(2,10,11). O diagnóstico por imagem do câncer gástrico pode ser feito pelo estudo radiográfico contrastado com duplo contraste, que apresenta sensibilidade de 96%, semelhante ao da EDA com biópsia, embora não forneça a profundidade da invasão mural e a extensão da disseminação metastática. Os aspectos radiológicos clássicos observados são a presença de área de acúmulo de contraste de contornos irregulares ou aspecto nodular, a qual se projeta para dentro da parede gástrica; pregas gástricas distorcidas ou espessadas, não-convergentes e que não alcançam o nicho ulceroso; presença do menisco de Carman-Kirklin. Em fase mais avançada, observam-se estreitamento e rigidez do corpo e antro gástrico, produzindo o aspecto de linite plástica(10,12). No caso do paciente descrito foi identificada, em exame radiográfico contrastado, uma lesão que se projetava para fora da parede gástrica, porém com pregas amputadas e distorcidas ao redor, sugerindo lesão maligna. A busca por metástases desempenha papel preponderante no estadiamento e conseqüente manejo do paciente com câncer gástrico, uma vez que o achado de lesões malignas locais precoces é raro. A disseminação por extensão direta através da parede gástrica para órgãos adjacentes afeta principalmente o baço, o pâncreas, as vias biliares, o fígado e o colo transverso. O duodeno está comprometido em 25% dos casos distais. A disseminação para linfonodos ocorre quando o tumor invade o sistema linfático da parede gástrica. Primeiramente atinge os linfonodos regionais e, posteriormente, aqueles situados a distância, como nas regiões supraclavicular esquerda (Virchow) e umbilical. Este fenômeno é observado em 36% dos carcinomas diferenciados e em 44% das neoplasias infiltrativas difusas. A TC abdominal e, mais recentemente, a ultra-sonografia endoscópica (USE) têm grande importância na detecção da invasão da parede gástrica e aos órgãos adjacentes, além do comprometimento dos linfonodos abdominais. Quando analisada a profundidade da lesão, os achados da USE foram concordantes em 92% dos casos com os achados anatomopatológicos pós-operatórios, enquanto os achados tomográficos foram concordantes em 42%. A avaliação do envolvimento dos linfonodos locais foi concordante em 78% dos casos com a USE e em 48% com a TC. Portanto, a USE vem cada vez mais destacando-se como um importante avanço no estadiamento do câncer gástrico. A carcinomatose peritoneal é a forma mais comum de metástase a distância do carcinoma gástrico, especialmente nos pacientes com envolvimento da serosa e não dos linfonodos regionais. Pode ser observada em até 50% dos pacientes que se apresentam com doença metastática e em 16% dos pacientes sem evidência de doença disseminada, porém com estudo citológico do peritônio durante a cirurgia. A metástase para ovário (tumor de Krukenberg) freqüentemente ocorre durante a disseminação peritoneal(2). Por ser a disseminação hematogênica pelo sistema portal o principal meio de formação de metástases, o fígado é o primeiro a ser acometido, apresentando lesões em 40% dos casos. O pulmão é sítio de metástases em 20% dos pacientes, sendo a via hematogênica o principal meio de disseminação. Os estudos de imagem mostram múltiplos nódulos periféricos, de tamanhos variáveis e contornos bem definidos. No caso descrito foi observada massa pulmonar envolvendo brônquios, caracterizando metástase endobronquial, que é observada em 2% dos pacientes com doença maligna sólida, principalmente de origem em rins, mama e colorretal. Este aspecto impossibilita a diferenciação entre metástase e tumor primário de pulmão, por apresentarem o mesmo quadro radiológico. O diagnóstico é feito por meio de exame anatomopatológico. Deve-se lembrar, ainda, que os ossos são acometidos em 10% dos casos, usualmente com padrão osteolítico, como observado no nosso caso, podendo também ser misto; porém, já foram relatados casos com metástase osteoblástica e reação periosteal espiculada. O cérebro é acometido em menos de 1% dos casos, apresentando-se em 55% deles com múltiplas lesões. Raramente rins e adrenais são envolvidos(2,3,13,14). A taxa geral de sobrevida de pacientes com câncer gástrico em cinco anos varia muito, podendo chegar a 60¾100% em casos precocemente tratados por gastrectomia radical, acompanhada ou não de quimioterapia, ou 7¾31% em tumores avançados após o mesmo procedimento(1,7¾9). O paciente descrito apresentava estádio clínico IV, evoluindo para o óbito pouco tempo após o diagnóstico.
REFERÊNCIAS 1.Wile AG, Hourani L, Schell MJ. The contributions of patient factors, physician delay, and tumor biology to the outcome of gastric cancer. Am Surg 1993;59:850¾4. [ ] 2.Bruckner HW, Kondo T, Kondo K. Neoplasms of the stomach. In: Holland JF, Bast RC, Morton DL, Frei E III, Kufe DW, Weichselbaum RR, eds. Cancer medicine. Baltimore: Williams & Wilkins, 1997:1879¾22. [ ] 3.Libshitz HI. Pulmonary metastatic disease. In: Freundlich IM, Bragg DG, eds. Radiologic approach to diseases of chest. Baltimore: Williams & Wilkins, 1997:561¾75. [ ] 4.Fuchs CS, Mayer RJ. Gastric carcinoma. N Engl J Med 1995;333:32¾41. [ ] 5.Botet JF, Lightdale CJ, Zauber AG, et al. Preoperative staging of gastric cancer: comparison of endoscopic US and dynamic CT. Radiology 1991; 181:426¾32. [ ] 6.Ministério da Saúde/Instituto Nacional do Câncer. Estimativa da incidência e mortalidade por câncer no Brasil, Datasus 2000. (http://www.datasus. gov.br [ ] 7.Sigon R, Canzonieri V, Cannizzaro R, et al. Early gastric cancer: diagnosis, surgical treatment and follow-up of 45 cases. Tumori 1998;84:547¾51. [ ] 8.Sue-Ling HM, Johnston D, Martin IG, et al. Gastric cancer: a curable disease in Britain. BMJ 1993;307:591¾7. [ ] 9.Tabuenca AD, Aitken DR, Ihde JK, Smith J, Garberoglio C. Factors influencing survival in advanced gastric cancer. Am Surg 1993;59:855¾9. [ ] 10.Levine MS, Laufer I. The upper gastrointestinal series at a crossroads. AJR 1993;161:1131¾7. [ ] 11.Meyers WC, Damiano RJ Jr, Rotolo FS, Postlethwait RW. Adenocarcinoma of the stomach: changing patterns over the last 4 decades. Ann Surg 1987;205:1¾8. [ ] 12.Gore RM, Levine MS, Ghahremani GG, Miller FH. Gastric cancer: radiologic diagnosis. Radiol Clin North Am 1997;35:311¾29. [ ] 13.Narváez JA, Narváez J, Clavaguera MT, Juanola X, Valls C, Fiter J. Bone and skeletal muscle metastases from gastric adenocarcinoma: unusual radiographic, CT and scintigraphic features. Eur Radiol 1998;8:1366¾9. [ ] 14.York JE, Stringer J, Ajani JA, Wildrick DM, Gokaslan ZL. Gastric cancer and metastasis to the brain. Ann Surg Oncol 1999;6:771¾6. [ ]
* Trabalho realizado no Serviço de Radiologia do Hospital de Clínicas da Universidade Federal do Paraná (UFPR), Curitiba, PR. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554