Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 36 nº 6 - Nov. / Dez. of 2003
Vol. 36 nº 6 - Nov. / Dez. of 2003
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Maria Lúcia de Oliveira Santos, Edson Marchiori, Alberto Domingues Vianna, Arthur Soares Souza Jr., Heleno Pinto de Moraes |
|
|
Descritores: Opacidade em vidro fosco, Pulmões, Tomografia computadorizada de alta resolução |
|
|
Resumo: IIIProfessor Adjunto de Radiologia da Faculdade de Medicina de São José do Rio Preto (Famerp), SP
INTRODUÇÃO Opacidade em vidro fosco, ou atenuação em vidro fosco, é um aspecto descrito na tomografia computadorizada de alta resolução (TCAR) dos pulmões, no qual ocorre aumento do coeficiente de atenuação do parênquima, com preservação das marcas broncovasculares(1,2). Pode ser determinado por preenchimento ou colapso parcial dos alvéolos, por espessamento intersticial, por aumento do volume sanguíneo capilar, ou por expiração normal. Pode vir acompanhado de broncograma aéreo, o que muitas vezes leva a confundir com áreas de consolidação; porém, o que o diferencia destas é a identificação das marcas vasculares na opacidade em vidro fosco(1). Apesar de ser um aspecto freqüentemente observado, é, na maior parte das vezes, inespecífico, mas, quando associado com os dados clínicos e com outros achados tomográficos, pode sugerir um diagnóstico específico, bem como ser útil no acompanhamento evolutivo de doenças, além de servir de referência para o cirurgião ou para o broncoscopista na escolha do local para a realização de biópsias ou de lavado broncoalveolar(1). Atualmente, considera-se que este padrão possa ser encontrado nas fases agudas ou crônicas de doenças que comprometem o interstício e/ou os alvéolos das mais variadas naturezas. A extensão, distribuição, forma de apresentação e associação com outros achados tomográficos são condições que, quando associadas à clínica, podem caracterizar doenças específicas em determinadas fases do seu curso. No presente estudo foram analisadas as TCAR de 62 pacientes com doenças pulmonares difusas de 14 etiologias diferentes, nas quais o padrão em vidro fosco foi o achado principal, sendo estabelecida a correlação anatomopatológica por meio de biópsias a céu aberto ou de necropsias. Os objetivos deste trabalho são discutir as principais doenças que apresentam opacidades em vidro fosco como achado único ou predominante, o significado deste achado e a sua associação com outros padrões tomográficos, e correlacionar estes aspectos com o seu substrato anatomopatológico.
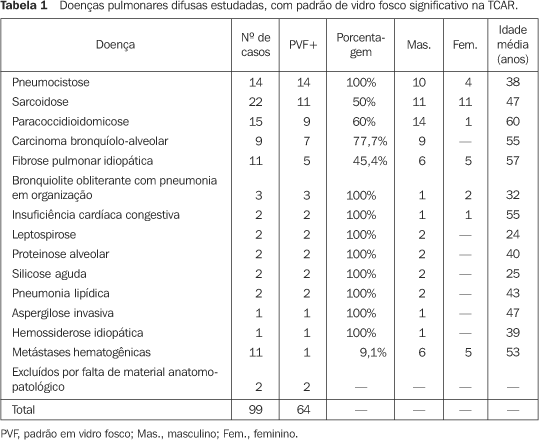
MATERIAIS E MÉTODOS Neste trabalho foram estudadas, retrospectivamente, as TCAR de tórax de 64 pacientes que apresentavam opacidade em vidro fosco. Eles foram selecionados de um grupo de 213 pacientes submetidos a TCAR para avaliação de doenças pulmonares difusas, nas quais opacidade em vidro fosco eventualmente é um achado expressivo ou predominante, e que obtiveram comprovação diagnóstica por meio de exames anatomopatológicos, por correlação clínico-radiológica ou por resposta terapêutica adequada. Estes casos foram reunidos aleatoriamente dos arquivos de ensino de diversas instituições dos estados do Rio de Janeiro e de São Paulo. Foram selecionados os pacientes que apresentavam opacidade em vidro fosco como achado único ou como achado significativo, mesmo quando associado a outras alterações. Não foram considerados aqueles exames que apresentavam discutíveis áreas com este padrão, de permeio a outras lesões de maior importância, ou os casos em que os critérios de comprovação diagnóstica eram passíveis de questionamento. Dos 213 casos, foram selecionados 64 pacientes com doenças pulmonares difusas e que apresentavam opacidade em vidro fosco na TCAR (30,4%), correspondendo a 16 diferentes doenças. Dois desses 64 pacientes — um com pneumonia intersticial descamativa e o outro com alveolite alérgica extrínseca — foram excluídos porque não se obteve o material anatomopatológico para correlação. Dessa forma, o estudo final foi realizado com as TCAR de 62 pacientes, correspondendo a 14 diferentes doenças, das quais se obteve material anatomopatológico em quantidade e qualidade adequadas para a correlação anátomo-radiológica de pelo menos um dos casos de cada. Foram encontrados 14 casos de pneumocistose, 11 de sarcoidose, nove de paracoccidioidomicose, sete de carcinoma bronquíolo-alveolar, cinco de fibrose pulmonar idiopática e três de bronquiolite obliterante com pneumonia em organização. Foram também observados dois casos de insuficiência cardíaca congestiva, de leptospirose, de proteinose alveolar, de silicose aguda e de pneumonia lipídica; e um caso de aspergilose invasiva, de hemossiderose idiopática e de metástases hematogênicas (Tabela 1).
Quanto à rotina de exame, o estudo retrospectivo, feito com exames provenientes de diferentes instituições, não permitiu uma padronização adequada dos protocolos utilizados. De maneira geral, todos os exames foram feitos com a técnica de alta resolução, que consiste em cortes finos, variando de 1 a 2 mm de espessura, com intervalos de 10 mm, dos ápices pulmonares até a cúpula diafragmática, com reconstruções utilizando-se o algoritmo de alta resolução espacial, com o paciente em posição supina. O registro dos casos foi feito em filme radiológico, com janelas variando de 1.200 a 1.600 UH e níveis entre -450 e -650 UH, dependendo do aparelho utilizado em cada instituição. Para o estudo do parênquima pulmonar, em nenhum dos casos foi empregado meio de contraste iodado. Não foi objetivo deste estudo a avaliação de alterações extraparenquimatosas (hilares, mediastinais ou pleurais).
RESULTADOS E DISCUSSÃO Pneumocistose Todos os 14 pacientes estudados com pneumocistose apresentavam opacidade em vidro fosco. A alta incidência deste padrão nas TCAR de pacientes com pneumonia por Pneumocystis carinii também foi relatada por vários autores(3,4). Onze pacientes apresentaram opacidade em vidro fosco com distribuição difusa, heterogênea, e três o padrão de pavimentação em mosaico (Figura 1A). O achado de opacidade em vidro fosco com distribuição difusa está de acordo com vários autores(3,5). Com relação à pavimentação em mosaico, no nosso estudo houve concordância com Primack e Müller(5) e Pereira et al.(4), que também encontraram pequeno porcentual deste aspecto, diferindo, entretanto, de McGuinness(6), que relatou alta incidência de pavimentação em mosaico na pneumonia por P. carinii. Em seis dos nossos pacientes o diagnóstico foi estabelecido em função dos achados clínicos, associados à resposta à terapêutica específica. Viegas et al.(7) concluíram que, nos pacientes com quadro típico de pneumonia por P. carinii, o diagnóstico clínico constitui uma alternativa eficaz, quando há dificuldade de realização do exame histopatológico. No nosso estudo, os achados histológicos foram a presença de material espumoso contendo parasitos no interior de alvéolos, e alguns septos espessados por edema e elementos celulares (Figura 1B), de acordo com o descrito na literatura(3,6). Sarcoidose Neste estudo foram observadas opacidades em vidro fosco em 11 (50%) dos 22 pacientes com sarcoidose. Brauner et al.(8) observaram este padrão em 75% dos seus casos. Em dez de nossos casos houve a apresentação esparsa pelo parênquima, e em apenas um deles a forma difusa. No caso com distribuição difusa e em cinco dos casos com distribuição esparsa estavam presentes micronódulos, cissuras nodulares, nódulos subpleurais e espessamento nodular do interstício axial (Figura 2A). Achados semelhantes a estes também foram relatados na literatura(8-10). Nos pacientes em que foi possível a realização do estudo anatomopatológico, foram observados granulomas com distribuição perilinfática, sendo que, nas áreas correspondentes às opacidades em vidro fosco, havia também granulomas no interstício intralobular (Figura 2B), o que está de acordo com a literatura(8-10). Paracoccidioidomicose Opacidades em vidro fosco foram encontradas em nove (60%) dos 15 pacientes estudados com paracoccidioidomicose, um porcentual maior do que o encontrado por Funari et al.(11) (34%) e Kauer(12) (32,1%), porém bem próximo dos relatados por Marchiori et al.(13) (61,5%) e Muniz et al.(14) (66,7%). As opacidades em vidro fosco distribuíram-se aleatoriamente em seis casos, em um predominando nos dois terços superiores e em dois, nos dois terços inferiores, sendo que em um predominaram nas regiões posteriores. Espessamento de septos interlobulares associado a opacidades em vidro fosco foi observado em sete casos (46%), em geral pouco expressivos, em discordância com os altos porcentuais descritos na literatura(12-14). Áreas de atenuação em vidro fosco relacionadas a enfisema e distorção parenquimatosa foram observadas em apenas dois casos (Figura 3A). Os estudos anatomopatológicos mostraram infiltrado inflamatório nos septos alveolares, além de áreas de fibrose (Figura 3B). Foi também observado que material com presença de exsudato intra-alveolar tipo broncopneumônico correspondia à área de consolidação visualizada na TCAR. Estes achados são semelhantes aos relatados na literatura(15). Carcinoma bronquíolo-alveolar Neste trabalho, as opacidades em vidro fosco observadas em sete pacientes com carcinoma bronquíolo-alveolar ocorreram nas formas difusas da doença. Estes achados são semelhantes aos encontrados por Moreira et al.(16) e Akira et al.(17), mas diferem dos descritos por Jang et al.(18), que observaram opacidades em vidro fosco como aspecto mais freqüente, porém na forma focal do carcinoma bronquíolo-alveolar. Ainda segundo Jang et al.(18), dos quatro pacientes com áreas focais em vidro fosco, dois apresentavam consolidação associada, o que, no presente trabalho, foi encontrado em três casos, levando à suspeição da presença da forma mucinosa do carcinoma bronquíolo-alveolar. A pavimentação em mosaico, descrita por Tan e Kuzo(19), foi encontrada em quatro dos nossos casos (Figura 4A). Segundo Marchiori et al.(20,21), a pavimentação em mosaico é dada pela ocupação parcial do lúmen alveolar por células tumorais ou muco, associada a espessamento dos septos interlobulares, por linfangite. Este aspecto também foi observado por Kobayashi et al.(22), ao descreverem opacidades em vidro fosco na sua apresentação difusa.
Os estudos histológicos demonstraram a presença de células tumorais revestindo os septos alveolares, e de muco no interior dos alvéolos, além de linfangite nos septos interlobulares (Figuras 4B e 4C), o que está consoante com a literatura(19-22). Fibrose pulmonar idiopática Cinco dos 11 pacientes com fibrose pulmonar idiopática apresentaram opacidades em vidro fosco na TCAR. O aspecto tomográfico encontrado foi o de opacidades em vidro fosco ocupando preferencialmente as porções posteriores e subpleurais dos pulmões, vistas de permeio a áreas císticas de paredes relativamente espessas, compartilhadas, formando camadas empilhadas nas regiões subpleurais, compatíveis com faveolamento (Figura 5A), além de outras evidências de fibrose (distorção arquitetural, bronquiolectasias e áreas de faveolamento). Reticulado intralobular e espessamento septal foram observados junto às áreas de opacidade em vidro fosco em três casos. O estudo histológico mostrou extenso comprometimento intersticial com espessamento de septos interlobulares e alveolares, por infiltração de fibroblastos, além de bronquiolectasias e faveolamento (Figura 5B), como descrito na literatura(23). Bronquiolite obliterante com pneumonia em organização Três casos de bronquiolite obliterante com pneumonia em organização foram observados. As opacidades em vidro fosco acometiam principalmente os lobos inferiores, com distribuição subpleural, esparsa, salteada; elas estiveram associadas a áreas de consolidação e ao espessamento de septos interlobulares (Figura 6A). Dilatação brônquica e áreas de vidro fosco de aspecto triangular subpleural foram observadas em todos os casos. Akira et al.(24) descreveram três padrões radiográficos para a bronquiolite obliterante com pneumonia em organização: o infiltrado reticular, difuso, periférico, de localização subpleural, a forma pneumônica e a forma nodular localizada. As paredes brônquicas espessadas, com luz dilatada, na presença de consolidações, além da presença de infiltrados alveolares com formato triangular e base na superfície pleural, também foram descritos por outros autores(25,26). Histologicamente, a inflamação dos septos alveolares, a descamação celular intra-alveolar e a presença de tecido de granulação no espaço aéreo terminal caracterizam a bronquiolite obliterante com pneumonia em organização e são responsáveis pelo padrão em vidro fosco na TCAR(27,28). Os estudos histopatológicos obtidos demonstraram a presença de pneumonia intersticial com áreas de organização intra-alveolar e bronquiolite obliterante secundária à presença de pólipos no interior dos brônquios, obstruindo-os parcialmente (Figura 6B), o que está consoante com a literatura(27,28). Insuficiência cardíaca congestiva Nos dois pacientes com insuficiência cardíaca congestiva foram observadas opacidades em vidro fosco de comprometimento difuso, com predominância nos lobos inferiores. Aumento das dimensões cardíacas, espessamento dos septos interlobulares e derrame pleural foram achados associados (Figura 7A). Segundo Storto et al.(29), das alterações encontradas na TCAR de sete pacientes com edema pulmonar, as opacidades em vidro fosco foram as mais freqüentes, seguidas do espessamento dos septos interlobulares e espessamento intersticial peribroncovascular. Os achados anatomopatológicos mostraram alvéolos parcialmente ocupados e septos interlobulares espessados uniformemente, ambos por edema (Figura 7B). Segundo Storto et al.(29), o espessamento de septos interlobulares secundário ao edema pulmonar ocorre por acúmulo de líquido no interstício, com ou por disseminação uniforme e delicada. Quando é observado um aspecto nodular focal, geralmente está ocorrendo um aumento do calibre venoso intra-septal. Este aspecto não foi observado no presente trabalho. Leptospirose Os dois pacientes com leptospirose apresentaram opacidades em vidro fosco heterogêneas. Sua distribuição foi predominantemente periférica, subpleural e nas regiões póstero-inferiores dos pulmões (Figura 8A). A associação com áreas de consolidação pôde ser vista em um caso. O espessamento dos septos interlobulares não foi observado. Estes achados são concordantes com os encontrados por Marchiori e Müller(30). Segundo esses autores, na análise dos seus cinco casos também foram encontrados nódulos centrolobulares, nódulos do espaço aéreo e derrame pleural, não observados no presente trabalho. Anatomopatologicamente, são descritas superfícies de corte hemorrágicas, com lesões que sugerem infartos hemorrágicos, além de petéquias na superfície pleural. Microscopicamente, são observados congestão pulmonar, focos de hemorragia alveolar e intersticial e edema pulmonar(31). O estudo anatomopatológico em um dos casos deste estudo demonstrou ocupação alveolar maciça e intersticial esparsa, por sangue (Figura 8B), concordando com a literatura(31). Proteinose alveolar Analisadas as TCAR dos dois pacientes com proteinose alveolar, foi observada a presença de opacidades em vidro fosco em ambas, associadas ao espessamento de septos interlobulares, configurando o padrão de pavimentação em mosaico, de distribuição bilateral (Figura 9A). Estes aspectos foram descritos na literatura como achados freqüentes na TCAR na proteinose alveolar(1,32), tendo sido a pavimentação em mosaico, inicialmente, considerada como um padrão característico da doença. O estudo anatomopatológico mostrou a presença de material lipoprotéico, corando-se pelo ácido periódico de Schiff (PAS positivo), no interior dos alvéolos (Figura 9B), conforme descrito na literatura(32,33). Silicose aguda (silicoproteinose) Foram estudados dois pacientes com silicoproteinose, ambos jateadores de areia. As opacidades em vidro fosco se deviam à presença de nódulos de pequenas dimensões, com localização centrolobular, mas com tendência a confluência, predominantemente nos lobos inferiores. Em um caso foi observada uma maior confluência destes nódulos, com a formação de opacidade em vidro fosco e de consolidação com broncograma aéreo nos segmentos posteriores e inferiores dos pulmões, mais evidentes à esquerda. De acordo com a literatura, opacidade em vidro fosco ocorre quando o espaço aéreo encontra-se ocupado por material protéico(34), muito semelhante àquele observado na proteinose alveolar, podendo assumir, tomograficamente, a forma de nódulos ou de opacidades com atenuação em vidro fosco(35). O exame anatomopatológico obtido de um paciente, neste estudo, demonstrou a presença de material protéico, PAS positivo, no interior dos alvéolos, de localização predominantemente peribronquiolar, semelhante ao descrito na literatura(35). Pneumonia lipídica Foram estudados dois pacientes com pneumonia lipídica. Em um deles (paciente de dois anos de idade, que aspirou óleo mineral), as opacidades em vidro fosco foram observadas de forma difusa, bilateral e simétrica, com áreas de confluência ocupando tanto a cortical como a medular dos pulmões, contendo septos interlobulares espessados de permeio (pavimentação em mosaico). No outro caso (paciente de 83 anos de idade, com história de aspiração crônica de óleo de rícino), o padrão em vidro fosco foi observado acompanhando áreas de consolidação isoladas, distribuídas esparsamente pelas regiões posteriores dos pulmões, com predominância à direita. Septos espessados foram observados junto às opacidades em vidro fosco. Segundo Wheeler et al.(36), a TCAR é o exame de escolha para o diagnóstico desta doença, permitindo que seja observada a medida da densidade das opacidades, que, se negativa, caracteriza o acúmulo de lipídios. Em um de nossos casos foram encontradas densidades negativas. Segundo Franquet et al.(37), a variação na distribuição das opacidades observadas em dois de seus pacientes seria conseqüência das múltiplas aspirações e alterações de postura do corpo, o que é possível transportar para um dos casos deste estudo. No paciente pediátrico estudado neste trabalho os cortes histológicos demonstraram alvéolos com paredes espessadas por material celular mono e polimorfonuclear, contendo vacúolos de gordura no interior. Áreas de parênquima preservado eram observadas de permeio, separadas por septos interlobulares espessados. Aspergilose invasiva No caso de aspergilose angioinvasiva foram observadas opacidades em vidro fosco circundando irregularmente um nódulo homogêneo (sinal do halo) situado no lobo inferior esquerdo (Figura 10A). Kuhlman et al.(38) relataram que diagnósticos precoces de aspergilose invasiva puderam ser feitos ao observar o sinal do halo em pacientes com leucemia. Eles correlacionaram este achado tomográfico com a presença de hemorragia ou infartos hemorrágicos circundando as lesões parenquimatosas pulmonares pelo parasito. O estudo anatomopatológico mostrou alvéolos preenchidos por fibrina e hemorragia, circundando uma área necrótica formada por hifas e envolta por células inflamatórias (Figura 10B), o que está de acordo com a literatura(1,38). Hemossiderose idiopática Foi estudado um paciente com hemossiderose idiopática, com opacidades em vidro fosco comprometendo difusa e simetricamente os pulmões, com predomínio nos lobos inferiores. Brônquios levemente dilatados e espessamento dos septos interlobulares também foram vistos. Não encontramos, na literatura consultada, relato de achados da hemossiderose na TCAR. O estudo anatomopatológico mostrou hemorragia alveolar maciça. Havia, também, espessamento do interstício, com macrófagos contendo hemossiderina, semelhante ao descrito na literatura(39). Metástases hematogênicas No caso de metástases hematogênicas, as opacidades em vidro fosco predominaram ao redor dos nódulos, que tinham diferentes dimensões. Estas opacidades eram mais evidentes junto aos nódulos maiores, embora nódulos menores também apresentassem halo em vidro fosco (Figura 11A). Este aspecto (sinal do halo) foi relatado por Hirakata et al.(40), como eventualmente encontrado circundando nódulos metastáticos. O estudo anatomopatológico revelou ocupação alveolar por hemorragia ao redor dos nódulos neoplásicos (Figura 11B). Aspectos particulares do padrão em vidro fosco a) Pavimentação em mosaico O padrão em pavimentação em mosaico foi encontrado no presente trabalho em quatro diferentes doenças: carcinoma bronquíolo-alveolar (quatro casos), pneumocistose (três casos), em um caso de pneumonia lipídica e em outro de proteinose alveolar. À semelhança do descrito na literatura(19,41-43), que desfaz a idéia de ser este padrão patognomônico da proteinose alveolar(43), a pavimentação em mosaico tem sido descrita em um número cada vez maior de doenças, demonstrando assim a sua inespecificidade. b) Sinal do halo O sinal do halo foi encontrado em três diferentes doenças, cujo substrato anatomopatológico correspondeu à hemorragia (no caso de metástase de tumor renal e na aspergilose invasiva) e ao acúmulo de material lipídico na pneumonia lipídica. A presença de hemorragia configurando o sinal de halo foi relatada exaustivamente na literatura(28,44-46), incluindo causas infecciosas e não-infecciosas. Não encontramos, no entanto, relato do sinal do halo na pneumonia lipídica. c) Nódulos centrolobulares Neste estudo, dois casos de silicoproteinose apresentaram-se como nódulos centrolobulares na TCAR. Este padrão também foi descrito na literatura na pneumonia por hipersensibilidade(47), na pneumonia intersticial descamativa(47) e na proteinose alveolar na infância(48). Principais substratos anatomopatológicos causadores do padrão em vidro fosco Sangue foi o substrato anatomopatológico do padrão em vidro fosco em cinco pacientes, correspondendo a quatro doenças: leptospirose, aspergilose angioinvasiva, hemossiderose e metástases hematogênicas. Nos casos de carcinoma bronquíolo-alveolar, o padrão em vidro fosco se deveu tanto ao revestimento dos septos alveolares por células neoplásicas quanto ao acúmulo de muco nos espaços alveolares. Fibrose como causa de padrão em vidro fosco foi observada em três doenças (sarcoidose, paracoccidioidomicose e fibrose pulmonar idiopática), sempre acompanhada de outros sinais, como faveolamento, bronquiectasias ou distorção arquitetural, indicando cronicidade. Na sarcoidose e na paracoccidioidomicose foi observada, também, infiltração celular inflamatória. Outros substratos menos comuns para o padrão em vidro fosco foram a presença de material lipoprotéico, PAS positivo, observado nos casos de silicose aguda e de proteinose alveolar, vacúolos de gordura na pneumonia lipídica, parasitos e muco na pneumonia por P. carinii, edema na insuficiência cardíaca congestiva, e tecido de granulação configurando pólipos intraluminais associados a pneumonia intersticial na bronquiolite obliterante com pneumonia em organização. Em conclusão, opacidades em vidro fosco são um achado inespecífico, podendo ser encontradas em doenças de diversas etiologias, sendo resultado do comprometimento intersticial, alveolar, ou de ambos, tanto em condições agudas como crônicas, podendo se apresentar isoladamente ou sob a forma de pavimentação em mosaico, sinal do halo, ou nódulos centrolobulares. Quando associadas a alterações intersticiais do parênquima pulmonar, podem ser muito úteis no diagnóstico específico e na avaliação da fase ou do prognóstico da doença.
REFERÊNCIAS 1. Collins J, Stern EJ. Ground-glass opacity at CT: the ABCs. AJR 1997;169:355-67. [ ] 2. Remy-Jardin M, Remy J, Deffontaines C, Duhamel A. Assessment of diffuse infiltrative lung disease: comparison of conventional CT and high-resolution CT. Radiology 1991;181:157-62. [ ] 3. Gruden JF, Huang L, Turner J, et al. High-resolution CT in the evaluation of clinically suspected Pneumocystis carinii pneumonia in AIDS patients with normal, equivocal, or nonspecific radiographic findings. AJR 1997;169:967-75. [ ] 4. Pereira CIGS, Marchiori E, Souza Jr AS. Pneumocistose no paciente com síndrome da imunodeficiência adquirida: avaliação pela tomografia computadorizada de alta resolução do tórax. Rev Imagem 2001;23:91-9. [ ] 5. Primack SL, Müller NL. High resolution computed tomography in acute diffuse lung disease in the immunocompromised patient. Radiol Clin North Am 1994;32:731-44. [ ] 6. McGuinness G. Changing trends in the pulmonary manifestations of AIDS. Radiol Clin North Am 1997;35:1029-82. [ ] 7. Viegas C, MacGregor RR, Collman EG. Management of Pneumocystis carinii pneumonia in HIV-infected patients: empiric treatment versus microscopic confirmation. J Pneumologia 1997;23:61-5. [ ] 8. Brauner MW, Grenier P, Mompoint D, Lenoir S, Crémoux H. Pulmonary sarcoidosis: evaluation with high-resolution CT. Radiology 1989;172: 467-71. [ ] 9. Marchiori E, Melo ASA, Kavakama J, Teixeira GHM, Capone D. Sarcoidose: correlação da tomografia computadorizada de alta resolução com a anatomopatologia. Radiol Bras 2000;33:67-71. [ ] 10. Nishimura K, Itoh H, Kitaichi M, Nagai S, Izumi T. Pulmonary sarcoidosis: correlation of CT with histopathologic findings. Radiology 1993;189: 105-9. [ ] 11. Funari M, Kavakama J, Shikanai-Yasuda MA, et al. Chronic pulmonary paracoccidioidomycosis (South American blastomycosis): high-resolution CT findings in 41 patients. AJR 1999;173:59-64. [ ] 12. Kauer CL. Paracoccidioidomicose: tomografia computadorizada de alta resolução no estudo das alterações pleuropulmonares. (Tese de Doutorado). Porto Alegre: Universidade Federal do Rio Grande do Sul, 2000. [ ] 13. Marchiori E, Moraes HP, Muniz MAS, Santos MLO, Capone D. Paracoccidioidomicose: correlação da tomografia computadorizada de alta resolução com a anatomopatologia. Radiol Bras 2000; 33:333-40. [ ] 14. Muniz MAS, Marchiori E, Magnago M, Moreira LBM, Almeida Junior JG. Paracoccidioidomicose pulmonar: aspectos na tomografia computadorizada de alta resolução. Radiol Bras 2002;35:147-54. [ ] 15. Angulo-Ortega A, Pollak L. Paracoccidiodomycosis. In: Baker RD, ed. The pathologic anatomy of mycosis. Berlin: Springer-Verlag, 1971. [ ] 16. Moreira LBM, Marchiori E, Melo ASA, Magnago M, Muniz MAS, Irion K. Carcinoma bronquíolo-alveolar: aspectos na tomografia computadorizada de alta resolução. Radiol Bras 2002;35:7-14. [ ] 17. Akira M, Atagi S, Kawahara M, Iuchi K, Johkoh T. High-resolution CT findings of diffuse bronchioloalveolar carcinoma in 38 patients. AJR 1999;173: 1623-9. [ ] 18. Jang HJ, Lee KS, Kwon OJ, Rhee CH, Shim YM, Han J. Bronchioloalveolar carcinoma: focal area of ground-glass attenuation at thin-section CT as an early sign. Radiology 1996;199:485-8. [ ] 19. Tan RT, Kuzo RS. High-resolution CT findings of mucinous bronchioloalveolar carcinoma: a case of pseudopulmonary alveolar proteinosis. AJR 1997; 168:99-100. [ ] 20. Marchiori E, Kavakama J, Capelozzi VL, Vabo KA, Damato SD. "Pavimentação em mosaico": correlação da tomografia computadorizada de alta resolução com a anatomopatologia. Radiol Bras 2000; 33:169-73. [ ] 21. Marchiori E, Moreira LBM, Melo ASA, Capone D, Moraes HP. Carcinoma bronquíolo-alveolar: correlação da tomografia computadorizada de alta resolução com a anatomopatologia. Rev Imagem 2000;22:123-9. [ ] 22. Kobayashi T, Satoh K, Sasaki M, et al. Bronchioloalveolar carcinoma with widespread ground-glass shadow on CT in two cases. J Comput Assist Tomogr 1997;21:133-5. [ ] 23. Katzenstein ALA, Fiorelli RF. Nonspecific interstitial pneumonia/fibrosis. Histologic features and clinical significance. Am J Surg Pathol 1994;18: 136-47. [ ] 24. Akira M, Yamamoto S, Sakatani M. Bronchiolitis obliterans organizing pneumonia manifesting as multiple large nodules or masses. AJR 1998;170: 291-5. [ ] 25. Lee KS, Kullnig P, Hartman TE, Müller NL. Cryptogenic organizing pneumonia: CT findings in 43 patients. AJR 1994;162:543-6. [ ] 26. Machado DM, Marchiori E, Malheiros NR, et al. Bronquiolite obliterante com pneumonia em organização (BOOP) - relato de um caso. Radiol Bras 1994;27:239-43. [ ] 27. Nishimura K, Itoh H. High-resolution computed tomographic features of bronchiolitis obliterans organizing pneumonia. Chest 1992;102(1 Suppl.): 26S-31S. [ ] 28. Preidler KW, Szolar DM, Moelleken S, Tripp R, Schreyer H. Distribution pattern of computed tomography findings in patients with bronchiolitis obliterans organizing pneumonia. Invest Radiol 1996;31:251-5. [ ] 29. Storto ML, Kee ST, Golden JA, Webb WR. Hydrostatic pulmonary edema: high-resolution CT findings. AJR 1995;165:817-20. [ ] 30. Marchiori E, Müller NL. Leptospirosis of the lung: high-resolution computed tomography findings in five patients. J Thorac Imaging 2002;17:151-3. [ ] 31. Carvalho JEM, Marchiori ES, Silva JBG, Souza Netto BA, Tavares W, Paula AV. Comprometimento pulmonar na leptospirose. Rev Soc Bras Med Trop 1992;25:21-30. [ ] 32.Coulier B, Mailleux P, Mairesse M, Bachez P. Alveolar proteinosis; signs and prognosis using high-resolution computed tomography in 5 patients. JBR-BTR 1999;82:277-81. [ ] 33. Crocker HL, Pfitzner J, Doyle IR, Hague WM, Smith BJ, Ruffin RE. Pulmonary alveolar proteinosis: two contrasting cases. Eur Respir J 2000;15: 426-9. [ ] 34. Graham WGB. Silicosis. Clin Chest Med 1992;13: 253-67. [ ] 35. Marchiori E, Ferreira A, Müller NL. Silicoproteinosis: high-resolution CT and histologic findings. J Thorac Imaging 2001;16:127-9. [ ] 36. Wheeler PS, Stitik FP, Hutchins GM, Klinefelter HF, Siegelman SS. Diagnosis of lipoid pneumonia by computed tomography. JAMA 1981;245:65-6. [ ] 37. Franquet T, Giménez A, Bordes R, Rodriguez-Arias JM, Castella J. The crazy-paving pattern in exogenous lipoid pneumonia: CT-pathologic correlation. AJR 1998;170:315-7. [ ] 38. Kuhlman JE, Fishman EK, Siegelman SS. Invasive pulmonary aspergillosis in acute leukemia: characteristic findings on CT, the CT halo sign, and the role of CT in early diagnosis. Radiology 1985;157:611-4. [ ] 39. Theros EG, Reeder MM, Eckert JF. An exercise in radiologic-pathologic correlation. Radiology 1968; 90:784-91. [ ] 40. Hirakata K, Nakata H, Nakagawa T. CT of pulmonary metastases with pathological correlation. Semin Ultrasound CT MR 1995;16:379-94. [ ] 41. Hartman TE, Primack SL, Müller NL, Staples CA. Diagnosis of thoracic complications in AIDS: accuracy of CT. AJR 1994;162:547-53. [ ] 42. Murayama S, Murakami J, Yabuuchi H, Soeda H, Masuda K. "Crazy-paving appearance" on high resolution CT in various diseases. J Comput Assist Tomogr 1999;23:749-52. [ ] 43. Murch CR, Carr DH. Computed tomography appearances of pulmonary alveolar proteinosis. Clin Radiol 1989;40:240-3. [ ] 44. Brown MJ, Miller RR, Müller NL. Acute lung disease in the immunocompromised host: CT and pathologic examination findings. Radiology 1994; 190:247-54. [ ] 45. Curtis AMB, Smith GJW, Ravin CE. Air crescent sign of invasive pulmonary aspergillosis. Radiology 1979;133:17-21. [ ] 46. Primack SL, Hartman TE, Lee KS, Müller NL. Pulmonary nodules and the CT halo sign. Radiology 1994;190:513-5. [ ] 47. Engeler CE, Tashjian JH, Trenkner SW, Walsh JW. Ground-glass opacity of the lung parenchyma: a guide to analysis with high-resolution CT. AJR 1993;160:249-51. [ ] 48. Albafouille V, Sayegh N, De Coudenhouve S, et al. CT scan patterns of pulmonary alveolar proteinosis in children. Pediatr Radiol 1999;29:147-52. [ ]
Recebido para publicação em 20/3/2003
* Trabalho realizado no Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, e no Serviço de Radiodiagnóstico do Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554