Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 36 nº 5 - Set. / Out. of 2003
Vol. 36 nº 5 - Set. / Out. of 2003
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Flávio Augusto Prado Vasques, Antonio Fernandes Moron, Carlos Geraldo Viana Murta, Telma Regina Gonçalves, Francisco Herlânio da Costa Carvalho |
|
|
Descritores: Cordão umbilical, Área de secção transversa, Crescimento fetal |
|
|
Resumo: IIIDoutor em Medicina pela Unifesp/EPM, Professor Colaborador da Disciplina de Obstetrícia da Universidade Federal do Espírito Santo (UFES)
INTRODUÇÃO Este estudo objetivou verificar a correlação entre a área de secção transversa do cordão umbilical (ASTCU) com o crescimento fetal adequado, em gestações normais, tendo por objetivo principal o desenvolvimento de uma curva de normalidade para o crescimento do cordão umbilical da 20ª à 40ª semanas de gestação, correlacionando os dados obtidos com os clássicos parâmetros antropométricos fetais. Os primeiros trabalhos apresentados na literatura, correlacionando as alterações da espessura do cordão umbilical com o nascimento de fetos com evolução adversa ou morte fetal intra-útero, bem como outras alterações estruturais ou funcionais do funículo, resultando em anomalias fetais, surgiram isoladamente, como relatos de casos(1–5). Estudos que correlacionavam a espessura do cordão umbilical com afecções gestacionais diversas(6–10) foram apresentados posteriormente. Tais estudos(7,9,10) procuraram correlacionar o diâmetro do cordão à evolução de gestações normais e em gestações diabéticas, com achados significativos em relação ao diâmetro do cordão em relação às diferentes entidades mórbidas pesquisadas. Coube a Raio et al.(11,12) correlacionar, pioneiramente, a espessura do cordão umbilical, aferida por meio de sua área de secção transversa, ao crescimento fetal e desempenho perinatal, comparando o novo parâmetro aos clássicos parâmetros antropométricos fetais já utilizados e ao desempenho perinatal daqueles fetos que apresentam espessura funicular diminuída (cordões "finos"). Investigações a respeito da microscopia, fisiologia e patologia do cordão umbilical surgiram, então, procurando, por meio de características diversas, conhecer melhor a importância do funículo no desenvolvimento da prenhez(13–29). O advento da ultra-sonografia tridimensional(30,31) aclarou ainda mais o conhecimento sobre a estrutura e funções funiculares. Os primeiros trabalhos correlacionando a presença de cordões umbilicais "finos" à restrição do crescimento intra-uterino e mau desempenho perinatal dos recém-nascidos surgiram a partir das pesquisas de Raio et al.(11,12). Atualmente é consenso que o estudo ultra-sonográfico do cordão umbilical não se deva restringir à simples verificação do seu número de vasos e dopplerfluxometria da artéria umbilical, ante as importantes informações passíveis de se obter, pois as alterações da espessura do funículo surgem em fase anterior à diminuição ominosa do volume do líquido amniótico(12,32).
MATERIAIS E MÉTODOS Para o presente estudo foram adotados os seguintes critérios de inclusão: a) gestação única; b) idade gestacional maior que 20 semanas (data da última menstruação conhecida e ultra-som antes da 20ª semana); c) membranas amnióticas íntegras. Como critérios de exclusão (presença de qualquer um dos fatores) foram considerados: a) anomalias cromossômicas/congênitas; b) complicações da gravidez (de qualquer tipo); c) peso/tamanho inadequados do feto (peso abaixo do 10º percentil constatado ao exame ultra-sonográfico); d) anomalias do líquido amniótico (índice do líquido amniótico); e) anormalidade do fluxo umbilical. As pacientes foram examinadas e os seus dados incluídos apenas uma vez (estudo transversal). Após a constatação da normalidade fetal — quanto ao tamanho, peso e proporcionalidade corporal aferidos pelos parâmetros e relações classicamente utilizadas para este fim: diâmetro biparietal (DBP), circunferência craniana (CC), circunferência abdominal (CA), comprimento do fêmur (CF), relação CC/CA, relação CF/DBP, relação CF/CA —, e satisfeitos os critérios de inclusão e exclusão, procedia-se à aferição da área de secção transversa do cordão umbilical (Figura 1), em plano transversal, distando cerca de 2 cm de sua inserção abdominal, através de calibradores elípticos dos aparelhos ultra-sonográficos utilizados, perfazendo, cada examinador, o total de três diferentes medidas, para posterior verificação da observação intra-observador. Para a verificação da variação interobservador, foram realizadas a análise de variância (Anova) e a curva de dispersão dos valores (teste F). Foi aplicada a correlação não-paramétrica de Spearman para testar a correlação entre as medidas da ASTCU e os parâmetros antropométricos classicamente utilizados para avaliação da idade gestacional, estimativa do peso fetal e proporcionalidade corporal fetal. Adotamos o programa Statistical Package for Social Sciences (SPSS) para os cálculos estatísticos. Todas as pacientes foram devidamente esclarecidas e informadas, assinando termo de consentimento livre e esclarecido, elaborado segundo as normas do Comitê de Ética em Pesquisa da Universidade Federal de São Paulo/Escola Paulista de Medicina, que aprovou o projeto.
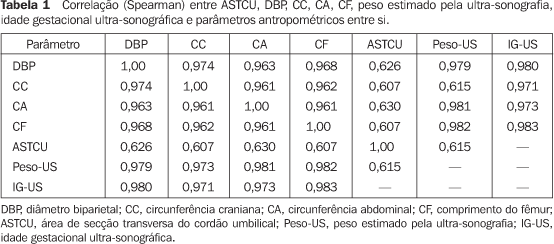
RESULTADOS Foram incluídas, neste estudo, 545 pacientes. A idade materna variou de 15 a 42 anos (média de 26,7 ± 4,8 anos). Em relação à paridade, 135 pacientes eram primigestas (28,1%), 242 pacientes eram secundigestas (44,4%), 129 pacientes eram tercigestas (23,7%) e 39 pacientes eram multigestas (quatro ou mais gestações, com o porcentual de 3,8%). Os resultados obtidos com as correlações (Spearman) entre a ASTCU e DBP, CC, CA, CF e peso estimado pela ultra-sonografia estão sumarizados na Tabela 1.
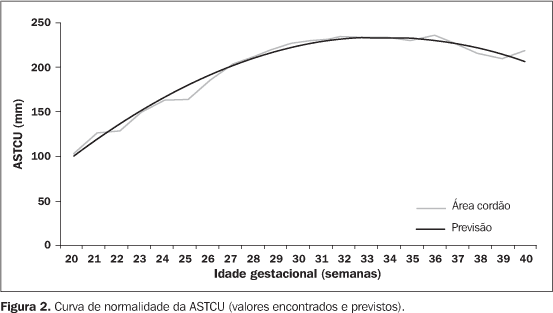
Quanto às aferições da ASTCU, o teste de Kolmogorov-Smirnov considerou normais os dados obtidos e a curva de normalidade da ASTCU foi então calculada por análise de regressão linear, que mostrou, pelo teste F (valor = 356,27), ser bem representativa da população estudada, contendo o valor real da ASTCU nos limites de confiança (95%) e mostrando, ainda, significância nos níveis de p < 0,01. A equação obtida para a ASTCU (y), de acordo com a idade gestacional (x), foi: A Figura 2 mostra a curva da ASTCU obtida com a previsão dos resultados. A curva apresenta valores crescentes até a 32ª semana de gestação, seguida de um patamar de estabilização até a 34ª semana e uma queda dos seus valores a partir da 35ª semana.
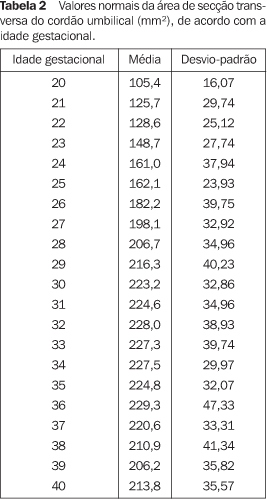
Em relação aos examinadores, o primeiro colheu 22% dos dados, o segundo participou com 45% dos dados, cabendo ao terceiro e quarto examinadores os porcentuais de 24% e 9% dos dados. De acordo com a análise de variância (Anova), comparando os dados obtidos pelos diferentes examinadores, não foi encontrada variação significativa entre os dados destes, concluindo que a dispersão dos dados situou-se em uma faixa de limites toleráveis. Para exemplificar, com 25 semanas o teste F mostrou valor de 0,930 e o valor de p situou-se na faixa de 0,454; com 32 semanas os valores foram de 0,106 para o teste F e 0,956 para o valor de p; e para 38 semanas os valores situaram-se em 0,102 para o teste F e 0,904 para o valor de p. Os valores da ASTCU obtidos em cada idade gestacional (média e desvio-padrão) estão sumarizados na Tabela 2.
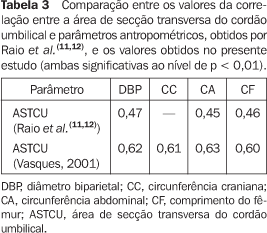
DISCUSSÃO O cordão umbilical, atualmente, pode prestar valiosas informações quanto à evolução da gravidez, em especial no que concerne ao crescimento fetal. Classicamente, é uma estrutura composta por duas artérias e uma veia, envoltas por uma substância gelatinosa denominada geléia de Wharton. Estudos de microscopia eletrônica, imuno-histoquímicos e investigações diversas(11–16,19–27) comprovaram que as células existentes na substância basal amorfa da geléia de Wharton tratam-se de células, na verdade, com características de células musculares lisas e fibroblastos, denominadas de miofibroblastos(13). Tais células acham-se em maior concentração ao redor dos vasos umbilicais, apresentando características de células produtoras de colágeno, proteoglicanos e glicoproteínas, apresentando, ainda, numerosas mitocôndrias e aparelhos de Golgi, características de fibroblastos e indicando processos de síntese. O citoplasma apresenta-se subdividido em vários processos finos que se conectam às células adjacentes em junção do tipo "gap junction", semelhantes às sinapses neuronais(13–17). A substância basal forma uma rede de fibrilas colágenas (que se entrelaçam) e apresenta um amplo sistema de cavidades interligadas, formando estruturas canaliculares e também consistindo de espaços cavernosos e perivasculares(9,18). No caso de compressão externa ou expansão dos vasos umbilicais, as estruturas formadas pelos canalículos, espaços cavernosos e espaços perivasculares adaptam-se à situação, permitindo que a substância basal do cordão flua através dos canalículos para os espaços cavernosos, alterando, assim, consideravelmente, seu volume e, por conseguinte, o fluxo sanguíneo no local. Os miofibroblastos, além de atuarem na síntese do colágeno e dos glicosaminoglicanos(19) para a substância basal, contribuem para a regulação do fluxo umbilical e também como camada adventícia, ausente no cordão umbilical, envolvendo os vasos umbilicais. Os proteoglicanos, que compõem a estrutura do esqueleto colágeno do cordão, são macromoléculas compostas de cadeias de glicosaminoglicanos unidos em ligação covalente a uma âncora protéica, apresentando ainda carboidratos em sua estrutura, com classificação extensa e funções variadas(19). As células do estroma da geléia de Wharton possuem função contrátil que pode ajudar na proteção aos vasos umbilicais contra compressão(33). A presença de substâncias como o ácido hialurônico, na proporção de 70% (que favorece a hidratação das células, contribuindo de forma significativa para as propriedades elásticas da geléia de Wharton), e os glicosaminoglicanos sulfatados (na proporção de 30% e que substituem o ácido hialurônico à medida que a gestação evolui), que estão imobilizados na rede de fibrilas colágenas da geléia de Wharton, cuja proporção, conforme já mencionado, vai se alterando com o amadurecimento da prenhez, altera a função tida como principal exercida pela geléia de Wharton, fato também constatado nas prenhezes que evoluem com toxemia hipertensiva, situação na qual ocorre um amadurecimento precoce do cordão(9,19,34,35). O estudo investigativo sobre a participação do cordão umbilical na formação do líquido amniótico comprovou importante atividade metabólica local, pela presença de numerosas organelas nas células endoteliais dos vasos umbilicais, sugerindo, em suma, relevante papel do cordão umbilical na transferência de substâncias entre o feto e o líquido amniótico, facilitando, também, a difusão de substâncias nutrientes e de água pelo sistema de cavidades(28,36–38). A geléia de Wharton contém, ainda, prostaglandinas(39–41), cujos teores parecem aumentar com a proximidade do termo da prenhez, apresentando menores concentrações em prematuros. A disposição espiralada do cordão umbilical, em forma comparada por alguns autores ao "fio de telefone", permite que ele se estire ou se encurte, dependendo da situação (por exemplo, trabalho de parto), até um certo grau, evidentemente, de forma a não estirar os vasos umbilicais em demasia, evitando, desta maneira, modificações acentuadas do fluxo sanguíneo ao longo do trajeto dos vasos funiculares. Destes fatos depreendemos por que tanto a hiperespiralação(22) quanto, ao revés, a hipoespiralação dos vasos funiculares podem trazer efeitos pejorativos à circulação umbilical e, conseqüentemente, ao concepto(11,12). O crescimento da espessura do cordão umbilical ao longo da gestação, atingindo seu pico na 32ª semana(7,11,12,42), mantendo um patamar até a 34ª semana aproximadamente e declinando a seguir, à exceção dos casos de diabetes gestacional(10), constitui-se, comprovado pelos estudos realizados, em parâmetro adequado para a verificação do crescimento fetal e predição da restrição do crescimento intra-uterino, bem como da predição do desempenho perinatal dos fetos portadores de cordões umbilicais anormalmente "finos". Os resultados do presente estudo apresentaram forte correlação entre a ASTCU com os parâmetros antropométricos classicamente utilizados para aferir a idade gestacional, peso fetal, proporcionalidade corporal, conforme demonstram os resultados estatísticos, estando de acordo com os demais trabalhos presentes na literatura mundial(7,10–12). Destacamos, todavia, que nossos resultados apresentaram, em relação à correlação da ASTCU × parâmetros antropométricos, correlações mais altas do que as correlações obtidas nos trabalhos apresentados na literatura(11,12). Exemplificando, a correlação de Spearman (não-paramétrica) apresentou, para a relação ASTCU × DBP, em nossa pesquisa, o valor de 0,626; para a relação ASTCU × CC, o valor de 0,621; para a relação ASTCU × CA, o valor de 0,630; e para a relação com o fêmur, o valor de 0,607 (Tabela 3).
Nossa pesquisa, desenvolvida agora uma tabela de valores normais para a ASTCU, pode servir para que se comprove, por meio de estudos complementares, sua aplicabilidade quanto à detecção precoce da restrição ao crescimento intra-uterino, afirmativa contida em trabalhos da literatura(11,12), podendo-se, ainda, estendê-la à busca de alterações do referido parâmetro a diversas entidades mórbidas que se apresentam nas gravidezes de alto risco. Tal parâmetro (ASTCU), pelos trabalhos já existentes, deve incorporar-se à rotina dos exames ultra-sonográficos obstétricos, por sua fácil execução e reprodutibilidade, conforme demonstrado por nossa pesquisa.
REFERÊNCIAS 1.Bergman P, Lundin P, Malmstrom T. Mucoid degeneration of the Wharton's jelly: an umbilical cord threatening foetal life. Acta Obstet Gynecol Scand 1961;40:372–8. [ ] 2.Ghosh A, Woo JSK, MacHenry C, Wan CW, O'Hoy KM, Ma HK. Fetal loss from umbilical cord abnormalities – a difficult case for prevention. Eur J Obstet Gynecol Reprod Biol 1984;18:183–98. [ ] 3.Labarrere C, Sebastiani M, Siminovich M, Torassa E, Althabe O. Absence of Wharton's jelly around the umbilical arteries: an unusual case of perinatal mortality. Placenta 1985;6:555–9. [ ] 4.Clausen I. Umbilical cord anomalies and antenatal fetal deaths. Obstet Gynecol Surv 1989;44:841–5. [ ] 5.Goodlin RC. Fetal dysmaturity, "lean" umbilical cord, and fetal distress. Am J Obstet Gynecol 1987;156:1357. [ ] 6.Qureshi F, Jacques SM. Marked segmental thinning of the umbilical cord vessels. Arch Pathol Lab Med 1994;118:826–30. [ ] 7.Weissman A, Jakobi P, Bronshtein M, Goldstein I. Sonographic measurements of the umbilical cord and vessels during normal pregnancies. J Ultrasound Med 1994;13:11–4. [ ] 8.Sun Y, Arbuckle S, Hocking G, Billson V. Umbilical cord stricture and intrauterine fetal death. Pediatr Pathol Lab Med 1995;15:723–32. [ ] 9.Bankowski E, Sobolewski K, Romanowicz L, Chyczewski L, Jaworski S. Collagen and glycosaminoglycans of Wharton's jelly and their alterations in EPH-gestosis. Eur J Obstet Gynecol Reprod Biol 1996;66:109–17. [ ] 10.Weissman A, Jakobi P. Sonographic measurements of the umbilical cord in pregnancies complicated by gestational diabetes. J Ultrasound Med 1997;16:691–4. [ ] 11.Raio L, Ghezzi F, Di Naro E, et al. Prenatal diagnosis of a lean umbilical cord: a simple marker for the fetus at risk of being small for gestational age at birth. Ultrasound Obstet Gynecol 1999;13:176–80. [ ] 12.Raio L, Ghezzi F, Di Naro E, et al. Sonographic measurement of the umbilical cord and fetal anthropometric parameters. Eur J Obstet Gynecol Reprod Biol 1999;83:131–5. [ ] 13.Takechi K, Kuwabara Y, Mizuno M. Ultrastructural and immunohistochemical studies of Wharton's jelly umbilical cord cells. Placenta 1993;14:235–45. [ ] 14.Eyden BP, Ponting J, Davies H, Bartley C, Torgersen E. Defining the myofibroblast: normal tissues, with special reference to the stromal cells of Wharton's jelly in human umbilical cord. J Submicrosc Cytol Pathol 1994;26:347–55. [ ] 15.Levene CI, Bartlet CP, Heale G. Identification of the connective tissues synthesized by the venous and arterial endothelia of the human umbilical cord: a comparative study. Br J Exp Pathol 1988;69:177–88. [ ] 16.Nanaev AK, Kohnen G, Milovanov AP, Domogatsky SP, Kaufmann P. Stromal differentiation and architecture of the human umbilical cord. Placenta 1997;18:53–64. [ ] 17.Heimli H, Kähler H, Endresen MJ, Henriksen T, Lyberg T. A new method for isolation of smooth muscle cells from human umbilical cord arteries. Scand J Clin Lab Invest 1997;57:21–9. [ ] 18.Vizza E, Correr S, Goranova V, et al. The collagen skeleton of the human umbilical cord at term: a scanning electron microscopy study after 2N-NaOH maceration. Reprod Fertil Dev 1996;8:885–94. [ ] 19.Kjellén L, Lindahl U. Proteoglycans: structures and interactions. Annu Rev Biochem 1991;60:443–75. [ ] 20.Chaurasia BD, Agarwall BM. Helical structure of the human umbilical cord. Acta Anat (Basel) 1979;103:226–30. [ ] 21.Degani S, Lewinsky RM, Berger H, Spiegel D. Sonographic estimation of umbilical coiling index and correlation with Doppler flow characteristics. Obstet Gynecol 1995;86:990–3. [ ] 22.Montenegro CAB, Rezende Filho J. Cordão umbilical hiperespiralado. Femina 2000;28:329–30. [ ] 23.Strong TH Jr, Elliot JP, Radin TG. Non-coiled umbilical blood vessels: a new marker for the fetus at risk. Obstet Gynecol 1993;81:409–11. [ ] 24.Strong TH Jr, Jarles DL, Veja JS, Feldman DB. The umbilical coiling index. Am J Obstet Gynecol 1994;170:29–32. [ ] 25.Strong TH Jr, Finberg HJ, Mattox JH. Antepartum diagnosis of noncoiled umbilical cords. Am J Obstet Gynecol 1994;170:1729–33. [ ] 26.Nishio J, Nakay Y, Mine M, Imanaka M, Ogita S. Characteristics of blood flow in intrauterine growth-restricted fetuses with hypercoiled cord. Ultrasound Obstet Gynecol 1999;13:171–5. [ ] 27.Otsubo Y, Yoneyama Y, Suzuki S, Sawa R, Araki T. Sonographic evaluation of umbilical cord insertion with umbilical coiling index. J Clin Ultrasound 1999;27:341–4. [ ] 28.Ronzoni S, Marconi AM, Cetin I, et al. Umbilical amino acid uptake at increasing maternal amino acid concentrations: effect of a maternal amino acid infusate. Am J Obstet Gynecol 1999;181:477–83. [ ] 29.Bruch JF, Sibony O, Benali K, Challier JC, Blot P, Nessmann C. Computerized microscope morphometry of umbilical vessels from pregnancies with intrauterine growth retardation and abnormal umbilical artery Doppler. Hum Pathol 1997;28:1139–45. [ ] 30.Hata T, Aoki S, Hata K, Miyazaki K. Three-dimensional ultrasonographic assessment of the umbilical cord during the 2nd and 3rd trimesters of pregnancy. Gynecol Obstet Invest 1998;45:159–64. [ ] 31.Bonilla-Musoles F, Raga F, Osborne NG. Three-dimensional ultrasound evaluation of the embryo and the early fetus. In: Kurjak A, ed. Textbook of perinatal medicine. 1st ed. London, UK: The Partenon Publishing Group, 1998:240–62. [ ] 32.Sepúlveda W. Time for a more detailed prenatal examination of the umbilical cord? Ultrasound Obstet Gynecol 1999;13:157–60. [ ] 33.Kobayashi K, Kubota T, Aso T. Study on myofibroblast differentiation in the stromal cells of Warton's jelly: expression and localization of alpha-smooth muscle actin. Early Hum Dev 1998;51:223–33. [ ] 34.Meyer FA, Laver-Rudich Z, Tanenbaum R. Evidence for a mechanical coupling of glycoprotein microfibrils with collagen fibrils in Wharton's jelly. Biochim Biophys Acta 1983;755:376–87. [ ] 35.Engberg-Damsgaard TM, Windelborg-Nielsen B, Sorensen FB, Henriques U, Schiotz PO. Estimation of the total number of mast cells in the human umbilical cord. APMIS 1992;100:845–50. [ ] 36.Scott JM, Wilkinson R. Further studies on the umbilical cord and its water content. J Clin Pathol 1978;31:944–8. [ ] 37.Gebrane-Younes J, Hoang NM, Orcel L. Ultrastructure of human umbilical vessels: a possible role in amniotic fluid formation? Placenta 1986;7:173–85. [ ] 38.Anderson DF. Regulation of umbilical blood flow. In: Polin RA, Fox WW, eds. Fetal and neonatal physiology. Philadelphia, PA: WB Saunders, 1992:694. [ ] 39.Karim SMM. The identification of prostaglandins in human umbilical cord. Br J Pharmacol 1967;29:230–7. [ ] 40.Siegel RJ, Villa LC, Fishbein MC. Immunohistochemical localization of 6-keto-prostaglandin F1 alpha and prostaglandin E2 in the human umbilical cord before and after labor. Lab Invest 1987;56:550–3. [ ] 41.Kawano M, Mori N. Prostacyclin producting activity of human umbilical blood vessels in adrenergic innervated and non-innervated portions. Prostaglandins Leukot Essent Fatty Acids 1990;39:239–45. [ ] 42.Vasques FAP, Murta CGV, Moron AF, Carvalho FHC, Gonçalves TR. Curva de normalidade da área de secção transversa do cordão umbilical aferida pela ultra-sonografia. Resultados preliminares. Soc Bras Med Fetal 2000;6:17–24. [ ]
Recebido para publicação em 25/11/2002
* Trabalho realizado no Setor de Medicina Fetal da Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554