Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 36 nº 4 - Jul. / Ago. of 2003
Vol. 36 nº 4 - Jul. / Ago. of 2003
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Alexandre Sérgio de Araújo Bezerra, Giuseppe D'Ippolito, Pierpaolo Martelli, Gustavo Alfredo Duarte Henrique Pinto, Mário Melo Galvão Filho, Jacob Szejnfeld |
|
|
Descritores: Fígado, Calcificação, Neoplasia, Tomografia computadorizada |
|
|
Resumo: IIIEspecializando do Departamento de Diagnóstico por Imagem da Unifesp
INTRODUÇÃO O emprego cada vez mais rotineiro da tomografia computadorizada (TC) do abdome tem aumentado significativamente a detecção de calcificações hepáticas, auxiliando não só em relação à confirmação da sua localização intra-hepática, mas também provendo informações morfológicas sobre eventuais lesões focais associadas(1). A lista de possíveis causas de calcificações hepáticas é numerosa e inclui, entre outras, as infecciosas, vasculares, biliares e neoplásicas primárias (benignas e malignas) e secundárias(1?3). Apesar de freqüentes, não se sabe, com precisão, a incidência de calcificações hepáticas identificadas em exames de TC, que é considerado o método mais sensível para detectar calcificações no fígado e em outros órgãos(1,2). Segundo a literatura(1,3?8), a maioria das calcificações hepáticas são granulomas calcificados e cistos hidáticos, seguidos por calcificações associadas a neoplasias hepáticas. Porém, nem sempre é possível estabelecer com precisão a origem e o significado patológico dessas calcificações. O objetivo deste trabalho foi determinar a freqüência de calcificações hepáticas em exames tomográficos, procurando-se estabelecer o seu significado dentro do contexto clínico.
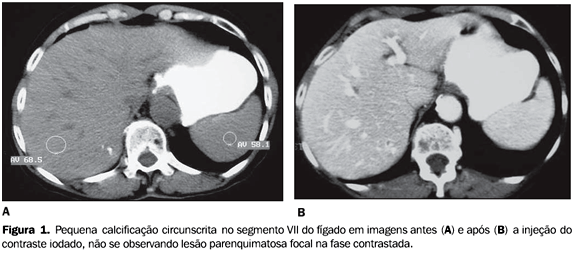
MATERIAIS E MÉTODOS Foram avaliados, retrospectivamente, os relatórios de exames de TC do abdome de 1.362 pacientes, realizados consecutivamente entre abril e novembro de 2000, independentemente da indicação clínica do exame. Desses exames, 671 (49%) foram realizados no Hospital São Paulo, SP, em aparelho helicoidal Tomoscan AV (Philips), e 691 (51%) foram realizados na unidade Itaim do Complexo Hospitalar São Luiz, SP, em aparelho helicoidal Helicat Plus (Elscint, Marconi). O protocolo de cada exame variava de acordo com a indicação clínica do exame; no entanto, uma fase sem contraste endovenoso foi realizada em todos os exames, utilizando-se cortes contíguos com 5?7 mm de espessura. Foram selecionados os relatórios com descrição de calcificações intra-hepáticas, observadas na fase sem contraste endovenoso, independentemente do seu número ou morfologia. Na tentativa de se estabelecer uma possível etiologia para as calcificações hepáticas, todos os prontuários ou fichas clínicas dos pacientes com achado de calcificações hepáticas foram revistos. As calcificações hepáticas foram então classificadas, segundo seu aspecto morfológico, nos seguintes tipos: Tipo I ? Residuais, quando tinham até 2 cm de tamanho e não apresentavam nenhuma alteração textural focal ou perfusional hepática associada(2,9)(Figura 1).
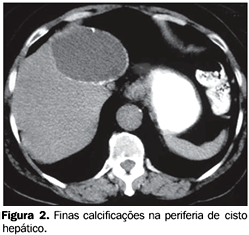
Tipo II ? Associadas a cistos, quando as calcificações eram associadas a lesões com característica cística à TC (lesões hipodensas, homogêneas, com densidade entre 0 e 20 UH e sem realce após a injeção de contraste), em pacientes sem história de neoplasia primária (Figura 2).
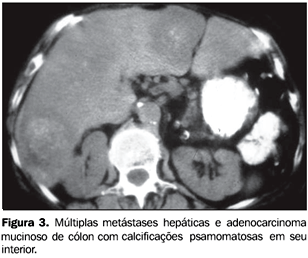
Tipo III ? Associadas a lesões neoplásicas, quando as calcificações se localizavam dentro de nódulos hepáticos vascularizados e em pacientes sabidamente portadores de neoplasia primária hepática ou extra-hepática (Figura 3).
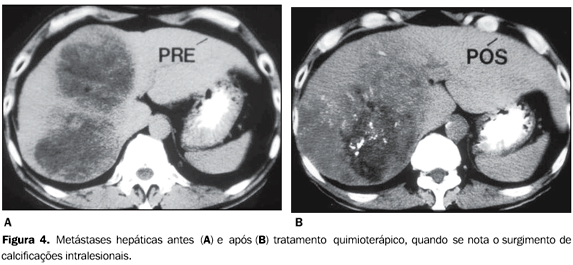
Tipo IV ? Pós-quimioterapia, em pacientes que apresentavam calcificações hepáticas em lesões hepáticas focais pré-existentes, com aparecimento após o início do tratamento quimioterápico, fato este confirmado por exames tomográficos pré e pós-quimioterapia (Figura 4).
Pelo fato de não termos observado hepatocarcinoma calcificado na nossa casuística, o aspecto morfológico tipo III foi restrito às metástases hepáticas. Foram calculadas as prevalências global e em relação ao sexo das calcificações intra-hepáticas, além da porcentagem de cada grupo etiológico responsabilizado pelas calcificações, em função do seu aspecto morfológico e da apresentação clínica. Foi aplicado o teste do qui-quadrado para medir a discrepância entre as freqüências observadas e esperadas de variáveis nominais. Foi considerado significante um p < 0,05.
RESULTADOS A prevalência global de calcificações hepáticas foi de 3,6% (49/1.362), não se observando diferença estatisticamente significante entre os sexos (c² = 1,9, com p > 0,05), sendo 57,2% (28/49) presentes em pacientes do sexo feminino e 42,8% (21/49) presentes em pacientes do sexo masculino. A idade dos pacientes com calcificações hepáticas variou entre 18 e 92 anos, com idade média de 59,4 anos e mediana de 63,5 anos. Dos 49 exames tomográficos com calcificações intra-hepáticas, 39 (79,5%) apresentavam calcificações compatíveis com a definição pré-estabelecida de calcificações residuais (tipo I) e, destes, apenas um (2,5%) fazia referência a doença hepática pregressa (abscesso amebiano). Os outros 38 pacientes não faziam qualquer menção de acometimento hepático atual ou pregresso de qualquer natureza nem apresentavam exames laboratoriais hepáticos alterados. Em 10,2% (5/49) dos exames as calcificações hepáticas estavam associadas a doença metastática (tipo III), por adenocarcinoma de cólon (Figura 3) em três casos e tumor carcinóide e teratoma maligno de ovário nos outros dois. Em todos os pacientes com história de metástases hepáticas as calcificações encontravam-se em lesões hepáticas focais. Foram observadas calcificações associadas a cistos em três exames (6,1%), caracterizando o tipo morfológico II. Nos três casos havia um único cisto hepático e não havia cistos em outros órgãos abdominais que sugerissem doença policística. Dois pacientes (4,2%) portadores de adenocarcinoma de cólon com metástase hepática apresentaram calcificações nas lesões secundárias, identificadas apenas após o início do ciclo de quimioterapia (calcificação tipo IV). Ambos os pacientes faziam uso do quimioterápico oxaliplatina.
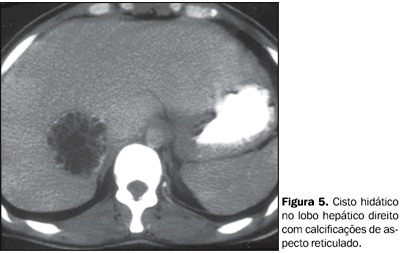
DISCUSSÃO Apesar de ser relativamente freqüente o achado de calcificações no hipocôndrio direito nas radiografias convencionais(9), na maioria das vezes elas se localizam na árvore biliar extra-hepática, rim, adrenal, pleura ou cartilagens costais(2), sendo relativamente raro o achado de calcificações intra-hepáticas. O uso rotineiro da TC na avaliação da cavidade abdominal aumentou sensivelmente a capacidade de se identificar calcificações intra-hepáticas, assim como inferir uma possível etiologia baseada nas características morfológicas das calcificações e de eventuais lesões associadas. A lista de possíveis causas de calcificações hepáticas é muito ampla, e discutiremos as principais etiologias, assim como suas particularidades em relação à morfologia da calcificação em cada caso(1,2). Causas infecciosas/inflamatórias As lesões inflamatórias que suscitam reação granulomatosa do organismo são a causa mais comum de calcificações hepáticas(10), destacando-se a tuberculose e a histoplasmose(1,2). Outras possíveis causas infecciosas de calcificações hepáticas são a brucelose, a coccidioidomicose e mais raramente a sífilis (goma sifilítica). Não é possível estabelecer com exatidão o agente etiológico da calcificação, baseando-se apenas nos aspectos tomográficos. Com a pandemia da síndrome da imunodeficiência adquirida, ocorrida na última década, observou-se que vários agentes oportunistas podem causar calcificações hepáticas, sendo o Pneumocystis carinii o mais freqüente(11). Outros estudos sugeriram ainda que, virtualmente, qualquer lesão necrotizante pode gerar calcificações hepáticas, as quais já foram observadas em lesões por citomegalovírus, micobacteriose atípica (complexo avium-intracellulare)(12) e candidíase(13). Nos casos de calcificações decorrentes de processos infecciosos, os focos calcificados são geralmente pequenos (< 2 cm) e clinicamente assintomáticos(1,2), podendo ser solitários ou múltiplos. A calcificação, tipicamente, envolve toda a lesão, não se observando nenhuma alteração textural focal hepática associada. A doença granulomatosa crônica e abscessos crônicos, amebianos ou piogênicos também podem causar calcificações intra-hepáticas(2). Nesses casos, podem ser observadas, excepcionalmente, alterações texturais hepáticas focais. Infecções parasitárias podem levar à formação de granulomas e, conseqüentemente, a calcificações hepáticas. A infecção parasitária mais comum é a esquistossomose, que nos casos de infecção por Schistosoma japonicum pode apresentar calcificações com uma morfologia característica, descrita como em "casco de tartaruga" (14). Nesses casos, a associação com sinais de hipertensão portal auxilia na determinação etiológica da calcificação. A doença hidática produz calcificações que, por vezes, assumem um aspecto anelar ao redor dos cistos ou ainda um aspecto reticulado (Figura 5). Ressalte-se que a presença de calcificações, nesses casos, não implica morte do parasita, uma vez que pequenos hematomas podem se associar a focos de calcificações irregulares(15). O aspecto de "cisto dentro de cisto" é forte indicativo de hidatidose.
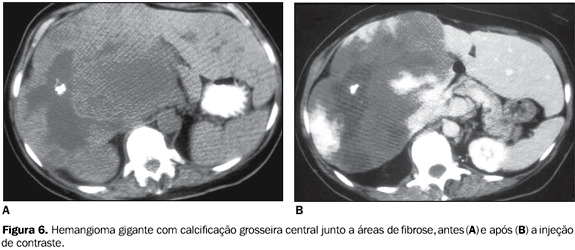
Causas mais raras de calcificações hepáticas incluem a cisticercose, a filaríase, a paragonimíase e a dracunculíase(2). Assim como na literatura, a maioria das calcificações hepáticas na nossa população foi encontrada em pacientes assintomáticos e que, morfológica e clinicamente, podiam ser classificadas como residuais. Causas neoplásicas As neoplasias primárias, benignas e malignas, e secundárias também se associam a calcificações que podem, em determinadas circunstâncias, auxiliar no diagnóstico etiológico. Os hemangiomas são os tumores hepáticos benignos mais comuns e podem apresentar calcificações em até 20% dos casos(16). Estas, na nossa experiência, têm sido observadas raramente (Figura 6). Tais calcificações apresentam morfologia variada, sendo geralmente grosseiras e de localização central junto a áreas de fibrose(2). Eventualmente, as calcificações podem assumir aspecto de flebólito, auxiliando no diagnóstico etiológico.
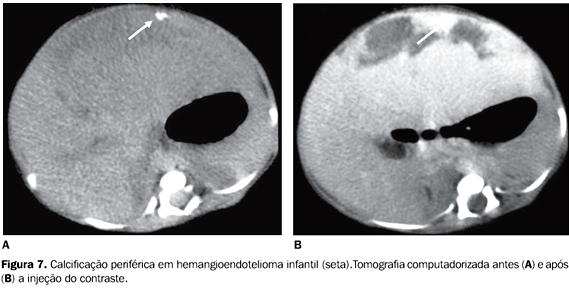
O adenoma hepático é a terceira neoplasia benigna mais comum e que necessita ser diferenciada de outras lesões benignas como o hemangioma e a hiperplasia nodular focal, uma vez que é necessária uma abordagem cirúrgica devido ao seu elevado risco de ruptura e hemoperitônio. Pode apresentar calcificações únicas ou múltiplas, de morfologia variada, geralmente localizadas perifericamente, em uma massa heterogênea com componente de gordura, hemorragia e fibrose(16), observando-se calcificações em cerca de 10% dos casos em exames de tomografia(17). Caseiro-Alves et al.(18) sugeriram que a calcificação é achado raro em hiperplasia nodular focal, tendo sido encontrada em apenas 5 de 357 casos estudados (0,14%), apresentando, nestes, padrão similar ao observado no carcinoma fibrolamelar. Entretanto, a aparência heterogênea do carcinoma fibrolamelar à TC auxilia no diagnóstico diferencial, bem como o aspecto bastante característico da hiperplasia nodular focal, na TC helicoidal multifásica. Na faixa etária pediátrica, principalmente em crianças menores de um ano, lesões hepáticas com calcificações associadas sugerem o diagnóstico de hemangioendotelioma infantil. Apesar de raro, o hemangioendotelioma infantil é o tumor benigno mesenquimal mais comum nas crianças e é particularmente importante devido às potenciais complicações hemodinâmicas decorrentes do alto débito gerado por "shunts" arteriovenosos. As calcificações no hemangioendotelioma infantil apresentam geralmente padrão salpicado e podem ser observadas em até 25% dos casos(2,19) (Figura 7).
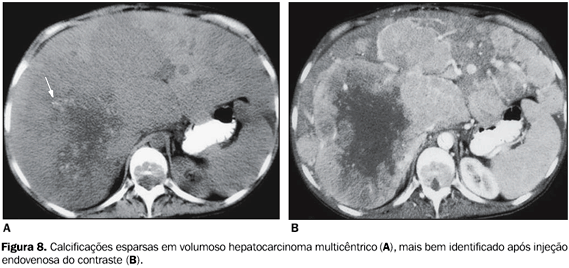
O carcinoma hepatocelular é a neoplasia hepática maligna mais comum e uma das neoplasias viscerais mais freqüentes no mundo(2,20). Pode ser único, múltiplo ou difuso, geralmente estando associado a hepatopatia crônica(21). Observa-se calcificação em até 25% dos carcinomas hepatocelulares(4,21), que pode se apresentar com aspecto puntiforme, nodular, grosseiro ou confluente, podendo ser única ou múltipla(4) (Figura 8).
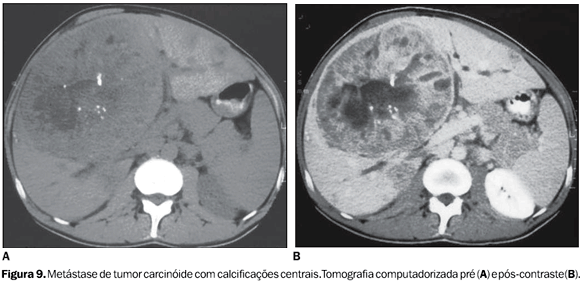
O carcinoma fibrolamelar é um subtipo histológico de carcinoma hepatocelular, que geralmente acomete pacientes jovens sem hepatopatia crônica. Apresenta comportamento biológico menos agressivo e melhor prognóstico que o carcinoma hepatocelular, apesar das grandes dimensões das lesões à época do diagnóstico(21). Nos estudos tomográficos identifica-se massa vascularizada, bem definida, de contornos lobulados, apresentando cicatriz central em até 50% das vezes. Freqüentemente essa cicatriz central apresenta calcificações(21,22) , fato que pode ajudar na diferenciação entre o carcinoma fibrolamelar e a hiperplasia nodular focal, que raramente apresenta cicatriz central calcificada(18). O colangiocarcinoma intra-hepático é a principal neoplasia de origem biliar e representa 10% dos colangiocarcinomas(1,2), podendo apresentar calcificações em até 20% dos casos(23), que podem ser únicas ou múltiplas e são em geral mal definidas. O hepatoblastoma é o tumor maligno hepático mais comum nas crianças, podendo apresentar calcificações em até 50% dos casos(2,24), quando são geralmente grosseiras e densas(25). Metástases As metástases hepáticas são as lesões mais comuns no fígado não-cirrótico(2) e sua aparência nos diferentes métodos de imagens depende de sua vascularização, tamanho e características histológicas do tumor primário. Calcificações são mais freqüentes em neoplasias produtoras de mucina, como o adenocarcinoma de cólon, porém podem ser encontradas em variada gama de tumores, tais como condrossarcoma, osteossarcoma, tumor carcinóide e tumores neuroendócrinos (Figura 9). Essas calcificações podem se apresentar como imagens hiperdensas puntiformes, amorfas ou granulares(2,5,21) (Figura 3).
Nos casos de metástases calcificadas, na nossa casuística, três eram de adenocarcinoma de cólon, sendo duas destas classificadas como de origem mucinosa, confirmando a maior tendência desse subtipo histológico de apresentar lesões secundárias calcificadas. Calcificações em metástases hepáticas também podem ser resultado de tratamento radioterápico ou quimioterápico(8), fato observado em dois pacientes que faziam uso do quimioterápico oxaliplatina em nosso estudo (Figura 4). Calcificações em metástases hepáticas tratadas por quimioterapia com 5-fluorouracil são observadas em até 4% a 8% e não possuem correlação com a resposta positiva ao tratamento(26). É importante observar que, devido à infreqüente associação de calcificação em tumores benignos, deve-se considerar o achado de calcificação em lesões hepáticas focais como fortemente indicativo de malignidade. Outras causas Cistos hepáticos simples são freqüentes na população em geral (5% a 14%)(27), podendo ser únicos ou múltiplos. Habitualmente apresentam paredes finas, podendo apresentar calcificações em caso de hemorragias ou infecções(21). Nos três casos em que observamos calcificações na parede de estrutura cística (Figura 2), não havia nenhum indício clínico ou laboratorial de doença hepática nem cistos hepáticos múltiplos ou em outros órgãos. Dessa forma, assumiu-se que tratavam-se de cistos com paredes calcificadas e não houve prosseguimento na investigação etiológica. Causas vasculares podem originar calcificações hepáticas, como, por exemplo, aneurisma de artéria hepática, trombose de veia porta e hematomas(2). Nesses casos, o aspecto lamelar da calcificação pode sugerir sua origem hemorrágica. Calcificações nas vias biliares podem ser decorrência de colangiocarcinomas(23), cálculos biliares e ascaridíase(28,29). Neste último caso, o encontro do parasita na ultra-sonografia ou na endoscopia é que permite o diagnóstico etiológico. Apresentamos, assim, as principais causas de calcificações hepáticas, ressaltando-se, no entanto, que diversas doenças não mencionadas e menos freqüentes, como, por exemplo, a amiloidose(30), podem também estar associadas a calcificações no parênquima hepático.
CONCLUSÃO As calcificações hepáticas apresentam baixa prevalência em exames tomográficos (< 5%) e são mais freqüentemente relacionadas a formas residuais e assintomáticas de processos infecciosos e inflamatórios pregressos. A presença de alteração textural e perfusional do parênquima hepático, associada à calcificação, indica origem provavelmente tumoral, merecendo o prosseguimento da investigação diagnóstica.
REFERÊNCIAS 1.Paley MR, Ros PR. Hepatic calcification. Radiol Clin North Am 1998;36:391?8. [ ] 2.Stoupis C, Taylor HM, Paley MR, et al. The Rocky liver: radiologic-pathologic correlation of calcified hepatic masses. RadioGraphics 1998;18:675?85. [ ] 3.Reeder MM. Liver calcification. Semin Roentgenol 1975;10:171. [ ] 4.Scatarige JC, Fishman EK, Saksouk FA, Siegelman SS. Computed tomography of calcified liver masses. J Comput Assist Tomogr 1983;7:83?9. [ ] 5.Baliko Z, Juhasz E, Hoffmann F, Anga B. Calcifying liver metastases in a case of primary lung cancer. Chest 1997;111:1121?2. [ ] 6.Bernardino ME. Computed tomography of calcified liver metastases. J Comput Assist Tomogr 1979;3: 32?5. [ ] 7.Darlak JJ, Moskowitz M, Kattan KR. Calcifications in the liver. Radiol Clin North Am 1980;18:209?19. [ ] 8.Dolan PA. Tumor calcification following therapy. AJR 1963;89:166?8. [ ] 9.Ros PR, Barreda P, Gore RM. Focal hepatic infections. In: Gore RM, Levine MS, Laufer I, eds. Textbook of gastrointestinal radiology. Philadelphia, PA: WB Saunders, 1994:1947?67. [ ] 10.Gelfand DW. The liver: plain film diagnosis. Semin Roentgenol 1975;10:177?85. [ ] 11.Feuerstein IM, Francis P, Raffeld M, Pluda J. Widespread visceral calcifications in disseminated Pneumocystis carinii infection: CT characteristics. J Comput Assist Tomogr 1990;14:149?51. [ ] 12.Towers MJ, Withers CE, Hamilton PA, Kolin A, Walmsley S. Visceral calcification in patients with AIDS may not always be due to Pneumocystis carinii. AJR 1991;156:745?7. [ ] 13.Shirkhoda A. CT findings in hepatosplenic and renal candidiasis. J Comput Assist Tomogr 1987;11: 795?8. [ ] 14.Hamada M, Ohta M, Yasuda Y, et al. Hepatic calcification in schistosomiasis japonica. J Comput Assist Tomogr 1982;6:76?8. [ ] 15.Beggs I. The radiology of hydatid disease. AJR 1985;145:639?48. [ ] 16.Ros PR, Li KCP. Benign liver tumors. Curr Probl Diagn Radiol 1989;18:125?55. [ ] 17.Grazioli L, Federle MP, Brancatelli G, Ichikawa T, Olivetti L, Blachar A. Hepatic adenomas: imaging and pathologic findings. RadioGraphics 2001;21: 877?94. [ ] 18.Caseiro-Alves F, Zins M, Mahfouz AE, et al. Calcification in focal nodular hyperplasia: a new problem for differentiation from fibrolamellar hepatocellular carcinoma. Radiology 1996;198:889?92. [ ] 19.Dachman AH, Lichtenstein JE, Friedman AC, Hartman DS. Infantile hemangioendothelioma of the liver: a radiologic-pathologic-clinical correlation. AJR 1983;140:1091?6. [ ] 20.Heiken JP. Liver. In: Lee JKT, Sagel SS, Stanley RJ, Heiken JP, eds. Computed body tomography with MRI correlation. Philadelphia, PA: Lippincott-Raven, 1998:701?66. [ ] 21.Kunstlinger F, Federle MP, Moss AA, Marks W. Computed tomography of hepatocellular carcinoma. AJR 1980;134:431?7. [ ] 22.Brandt DJ, Johnson CD, Stephens DH, Weiland LH. Imaging of fibrolamellar hepatocellular carcinoma. AJR 1988;151:295?9. [ ] 23.Ros PR, Buck JL, Goodman ZD, Ros AM, Olmsted WW. Intrahepatic cholangiocarcinoma: radiologic-pathologic correlation. Radiology 1988;167:689?93. [ ] 24.Dachman AH, Pakter RL, Ros PR, Fishman EK, Goodman ZD, Lichtenstein JE. Hepatoblastoma: radiologic-pathologic correlation in 50 cases. Radiology 1987;164:15?9. [ ] 25.Weinberg AG, Finegold MJ. Primary hepatic tumors of childhood. Hum Pathol 1983;14:512?37. [ ] 26.Hale HL, Husband JE, Gossios K, Norman AR, Cunningham D. CT of calcified liver metastases in colorectal carcinoma. Clin Radiol 1998;53:735?41. [ ] 27.Craig JR, Peters RL, Edmonson HA. Tumors of the liver and intrahepatic bile ducts. In: Atlas of human pathology 26. Washington, DC: Armed Forced Institute of Pathology, 1989. [ ] 28.Nagakura S, Shirai Y, Yamai K, Hatakeyama K. Calcification in mucinous cholangiocellular carcinoma. Hepatogastroenterology 1999;46:465?6. [ ] 29.Ribeiro MA Jr, Piva AM, Gualberto EF, Leitão RM, D'Ippolito G, Saad O. Right hepatic segmentectomy for the treatment of intrahepatic biliary stones due to Ascaris lumbricoides: report of a case. Surg Today 2001;31:1024?6. [ ] 30.Kennan NM, Evans C. Case report: hepatic and splenic calcification due to amyloid. Clin Radiol 1991;44:60?1. [ ]
Recebido para publicação em 22/1/2003
* Trabalho realizado no Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp) e no Serviço de Tomografia Computadorizada do Hospital São Luiz, São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554