Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 36 nº 3 - Maio / Jun. of 2003
Vol. 36 nº 3 - Maio / Jun. of 2003
|
ARTIGOS
|
|
|
|
|
Autho(rs): Beatriz Mahmud Jacob, Kim-Ir-Sen Santos Teixeira, Sizenildo da Silva Figueirêdo, Bruno Barcelos da Nóbrega |
|
|
Descritores: Persistência hiperplásica do vítreo primitivo, Leucocoria, Artéria hialóide, Canal de Cloquet |
|
|
Resumo:
INTRODUÇÃO Durante as primeiras quatro semanas de gestação, o espaço entre a lente (cristalino) e a retina contém o vítreo primário ou primitivo, constituído principalmente por uma rede ectodérmica fibrilar associada a um sistema vascular hialóide, de origem mesodérmica, composto pela artéria hialóide (responsável pela nutrição do vítreo), pelo vaso próprio hialóide e pela túnica vasculosa lentis (formada por ramos terminais da artéria hialóide)(1–3). No segundo mês de gestação ocorrem a formação do vítreo secundário (correspondente ao vítreo adulto) e o início da troca dos elementos vasculares do vítreo primitivo(3). O vítreo secundário, composto por uma substância aquosa contendo fibras colágenas e ácido hialurônico, começa a preencher a cavidade vítrea na 14ª semana de vida do concepto, ocupando sua quase totalidade no período do quinto ao sexto mês de gestação(1–3). Nesta fase, o vítreo primário encontra-se reduzido a um pequeno espaço central, em forma de S, denominado canal de Cloquet, orientando-se desde a origem do nervo óptico até a porção posterior da lente(1–3). A persistência hiperplásica do vítreo primitivo (PHVP) ocorre quando falha a regressão normal esperada do sistema vascular hialóide, sendo a lesão básica causada pela persistência de várias porções do vítreo primitivo e da túnica vasculosa lentis, que sofrem hiperplasia devido a uma intensa proliferação fibrovascular de tecido conectivo embriogênico(1,2,4). A PHVP foi inicialmente caracterizada por Reese(5) em 1955, consistindo em uma afecção não hereditária caracterizada por microftalmia, câmara anterior rasa, alongamento dos processos ciliares e uma catarata subcapsular posterior, bem como por proliferação fibrovascular que se estende do cristalino à papila do nervo óptico(5). As crianças afetadas comumente não apresentam antecedentes pessoais ou familiares equivalentes(5). Não há predileção por sexo e é geralmente detectada em recém-natos prematuros(6). Costuma ser unilateral, na maioria dos casos, e cursar com leucocoria (reflexo branco nacarado da pupila), microftalmia e, por vezes, estrabismo e nistagmo(7,8). A bilateralidade, incomum, ocorre em apenas 11% a 12% dos casos(9). A etiologia permanece desconhecida na maioria dos casos, porém a presença de alguns raros relatos em familiares sugere a possibilidade de herança autossômica dominante ou recessiva(6). Alguns autores têm descrito alterações neurológicas associadas, tais como ataxia, microcefalia, hipotonia e hemiparesia em alguns raros casos de PHVP bilateral(8), todavia a ausência de achados sistêmicos é a regra(10,11). A PHVP pode estar associada a malformações do nervo óptico e da retina(2). Essas malformações oculares refletem manifestações de uma doença mais extensa, como a doença de Norrie (degeneração óculo-acústico-cerebral progressiva), a síndrome de Warburg (malformações congênitas do sistema nervoso central, microftalmia e descolamento de retina uni ou bilateral), a displasia vítreo-retiniana primária ou outros defeitos congênitos(2).
FORMAS DE APRESENTAÇÃO E ASPECTOS DIAGNÓSTICOS A PHVP pode apresentar variações em sua forma de apresentação: uma variante anterior, outra posterior e uma terceira, denominada completa (somatório das duas primeiras)(4,11), que correspondem, respectivamente, a 25%, 12% e 63% dos casos de PHVP(6). A forma mais típica é a anterior, na qual uma placa de tecido conectivo vascularizado está situado no vítreo, imediatamen te atrás e aderente à lente, conectando-se perifericamente e tracionando os processos ciliares anormalmente alongados(12). A porção anterior da placa pode distender a cápsula da lente e distorcer a sua morfologia(12). Nesta variante, o fundo do globo fica obscurecido pela massa fibrovascular retrolental, caracterizando clinicamente a chamada "mancha de Mittendorf", freqüentemente confundida com catarata congênita(13). A forma puramente posterior da PHVP ocorre em globos com anormalidades confinadas ao segmento ocular posterior, tais como pregas retinianas, traves e membranas vítreas, anormalidades maculares e do nervo óptico(6). Nesta variante, uma lesão retrolental, a artéria hialóide e uma trave de tecido conectivo são freqüentemente encontradas na câmara vítrea, estendendo-se em todo o trajeto do disco óptico(12). Opostamente à forma anterior, as estruturas do pólo ventral do globo estão poupadas, tais como a câmara anterior e o cristalino(6). Se apenas ocorrer reabsorção da porção anterior da artéria hialóide embrionária, o tecido fibrovascular remanescente prolifera sobre a papila, estendendo-se ventralmente a partir do nervo óptico até uma distância variável na cavidade vítrea, configurando um aspecto típico denominado "papila de Bergmeister"(13). A combinação das apresentações anterior e posterior é a variante clínica mais freqüentemente presente(6), correspondendo a cerca de dois terços dos casos de PHVP. A idade, o sexo, a lateralidade, a hereditariedade e, em particular, a presença ou não de calcificações e o tamanho do globo ocular podem ser usados como critérios de diagnóstico para elucidar as diferentes causas de leucocoria(14). A PHVP e o retinoblastoma, tumor maligno do globo ocular de crianças(15), correspondem às causas mais freqüentes de leucocoria na infância(1). Outras condições com sinais clínicos similares incluem a catarata congênita isolada, a retinopatia da prematuridade, a doença de Coats e outras afecções agrupadas sob o termo pseudogliomas ou leucocorias(1,5). A identificação direta, por meio da fundoscopia, do remanescente fetal do sistema vascular hialóide seria a melhor evidência diagnóstica, exceto se não fosse quase impossível pela presença de um meio opaco(1), seja pela freqüente hemorragia vítrea, seja pelo tecido fibrovascular opaco retrolental(2). Nesses casos pode-se fazer a visualização indireta pela ultra-sonografia (US), tomografia computadorizada (TC) e/ou ressonância magnética (RM)(1). A detecção de achados clínicos ou de imagem alerta para o apropriado diagnóstico e estimam as possibilidades prognósticas para cada caso(2).
ACHADOS DE EXAME FÍSICO Um olho esbranquiçado e de dimensões reduzidas é comum. A fundoscopia ocasionalmente permite a observação da artéria hialóide ou de remanescentes dos vasos hialóides próprios(16). Catarata, glaucoma agudo e uveíte podem ser complicações da PHVP, levando a um glaucoma absoluto e atrofia bulbar (phthisis bulbi)(1,16). A catarata é determinada pela persistência de fluxo sanguíneo e da túnica vasculosa lentis(13), que inicialmente causam edema no cristalino. Este edema, associado às trações exercidas pela placa fibrovascular retrolental sobre o diafragma irido-cristaliniano, produz caracteristicamente uma câmara anterior rasa e glaucoma de ângulo fechado secundário(6). Hemorragias vítreas de repetição ocasionalmente ocorrem(1,16)e são geradas durante as contrações do tecido fibrovascular, predispondo ao extravasamento sanguíneo(13). O estiramento dos processos ciliares é quase patognomônico e sinéquias irido-cristalinianas podem ser observadas em alguns casos(7). Malformações retinianas e descolamento da retina podem estar presentes(1,7), sendo este último gerado pela tração da trave fibrovascular no pólo posterior do globo(13). Entretanto, deslocamentos severos da retina são raros.
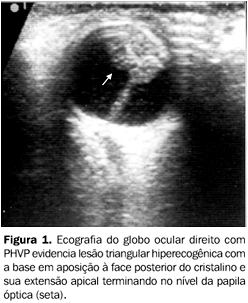
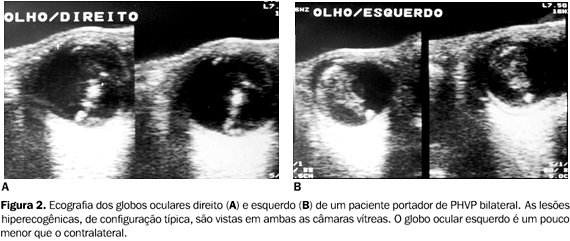
ACHADOS POR MÉTODOS DE IMAGEM Ultra-sonografia A US fornece informações essenciais ao diagnóstico da PHVP por determinar a presença da lesão e sua extensão à cabeça do nervo óptico(17). Ecograficamente, o globo ocular afetado pode parecer menor que o normal(13). O aspecto típico é o de um triângulo hiperecogênico cuja base situa-se na face posterior do cristalino, e o ápice, no nível da papila óptica (Figuras 1 e 2). Outros achados incluem a presença de tumoração ecogênica retrolental ou múltiplos ecos intravítreos(7,9), causados por hemorragia. Uma câmara posterior ecograficamente normal pode ser observada, porém é raro(7).
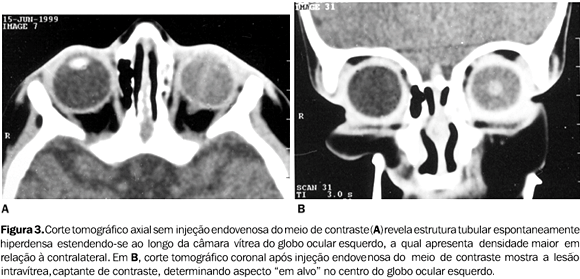
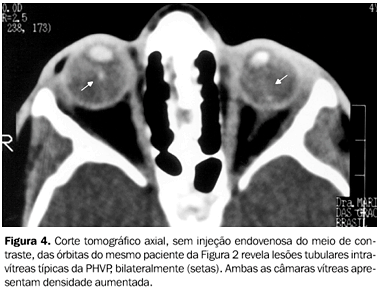
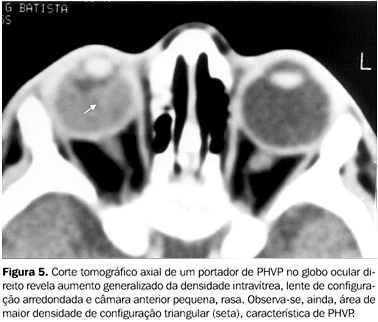
O uso do método Doppler na avaliação dos vasos na PHVP tem sido desencorajado deviso às dificuldades técnicas e à necessidade de sedação para sua execução em pacientes de baixa idade(17). Porém, quando realizado em pacientes cooperativos e de mais idade, pode-se observar fluxo sanguíneo na artéria hialóide persistente. Este achado ao Doppler, associado a hemorragia vítrea e ausência de calcificação, é virtualmente patognomônico de PHVP(3). Em todos os casos, a ausência de calcificações intravítreas praticamente permite descartar o diagnóstico de retinoblastoma. A US também pode excluir malformações retinianas associadas(5). Tomografia computadorizada A TC, nos planos axial e coronal, é de grande valia, devendo ser administrado meio de contraste endovenoso, e, em alguns casos, obtidas imagens complementares em decúbito lateral. Os achados tomográficos comumente observados na PHVP incluem(1,2): a) microftalmia, usualmente detectável, podendo ser mínima ou estar ausente; b) ausência de calcificações dentro e ao redor do globo ocular; c) aumento generalizado da densidade da câmara vítrea; d) visualização de imagem tubular, cilíndrica, triangular ou outra discreta densidade intravítrea; e) realce anormal do tecido intravítreo na fase pós-contraste endovenoso; f) à mudança de decúbito, pode-se observar deslocamento gravitacional do nível líquido dentro da câmara vítrea, refletindo fluido serossanguinolento no espaço sub-hialóide ou no espaço sub-retiniano; g) a lente pode ser pequena ou irregular e a câmara anterior pode ser rasa (Figuras 3, 4 e 5).
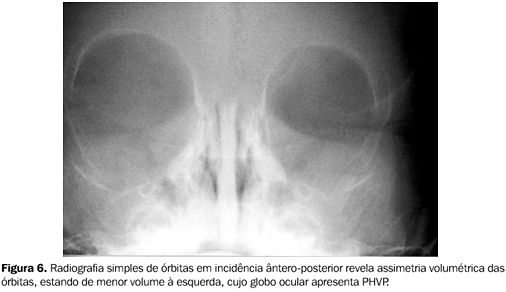
Pacientes com PHVP bilateral podem apresentar aumento difuso da densidade do vítreo, com formação de nível líquido-líquido decúbito-dependente e valores elevados de atenuação no espaço retro-hialóide (hemorragia)(18). Após a injeção endovenosa do meio de contraste iodado, ocorre realce do vítreo e da porção posterior da lente, revelando deformidade desta(1). Alterações involutivas do globo ocular acometido podem ser acompanhadas por assimetria óssea orbitária, também mostradas em radiografias simples (Figura 6).
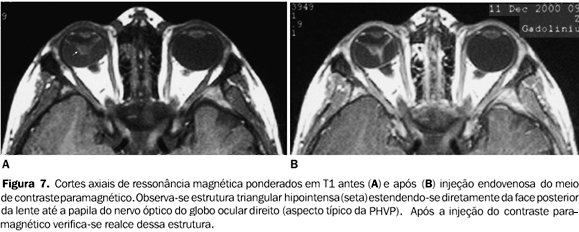
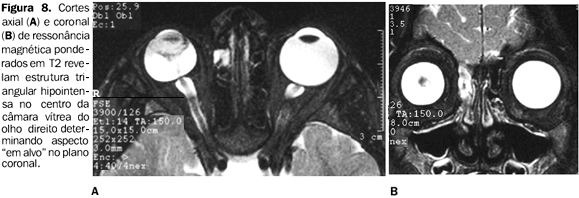
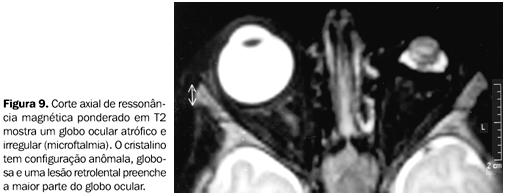
Ressonância magnética A RM oferece maior sensibilidade e especificidade quanto à diferenciação das diversas afecções intra-oculares que cursam com leucocoria, evidenciando anormalidades de simetria e de configuração do globo ocular(2). Também pode demonstrar os vários aspectos inerentes à PHVP, portanto sendo altamente específica para o diagnóstico desta entidade(12). A especificidade diagnóstica depende da demonstração do baixo sinal da placa fibrovascular retrolental, em íntima associação com anormalidades na configuração da lente, dentro de um pequeno globo ocular(12). A apresentação clássica do remanescente vascular hialóide nos exames de RM inclui uma estrutura linear hipointensa nas seqüências ponderadas em T1, estendendo-se diretamente da parte posterior da lente até a papila do nervo óptico(12). A câmara vítrea costuma ser hiperintensa nas imagens ponderadas em T1 e em T2(1,12), devido à hemorragia associada no seu interior(12). A placa retrolental, por ser altamente vascularizada, pode apresentar realce pelo meio de contraste paramagnético (gadolínio)(12)(Figuras 7 e 8).
A configuração da lente comumente é anormal na PHVP (Figura 9). Porém, se a configuração da lente é normal, na presença de uma lesão retrolental, outro diagnóstico deve ser fortemente considerado, tal como o retinoblastoma(12).
Nos pacientes com PHVP causada pela doença de Norrie, a RM revela microftalmia e hiperintensidade da câmara vítrea em todas as seqüências. Naqueles com síndrome de Warburg há descolamento bilateral da retina com hiperintensidade do fluido sub-retiniano na câmara vítrea. A aparência de RM na retinopatia do prematuro pode ser idêntica aos achados da PHVP(2). O descolamento de retina que ocorre na PHVP pode ter dois aspectos: 1) elevação da retina dentro do vítreo a partir do nervo óptico (lembrando a forma adquirida de descolamento de retina); 2) elevação da retina a partir de um ponto na parede do globo ocular, excêntrico ao nervo óptico (lembrando uma prega falciforme ou descolamento congênito da retina)(2).
DIAGNÓSTICO DIFERENCIAL O diagnóstico diferencial se faz com as várias causas de leucocoria: retinoblastoma, retinopatia da prematuridade, doença de Norrie, descolamentos da retina neonatais, doença de Coats e toxocaríase(13). O retinoblastoma é habitualmente distinguido da PHVP em virtude da ausência de catarata e microftalmia(6). A presença de calcificações intra-oculares é muito sugestiva de retinoblastoma, ocorrendo na maioria dos casos(13). Na PHVP não há calcificação(6,13), exceto nos casos crônicos de phthisis bulbi. A TC é superior à RM na detecção de calcificações em retinoblastomas(1), porêm os casos sem calcificações nem sempre são facilmente diferenciados da PHVP pela TC. Em tais circunstâncias, a RM é superior à TC na diferenciação entre esses tumores não-calcificados e a PHVP(1).
TRATAMENTO Entre as três apresentações da PHVP, apenas os globos oculares com a variante anterior têm bom prognóstico funcional, após intervenção cirúrgica(6). As anormalidades do pólo posterior vigentes nas formas puramente posterior e na combinada anterior-posterior determinam resultados pós-cirúrgicos insatisfatórios(6). Na variante anterior da PHVP, se a catarata é branda, o tratamento da ambliopia e a realização de exames clínicos freqüentes podem ser o suficiente. Se a catarata é densa e não há marcada microftalmia, a re-tirada da lente pode ser útil(6,11). A implantação de lentes intra-oculares pode ser uma opção benéfica e favorável para o manejo de crianças com PHVP unilateral(19). Na variante posterior, o tratamento cirúrgico deve ser evitado, devido ao alto risco de descolamento de retina(9). A intervenção da HPVP, em sua forma completa (anterior e posterior), consiste em ablação da parte plana do cristalino com vitrectomia em um mesmo tempo operatório, associado à coagulação e secção da artéria hialóide. Esta é benéfica em todos os casos porque evita o surgimento de complicações, tais como glaucoma neovascular, hemorragias intravítreas repetidas e phthisis bulbi(7).
CONCLUSÕES A associação de uma acurada avaliação clínica com os exames de imagem fornece subsídios suficientes para um diagnóstico preciso da PHVP. As limitações de cada um dos métodos diagnósticos reforçam a importância da complementação entre eles, objetivando reduzir as chances de erros de avaliação e, conseqüentemente, condutas inadequadas. Por isso, a difusão dos padrões de apresentação da PHVP por métodos de imagem torna-se relevante entre médicos radiologistas e oftalmologistas.
REFERÊNCIAS 1.Mafee MF, Goldberg MF. Persistent hyperplastic primary vitreous (PHPV): role of computed tomography and magnetic resonance. Radiol Clin North Am 1987;25:683–92. [ ] 2.Mafee FM. Eye and orbit. In: Som PM, Curtin HD, eds. Head and neck imaging. 3rd ed. St. Louis: Mosby, 1996:1030–6. [ ] 3.Mihmanli I, Albayran MS, Kantarci F, Adalitli I, Islak C, Altug A. Persistent hyperplastic primary vitreous and von Hippel-Lindau disease: contributions of color Doppler ultrasonography. J Ultrasound Med 2002;21:565–8. [ ] 4.Hosten H, Bornfeld H. Globe. In: Hosten H, Bornfeld H, eds. Imaging of the globe and orbit – a guide to differential diagnosis. New York: Thieme, 1998: 165–6. [ ] 5.Reese AB. Persistent hyperplastic primary vitreous. Am J Ophthalmol 1965;40:317–31. [ ] 6.Silbert M, Gurwood AS. Persistent hyperplastic primary vitreous. Clin Eye Vis Care 2000;12:131–7. [ ] 7.Monnot JP, Assi A. Persistance et hyperplasie du vitré primitif: resultats à moyen terme de la vitrectomie. J Fr Ophtalmol 1992;15:269–73. [ ] 8.Awan JK, Humayun M. Changes in the contralateral eye in uncomplicated persistent hyperplastic primary vitreous in adults. Am J Ophthalmol 1985;99:122–4. [ ] 9.Hermsem VM, Conahan BJ, Koops BL, Cunningham RD. Persistent hiperplastic primary vitreous associated with protein C deficiency. Am J Ophthalmol 1990;109:608–9. [ ] 10.Marshman WE, Jan JE, Lyons CJ. Neurologic abnormalities associated with persistent hyperplastic primary vitreous. Can J Ophthalmol 1999;34:17–22. [ ] 11.Roussat B, Barbat V, Cantaloube C, Baz P, Iba-Zizen MT, Hamard H. Syndrome de persistance et d'hyperplasie du vitré primaire. Aspects cliniques et thérapeutiques. J Fr Ophtalmol 1998;21:501–7. [ ] 12.Atlas SW, Galetta SL. The orbit and visual system. In: Atlas SW, ed. Magnetic resonance imaging of the brain and spine. 2nded. Philadelphia: Lippincott Williams & Wilkins, 1996:1026. [ ] 13.Sallum JMF, Moreira Jr CA. Anomalias vítreas congênitas. In: Abujanra S, Ávila M, Barsante C, et al., eds. Retina e vítreo – clínica e cirurgia. São Paulo: Roca, 2000:245–61. [ ] 14.Balmer A, Munier F. Leukokoria in a child: emergency and challenge. Klin Monatsbl Augenheilkd 1999;214:332–5. [ ] 15.Berges O, Vignaud J. Ophtalmologie – l'oeil et l'orbite. In: Vignaud J, Cosnard G, eds. Imagerie par résonance magnétique cranio-encéphalique. Paris: Vigot, 1991:555–6. [ ] 16.Menchini U, Pece A, Alberti M, Serini P, Brancato R. Vitré primitif hyperplasique avec persistance de l'artère hyaloïde, chez deux frères non jumeaux. J Fr Ophtalmol 1987;10:241–5. [ ] 17.Pieroni G, Russo M, Bolli V, Abbasciano V, Fabrizzi G. Ecografia oculare in pediatria: persistenza del vitreo primitivo iperplastico. Radiol Med (Torino) 2001;101:270–4. [ ] 18.Smirniotopoulos JG, Bargallo N, Mafee MF. Differential diagnosis of leukokoria: radiologic-pathologic correlation. RadioGraphics 1994;14:1059–79. [ ] 19.Anteby I, Cohen E, Karshai I, BenEzra D. Unilateral persistent hyperplastic primary vitreous: course and outcome. JAAPOS 2002;6:92–9. [ ]
Recebido para publicação em 8/8/2002
* Trabalho realizado no Serviço de Diagnóstico por Imagem do Hospital das Clínicas da Faculdade de Medicina da Universidade Federal de Goiás (HC-FMUFG) e no Instituto Goiano de Radiologia (IGR) da Fundação José Normanha, Goiânia, GO. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554