Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 37 nº 5 - Set. / Out. of 2004
Vol. 37 nº 5 - Set. / Out. of 2004
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): João Bosco Ramos Borges, Paula Gemignani Soriano, Nestor de Barros, Aurélio Zecchi de Souza, Alfredo Carlos Dornelles Barros, Giovanni Guido Cerri, José Aristodemo Pinotti |
|
|
Descritores: Tumor mamário, Tumor mamário, Tumor mamário |
|
|
Resumo:
INTRODUÇÃO A incidência do câncer da mama nos EUA aumentou nas três últimas décadas(1,2). No Brasil é estimada, em 2003, a ocorrência de cerca de 41.000 casos novos desta doença e de 9.000 mortes provocadas por este tipo de câncer(3), causadas principalmente por metástases a distância. O tamanho do tumor e a avaliação histopatológica do comprometimento axilar linfonodal são indicadores prognósticos de sobrevida em pacientes com câncer da mama utilizados na prática clínica. Outros indicadores prognósticos são o grau histológico e a avaliação dos receptores hormonais destes tumores. Novos marcadores prognósticos a serem testados devem ser capazes de identificar pacientes que tenham maior ou menor risco de desenvolver doença sistêmica. O papel da angiogênese no entendimento da biologia e do comportamento tumoral é matéria de interesse crescente(4). Apesar de não específicos, vasos anormais estão aumentados nos tumores e têm comportamento fluxométrico característico(5,6). O estudo da distribuição vascular e das características fluxométricas dos vasos em lesões mamárias malignas poderia contribuir para identificar eventual padrão vascular característico e seu papel na gênese de metástases a distância. Neste contexto, o objetivo deste estudo foi avaliar o padrão vascular de tumores primários da mama pelo "color" Doppler ultra-sonográfico e correlacionar a vascularização destes tumores com os parâmetros de sobrevida já consagrados, buscando identificar eventual valor prognóstico da dopplerfluxometria em pacientes portadoras de carcinoma da mama.
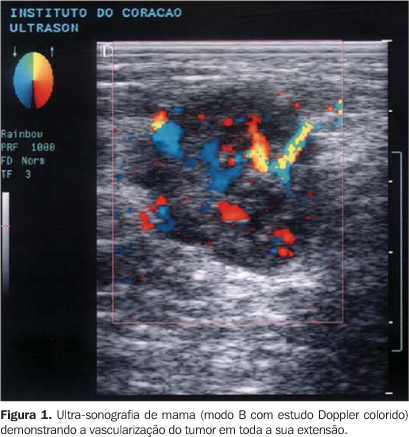
MATERIAIS E MÉTODOS Entre novembro de 1995 e outubro de 1997 estudamos 66 pacientes portadoras de carcinoma da mama comprovado histologicamente e que se encontravam nos estádios clínicos TNM I, II e III, de acordo com a Organização Mundial da Saúde (WHO)(7). Foram excluídas do estudo pacientes com tumor mamário bilateral (sincrônico ou metacrônico), aquelas submetidas a estrogenioterapia atual ou pregressa nos últimos três meses, as que se encontravam no ciclo grávido-puerperal e aquelas que haviam sido previamente biopsiadas ou submetidas a quimioterapia, ou ainda que apresentassem processo inflamatório mamário em atividade. A média etária foi de 52 anos, variando entre 28 e 74 anos. Eram da raça branca 70% das pacientes, da raça negra 27% e da raça amarela 3%. Antes do início do estudo as pacientes foram informadas dos procedimentos e etapas a serem desenvolvidos, e suas participações foram voluntárias. Este trabalho foi aprovado pela comissão de ética da instituição. As pacientes foram submetidas a estadiamento clínico, exame ginecológico e ultra-sonografia. O tamanho clínico do tumor foi obtido medindo-se os seus dois maiores diâmetros, em milímetros, com o auxílio de um paquímetro. Para o estudo ultra-sonográfico empregou-se aparelho Diasonics (EUA), modelo Gateway, com transdutor linear de banda larga com 5–10 MHz. As mamas foram examinadas com a paciente na posição supina, com os braços colocados sob a cabeça, no sentido látero-medial e crânio-caudal, observando-se idêntica sistematização tanto para as glândulas com tumor quanto para as mamas sadias contralaterais. Foi realizado, inicialmente, exame de ultra-sonografia convencional (modo B), seguido do exame com Doppler pulsátil (registro do espectro) e do exame com Doppler colorido. O tumor era avaliado fazendo-se varreduras axiais e longitudinais: o tamanho da neoplasia foi considerado como a maior medida em centímetros obtida em qualquer um dos cortes. No nódulo mamário visualizado pela ultra-sonografia foi feito estudo com Doppler colorido, avaliando-se a área máxima de 16 cm2, correspondente ao campo máximo em que o aparelho detectou fluxo. O aparelho foi ajustado para máxima sensibilidade, com filtro mínimo, em torno de 100 MHz, e "space peak temporal average" (SPTA) menor que 500 mW/cm2, o que permitia detectar pequenas mudanças de fluxo. Para a análise espectral convencionou-se que o vaso a ser registrado tivesse o Doppler ajustado em ângulo zero, já que quanto menor este ângulo, melhor seria o efeito Doppler(8). Identificamos a presença ou ausência de vascularização nos nódulos, e de cada nódulo com vascularização foram avaliados: a) o número de vasos na extensão mapeada do nódulo mamário que tinha padrão de espectro arterial (Figura 1);
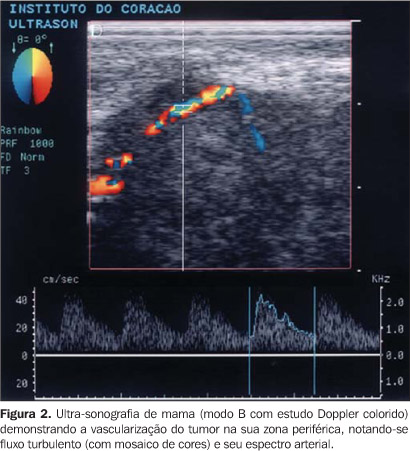
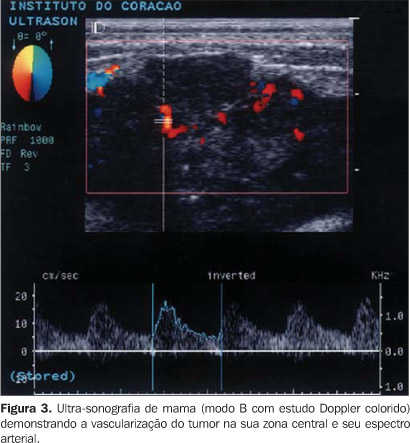
b) a distância do vaso detectado à borda do tumor, estipulando-se faixa de 2 mm como zona periférica do tumor, identificando-se dois grupos de vasos: centrais e periféricos (Figuras 2 e 3);
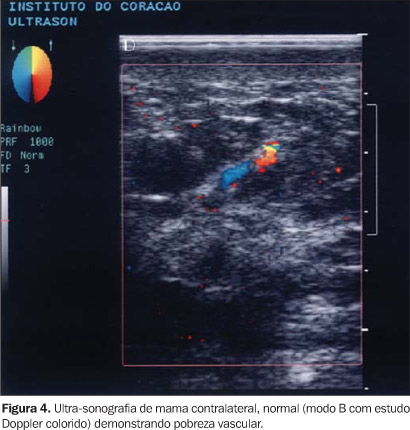
c) o padrão fluxométrico pelo espectro vascular (Figuras 2 e 3) ao Doppler colorido de três vasos, quando detectados, sendo dois no tumor e um na mama contralateral. Destes vasos foram quantificados os picos de velocidade sistólica e velocidade diastólica e os índices de pulsatilidade e resistência. Calculou-se o índice de pulsatilidade através do quociente entre pico sistólico (velocidade sistólica máxima) subtraído da diástole final e velocidade média, e o índice de resistência, através do quociente entre pico sistólico subtraído da diástole final e velocidade sistólica. Na mama contralateral, considerada como "padrão normal" ou controle (Figura 4), também se quantificou o número de estruturas vasculares arteriais e seu padrão fluxométrico no quadrante correspondente ao do nódulo tumoral ("imagem em espelho"), em região correspondente à área em que se avaliou o número de vasos do tumor até o máximo de 16 cm2, calculando-se os mesmos índices obtidos para os vasos do nódulo.
Após o exame dopplerfluxométrico, as pacientes foram submetidas a biópsia de fragmento ("core biopsy") guiada pela ultra-sonografia, com pistola automática Manan-Pro Mag 2.2 (Manan Scientific Products, Northbrook, Illinois) e com agulha 16 gauge. O grau histológico dos tumores foi avaliado pela técnica de graduação aprimorada por Elston e Ellis(9) e classificado em grau I (bem diferenciado), grau II (moderadamente diferenciado) e grau III (pouco diferenciado). O grau nuclear foi estabelecido de I a III, segundo critérios descritos por Dabbs(10). As variáveis quantitativas foram representadas em tabelas por média, desvio-padrão, valores mínimos e máximos, e as variáveis qualitativas, em tabelas com freqüências e porcentagens. Como as observações nas três regiões de interesse dopplerfluxométrico (centro e periferia do tumor e mama contralateral) envolveram as mesmas pacientes, a comparação entre elas com relação às respostas médias foi feita por análise de regressão multivariada(11). O estadiamento do tumor, o grau histológico e o grau nuclear também foram variáveis explicativas levadas em conta nas comparações de interesse. Para cada uma das cinco características dopplerfluxométricas consideradas (número de vasos, velocidade sistólica, velocidade diastólica, índice de resistência e índice de pulsatilidade) ajustaram-se dois modelos de análise. No primeiro modelo, as variáveis explicativas foram consideradas simultaneamente, e no segundo modelo cada variável foi considerada individualmente. Um terceiro modelo, ajustado a cada uma das cinco características dopplerfluxométricas em questão, incluiu somente as variáveis com efeitos significativos (p < 0,05) nos dois modelos iniciais. As respostas médias correspondentes às três regiões de estudo foram comparadas através de testes T2 de Hotelling e testes t pareados, com nível de significância corrigido pela técnica de Bonferroni(11,12). Com a finalidade de avaliar a necessidade de inclusão do tamanho clínico e do tamanho ultra-sonográfico como variáveis explicativas nos modelos de análise de regressão multivariada(11) utilizados na análise estatística, calculamos o correspondente coeficiente de correlação linear, cujo valor foi de 0,57 ± 0,09, com limites do intervalo de confiança de 95% dados por 0,39 e 0,72. Estas informações indicaram que apenas uma delas deveria ser incluída nos modelos. Optamos pela medida ultra-sonográfica, por ser mais precisa que a medida clínica.
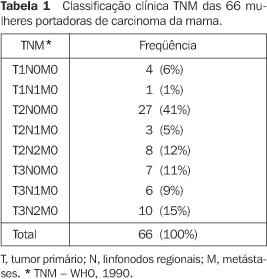
RESULTADOS Todos os tumores eram carcinomas invasivos, sendo 95% (63/66) do tipo ductal e os três restantes do tipo lobular. Em relação ao grau histolológico, 11% (7/66) eram carcinomas bem diferenciados, 71% (47/66) eram carcinomas moderadamente diferenciados e 18% (12/66), carcinomas indiferenciados. Quanto ao grau nuclear, quatro tumores (6%) eram grau I, 48 (73%) eram grau II e 14 (21%), grau III O tamanho clínico médio do tumor foi de 50,4 ± 29,5 mm e o tamanho ultra-sonográfico médio foi de 24,1 ± 12,4 mm. Quase a metade das pacientes se encontrava no estádio clínico T2N0M0 (Tabela 1), e dois quintos das pacientes se encontravam no estádio IIa e outros dois quintos no estádio IIIa (Tabela 2).
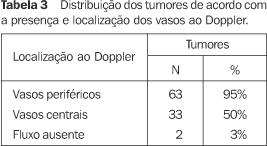
Nos 66 tumores de mama foram identificados vasos em 64 (97%), sendo que em 63 (95%) os vasos estavam localizados na periferia e em 33 (50%) situavam-se na porção central. Em dois casos (3%) não havia vasos (Tabela 3)
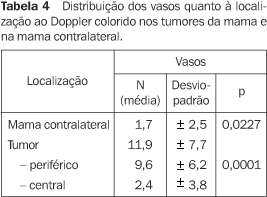
A análise estatística dos dados dos tumores em que foram observados vasos sugeriu que o número médio desses vasos (11,9 ± 7,7) foi significativamente maior (p = 0,0227) que o número médio de vasos na mama contralateral (1,7 ± 2,5) (Tabela 4). Além disso, observou-se que o número de vasos na periferia do tumor (9,6 ± 6,2) foi significativamente maior (p < 0,0001) que o número médio de vasos no centro do tumor (2,4 ± 3,8).
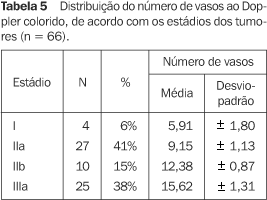
As velocidades sistólicas médias na periferia e no centro do tumor puderam ser consideradas iguais a 11,74 ± 0,96 (p = 0,9380) e diferentes da velocidade sistólica média da mama contralateral (p = 0,0201), cujo valor é de 9,45 ± 0,55. Não observamos diferenças nos valores da velocidade sistólica e dos índices de resistência e pulsatilidade medidos no tumor e os medidos na mama normal. Nenhuma das variáveis candidatas deve ser levada em consideração na comparação das regiões de interesse quanto a velocidade sistólica, velocidade diastólica e índice de resistência. Nenhuma associação foi feita entre o resultado das análises fluxométricas com os aspectos histológicos, incluindo graus histológicos e nucleares. A única variável estatisticamente significativa foi o estadiamento, observando-se que o número de vasos aumentou com a progressão do estadiamento do câncer. O ajuste de um modelo reduzido envolvendo apenas essa variável explicativa indica que o número médio de vasos no tumor foi de 5,91 ± 1,80 para pacientes com estadiamento I, de 9,15 ± 1,13 para pacientes com estadiamento IIa, de 12,38 ± 0,87 para pacientes com estadiamento IIb e de 15,62 ± 1,31 para pacientes com estadiamento IIIa (Tabela 5).
DISCUSSÃO A complexidade diagnóstica, a imprevisibilidade da evolução e o prognóstico do câncer mamário têm motivado muitos estudos, visando ao diagnóstico precoce e à melhoria dos resultados terapêuticos. Delorme et al.(13) e Sohn et al.(14) foram os primeiros a admitir que o fluxo sanguíneo dos tumores malignos associa-se ao prognóstico tumoral. Muitos trabalhos têm utilizado o Doppler colorido(15-18) para avaliar as características qualitativas e quantitativas do vasos relacionados aos tumores. A caracterização dos tumores malignos de mama de acordo com sua vascularização poderia eventualmente ser correlacionada com evolução prognóstica diferente. Peter-Engl et al.(19) mostraram que o fluxo sanguíneo medido pela ultra-sonografia pode ser um fator prognóstico independente na sobrevida de doentes com câncer de mama. O presente estudo se propôs avaliar o papel do Doppler como fator prognóstico e avaliar a quantificação e distribuição dos vasos na periferia e no centro do tumor, comparando-as com os achados de mama normal e com os fatores prognósticos clássicos. Dada a importância cada vez maior do estudo da angiogênese tumoral e sabendo da diferença na atividade angiogênica no interior do tumor e na sua periferia, tornou-se interessante avaliar os índices dopplerfluxométricos naquelas duas regiões do carcinoma. Chao et al.(17) relatam valores maiores e significativos nos índices de resistência e pulsatilidade e da velocidade sístólica nos carcinomas da mama. Diferenças nos índices dopplerfluxométricos entre mama com tumor e mama contralateral foram identificadas anteriormente(20,21). O achado dopplerfluxométrico importante a ser considerado neste estudo é que, exceto a velocidade sistólica, que foi diferente na mama contralateral, todos os outros índices foram iguais nas três regiões analisadas. Vasos no centro e na periferia do tumor, e em mama normal contralateral, apresentaram as mesmas velocidades diastólicas médias, os mesmos índices de resistência médios e os mesmos índices de pulsatilidade. A diferença entre a velocidade sistólica média do tumor e da mama contralateral era esperada, considerando-se a queda da variação sistólica-diastólica por perda da musculatura lisa destes neovasos e decréscimo da elasticidade dentro do tumor(22), permitindo alta velocidade sanguínea. Consideramos, porém, que a diferença percebida na velocidade sistólica necessita de confirmação em estudos posteriores com casuística maior. No presente estudo, a relação entre velocidade sistólica e estadiamento clínico esteve muito próxima da significância estatística, quando analisados individualmente. No entanto, considerando as outras variáveis estatísticas, como tamanho do tumor, grau histológico e grau nuclear, não foi mantida esta tendência à significância. Na revisão da literatura, Cosgrove et al.(23) encontraram, em tumores malignos, maior velocidade sistólica, associada ao aumento do número de vasos e do volume tumoral. Delorme et al.(13) apresentaram correlação positiva entre achados dopplerfluxométricos e tamanho tumoral. Sahin-Akyar e Sumer(24) encontraram associação estatisticamente significativa entre a velocidade sistólica e o tamanho do tumor no estudo do carcinoma mamário com Doppler colorido. Observa-se, no entanto, que esses trabalhos não definem suas amostras no que se refere às características que podem influenciar nos achados dopplerfluxométricos dos tumores (estadiamento, grau histológico e grau nuclear do tumor), o que pode justificar os resultados diferentes daqueles com os obtidos no presente estudo. Neste estudo, nenhuma correlação foi estabelecida entre os achados dopplerfluxométricos e os graus histológico e nuclear dos 66 tumores malignos de mama, salientando-se então a importância de se quantificar o número de vasos do tumor. Castagnone et al.(25) encontraram nítida associação entre o número de vasos e o tamanho tumoral, nos casos de massas menores que 2 cm. Ao analisarmos individualmente apenas o tamanho tumoral, notou-se significância estatística também nestes resultados (p = 0,0026). Entretanto, esta desapareceu ao se analisar as outras variáveis conjuntamente. Em nosso trabalho nenhuma diferença foi encontrada quanto ao número de vasos quando se considerava a variável tamanho do tumor, de acordo com estadiamento tumoral, ou seja, o tamanho do tumor de mama não exerceu efeito significativo sobre o número de vasos tumorais quando considerado em conjunto com as outras variáveis explicativas, tais como estadiamento, grau histológico ou nuclear do tumor (p = 0,1479). Fator que deve ser levado em conta é que os tumores por nós estudados tinham tamanho médio de 5 cm, aproximadamente. Na análise da associação entre graus tumorais e resultados do Doppler em pesquisas realizadas, houve associação do grau de malignidade com aumento da vascularização tumoral, porém não foi considerada a distribuição dos graus histológico e nuclear dos tumores(26,27). Na nossa casuística, mais de 70% dos tumores eram de moderada agressividade (grau histológico II e grau nuclear II), o que poderia induzir resultados diferentes, por exemplo, de outro estudo em que predominassem tumores bem diferenciados. A despeito dessas diferenças metodológicas, o número de vasos mostrou correlação significante com o estádio do câncer mamário. Considerando que o número de vasos cresceu com o aumento progressivo do estadiamento clínico e que os tumores mais vascularizados não se correlacionaram com o tamanho tumoral, foi permitido supor que os tumores mais vascularizados, independente do tamanho tumoral, tenderiam a ser aqueles que evoluiriam para estadiamentos progressivamente mais avançados. É possível a existência de dois grupos de suportes vasculares diferentes que, seguramente, imprimirão ritmo de crescimento e metastatização diferenciados. O entendimento destes achados seguramente ajudarão a compreender melhor a biologia dos tumores mamários. É importante salientar que uma ilação que poderia ser realizada é que se os tumores crescem e pertencem a estádios mais avançados, logicamente apresentarão aumento similar de vasos, acompanhando este crescimento tumoral. No entanto, não houve associação estatisticamente significativa entre tamanho do tumor e número de vasos. Devem existir, portanto, outros parâmetros relacionados ao estadiamento, que não só o tamanho do tumor, influenciando o aumento de vasos na neoplasia de mama. A primeira publicação que correlacionou angiogênese tumoral e evolução da doença apontou o número de microvasos nas áreas de mais intensa neovascularização de carcinomas mamários como preditor independente de doença metastática axilar ou a distância(28). Grischke et al.(29) detectaram fluxo sanguíneo no centro de tumores malignos em 71% dos casos e na periferia em 83%. Sahin-Akyar e Sumer(24) avaliaram, subjetivamente, a vascularização de 28 tumores malignos: vasos na periferia foram vistos em sete casos (25%), vasos penetrando dentro dos tumores foram observados em 15 (mais de 50%) casos, e em seis tumores (quase 25%) os vasos se apresentaram ao acaso. Observamos vascularização mais intensa na periferia do tumor do que no seu centro, o que é consistente com os resultados obtidos por Kubek et al.(30). Aproximadamente 70% dos tumores desta pesquisa eram moderadamente diferenciados e de grau nuclear II, portanto, mais agressivos e com ritmo de crescimento rápido. Estudos utilizando contrastes ultra-sonográficos mostram o aumento do número de vasos vistos após o uso desses agentes(31,32). O uso desses contrastes não foi objetivo do nosso trabalho, pela sua não disponibilidade fácil na prática diária; o eventual impacto do uso do contraste ultra-sonográfico em modificar nossos resultados, principalmente no tocante ao número de vasos identificados, é algo a ser desenvolvido em nossas pesquisas futuras A dopplerfluxometria no estudo dos tumores malignos de mama é exame de execução rápida, sem irradiação, podendo ser repetido quantas vezes for necessário; é de alto benefício no diagnóstico diferencial de tumores de mama, complementando exames mamográficos duvidosos, estudando áreas de densidade radiológica a esclarecer, avaliando e fazendo seguimento de mamas submetidas a tratamento conservador de câncer. No entanto, o papel do Doppler no prognóstico nos tumores de mama é assunto que se começa a discutir. O que se propõe aqui é mais uma metodologia que poderia nortear o clínico e o cirurgião na abordagem diferenciada da terapia, de acordo com o perfil vascular caracterizado à dopplerfluxometria. Apesar destes resultados promissores, em estudo futuro é necessário dividir os tumores mamários em dois grupos: os muito vascularizados e os menos vascularizados ao Doppler colorido, realizando estudo histológico quantitativo dos vasos e prospectivamente diferenciando seus perfis (no comportamento de recidivas local e a distância). Poder-se-ia, assim, aprender muito da biologia dos tumores mamários e, com isto, melhor interferir no processo terapêutico, quiçá mudando seu prognóstico. Concluindo, estudamos a vascularização de tumores mamários com Doppler, avaliando o número, a morfologia e o padrão fluxométrico de vasos intratumorais. Nenhuma correlação foi estabelecida entre o tamanho dos tumores, seus graus histológico e nuclear e suas características vasculares. Nossos resultados mostraram que o número de vasos dos tumores mamários pode potencialmente ser levado em conta, junto aos outros fatores prognósticos destes tumores, apesar de ser necessário confirmar estes achados em outros trabalhos.
REFERÊNCIAS 1. Parker SL, Tong T, Bolden S, Wingo PA. Cancer statistics, 1997. CA Cancer J Clin 1997;47:5-27. [ ] 2. Chu KC, Tarone RE, Kessler LG, et al. Recent trends in US breast cancer incidence, survival, and mortality rates. J Natl Cancer Inst 1996;88:1571-9. [ ] 3. Brasil. Instituto Nacional do Câncer, Ministério da Saúde. Estimativas de câncer para 2003. Rio de Janeiro, RJ: INCA, 2003. www.inca.gov.br [ ] 4. Burger MM, Folkman J. UICC study group on basic and clinical cancer research: tumor angiogenesis. Int J Cancer 1994;56:311-3. [ ] 5. Taylor KJ, Ramos I, Carter D, Morse SS, Snower D, Fortune K. Correlation of Doppler US tumor signals with neovascular morphologic features. Radiology 1988;166:57-62. [ ] 6. Srivastava A, Webster DJ, Woodcock JP, Shrotria S, Mansel RE, Hughes LE. Role of Doppler ultrasound flowmetry in the diagnosis of breast lumps. Br J Surg 1988;75:851-3. [ ] 7. World Health Organization. Histological typing of breast tumors. Tumori 1982;68:181-98. [ ] 8. Madjar H, Prompeler HJ, Sauerbrei W, Wolfarth R, Pfleiderer A. Color doppler flow criteria of breast lesions. Ultrasound Med Biol 1994;20:849-58. [ ] 9. Elston CW, Ellis IO. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 1991; 19:403-10. [ ] 10. Dabbs DJ. Role of nuclear grading of breast carcinomas in fine needle aspiration specimens. Acta Cytol 1993;37:361-6. [ ] 11. Johnson RA, Wichern DW. Applied multivariate statistical analysis. New Jersey: Prentice-Hall, 1992. [ ] 12. Neter J, Kutner MH, Wasserman W, Nachtshein CJ. Applied linear statistical models. 4th ed. Homewood: Richard D. Irwin, 1996. [ ] 13. Delorme S, Anton HW, Knopp MV. Breast cancer: assessment of vascularity by colour Doppler. Eur Radiol 1993;3:253-7. [ ] 14. Sohn C, Thiel C, Baudendistel A, Von Fournier D, Bastert G. Welche Sicherheit bietet die konventionelle mammasonographie und farcodiet Sonographie in der Diagnostik von Mammatumoren? Zentralbl Gynäkol 1996;118:142-7. [ ] 15. Raza S, Baum JK. Solid breast lesions: evaluation with power Doppler US. Radiology 1997;203: 164-8. [ ] 16. Peter-Engl C, Medl M, Mirau M, et al. Color-coded and spectral Doppler flow in breast carcinomas — relationship with the tumor microvasculature. Breast Cancer Res Treat 1998;47:83-9. [ ] 17. Chao TC, Lo YF, Chen SC, Chen MF. Color Doppler ultrasound in benign and malignant breast tumors. Breast Cancer Res Treat 1999;57:193-9. [ ] 18. Mehta TS, Raza S. Power Doppler sonography of breast cancer: does vascularity correlate with node status or lymphatic vascular invasion? AJR 1999; 173:303-7. [ ] 19. Peters-Engl C, Frank W, Leodolter S, Medl M. Tumor flow in malignant breast tumors measured by Doppler ultrasound: an independent predictor of survival. Breast Cancer Res Treat 1999;54:65-71. [ ] 20. Sohn C, Stolz W, Grischke EM, Wallwiener D, Bastert G, Fournier D. Die dopplersonographische Untersuchung von Mammatumoren mit hilfe der Farbdopplersonographie, der Duplexsonographie und des CW-Dopplers. Zentralbl Gynäkol 1992; 114:249-53. [ ] 21. Blohmer JU, Chaoui R, Schmalisch G, Bollmann R, Lau HU. Differential breast tumor diagnosis by comparing blood circulation of the tumor with the contralateral breast using color coded, pulsed Doppler ultrasound. Geburtshilfe Frauenheilkd 1995; 55:1-6. [ ] 22. Dock W, Grabenwöger F, Metz V, Eibenberger K, Farrés MT. Tumor vascularization: assessment with duplex sonography. Radiology 1991;181:241-4. [ ] 23. Crosgrove DO, Kedar RP, Bamber JC, et al. Breast diseases: color Doppler US in differential diagnosis. Radiology 1993;189:99-104. [ ] 24. Sahin-Akyar G, Sumer H. Color Doppler ultrasound and spectral analysis of tumor vessels in the differential diagnosis of solid breast masses. Invest Radiol 1996;31:72-9. [ ] 25. Castagnone D, Rescalli S, Rivolta R, Poma S. Color Doppler ultrasonography in the diagnosis of solid breast lesions. Minerva Chir 1995;50:475-9. [ ] 26. Holcombe C, Pugh N, Lyons K, Douglas-Jones A, Mansel RE, Horgan K. Blood flow in breast cancer and fibroadenoma estimated by colour Doppler ultrasonography. Br J Surg 1995;82:787-8. [ ] 27. Kutschker C, Allgayer B, Hauck W. Evaluating the morphology of uncertain breast tumors using color coded Doppler ultrasound. Ultraschall Med 1996; 17:18-22. [ ] 28. Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis — correlation in invasive breast carcinoma. N Engl J Med 1991;324: 1-8. [ ] 29. Grischke EM, von Fournier D, Sohn C, Wallwiener D, Bastert G. Diagnostische Wertigkeit der dopplersonographie bei der Beurteilung von Mammatumoren. Zentralbl Gynäkol 1996;118:553-9. [ ] 30. Kubek KA, Chan L, Frazier TG. Color Doppler flow as an indicator of nodal metastasis in solid breast masses. J Ultrasound Med 1996;15:835-41. [ ] 31. Kedar RP, Cosgrove D, McCready VR, Bamber JC, Carter ER. Microbubble contrast agent for color Doppler US: effect on breast masses. Work in progress. Radiology 1996;198:679-86. [ ] 32. Yang WT, Metreweli C, Lam PKW, Chang J. Benign and malignant breast masses and axillary nodes: evaluation with echo-enhanced color power Doppler US. Radiology 2001;220:795-802. [ ]
Recebido para publicação em 22/10/2003. Aceito, após revisão, em 12/11/2003
* Trabalho realizado no Departamento de Ginecologia e Obstetrícia e no Departamento de Radiologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554