Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 37 nº 5 - Set. / Out. of 2004
Vol. 37 nº 5 - Set. / Out. of 2004
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Alexandre Sérgio de Araújo Bezerra, Giuseppe D'Ippolito, Rogério Pedreschi Caldana, Alexandre Oliveira Cecin, Jacob Szejnfeld |
|
|
Descritores: Hepatopatias parasitárias, Esplenopatias, Esquistossomose mansoni, Ressonância magnética |
|
|
Resumo: IIIPós-graduandos do Departamento de Diagnóstico por Imagem da Unifesp/EPM
INTRODUÇÃO A esquistossomose mansônica é uma doença endêmica em muitos países e representa importante problema de saúde pública no Brasil(1,2). Apesar das medidas governamentais de controle do parasita, existem ainda muitos focos da doença em nosso território, inclusive no estado de São Paulo, determinando elevada morbidade, especialmente nos casos da forma hepatoesplênica(3,4). Esta forma da doença caracteriza-se pelo quadro de hepatopatia com fibrose periportal, hipertensão portal e esplenomegalia, que determina maior probabilidade de surgimento de complicações como o sangramento de varizes esofágicas(5). Dessa maneira, é importante que estes pacientes sejam acompanhados periodicamente para avaliação do grau de comprometimento hepático e de complicações associadas, como a presença de circulação colateral(6). Tradicionalmente, a ultra-sonografia (US) tem sido o método mais utilizado para o diagnóstico e acompanhamento de pacientes esquistossomóticos, principalmente daqueles que não apresentam mais os sinais da forma aguda da doença(6). Trabalhos publicados em diversos países e também por autores nacionais têm procurado demonstrar os principais aspectos de imagem da esquistossomose, entre eles a fibrose periportal, cuja apresentação é praticamente patognomônica da doença(7-10). Na US a fibrose periportal caracteriza-se por bandas hiperecogênicas ao longo dos vasos portais, representando o intenso processo fibrótico desenvolvido pelo organismo em resposta à deposição de ovos do parasita nesta região, o que torna a esquistossomose modelo de doença fibrogênica hepática, sem cirrose associada(11). Os outros achados observados com o uso da US em pacientes portadores de esquistossomose são alterações morfológicas decorrentes desse processo histopatológico. Foram descritos, nos casos avançados da doença, alterações como redução do lobo hepático direito e aumento compensatório dos lobos esquerdo e caudado(8,9,12,13). As complicações decorrentes do regime de hipertensão portal a que esses pacientes estão submetidos também podem ser identificadas pela US e compreendem a esplenomegalia muitas vezes marcante, desenvolvida em casos crônicos, e a circulação colateral no leito vascular hepatomesentérico, melhor identificadas com estudo utilizando a técnica Doppler(14,15). Apesar de amplamente disponível e difundida, a US apresenta moderada concordância interobservador ao avaliar e classificar o envolvimento hepático pela esquistossomose, sendo que, em alguns casos, tornam-se necessários estudos complementares de imagem(16-19). Neste sentido, outros métodos de diagnóstico por imagem também têm sido utilizados para acompanhamento desses pacientes. Poucos estudos demonstraram o aspecto da hepatopatia esquistossomótica pela tomografia computadorizada (TC), encontrando-se achados superponíveis aos descritos para a US, como alterações da morfologia hepática, presença de hipertensão portal e fibrose periportal(20). A ressonância magnética (RM) tem sido pouco utilizada para a avaliação da esquistossomose. Os trabalhos publicados na literatura até o momento compreendem apenas relatos de casos, a maioria de pacientes provenientes de áreas endêmicas que manifestaram a doença em países mais desenvolvidos, tornando esses relatos descrições de uma enfermidade "exótica" para tais pesquisadores, apesar do aumento dos casos em áreas não endêmicas, em decorrência dos grandes movimentos migratórios(19,21-23). Não encontramos, na literatura, relatos do emprego da RM em séries de casos de pacientes esquistossomóticos que possam descrever as alterações hepáticas e esplênicas decorrentes desta afecção através da análise de um grupo maior de doentes. Com a utilização cada vez maior da RM para a avaliação do abdome superior, é importante conhecer quais as alterações que permitem estabelecer suspeição do diagnóstico da esquistossomose, avaliando também o grau de acometimento dos órgãos abdominais envolvidos por ela. Outras vantagens potenciais da RM são a elevada reprodutibilidade do método, a capacidade de avaliação panorâmica de toda a cavidade abdominal e a possibilidade de ser combinada com estudos angiográficos (angio-RM)(24). Diante dessas considerações, realizamos estudo em pacientes portadores de esquistossomose mansônica crônica com os objetivos de avaliar, qualitativamente e quantitativamente, as alterações morfológicas hepáticas e esplênicas através da RM e a reprodutibilidade do método na avaliação hepatoesplênica destes pacientes.
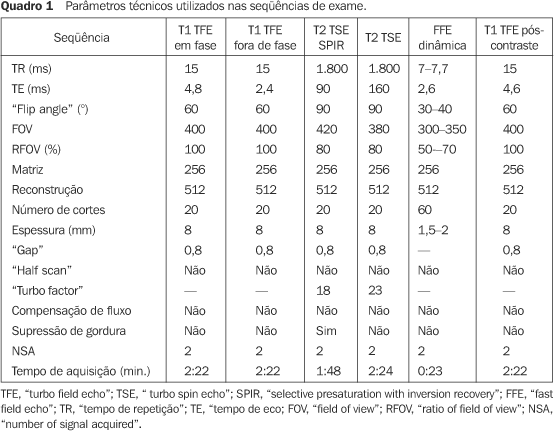
MATERIAIS E MÉTODOS No período de janeiro de 2001 a julho de 2002 foi realizado estudo prospectivo para avaliação das alterações morfológicas hepáticas e esplênicas em 28 pacientes portadores de esquistossomose mansônica hepatoesplênica crônica pela RM do abdome superior. O grupo de pacientes estudados foi constituído por 14 homens e 14 mulheres, com idade entre 29 e 61 anos (mediana = 42; média = 42,3). Entre os 28 pacientes esquistossomóticos estudados, nove tinham sido previamente submetidos a esplenectomia. Utilizamos como critérios de inclusão para o estudo: • pacientes com idade superior a 18 anos; • diagnóstico de esquistossomose mansônica por biópsia retal ou forte evidência clínico-laboratorial (sinais de hipertensão portal e/ou exame protoparasitológico de fezes positivo) e epidemiológica (contato com água de rios e lagoas em áreas endêmicas). Usamos como critérios de não-inclusão: • contra-indicação ao exame de RM (marcapasso cardíaco, implante coclear, claustrofobia, clipe de aneurisma cerebral, alergia ao contraste paramagnético); • antecedente de etilismo (ingesta maior que 160 g de etanol por semana); • sorologia positiva para vírus da hepatite B ou C; • antecedente de doença auto-imune comprovada que possa cursar com hepatite auto-imune; • uso conhecido de drogas hepatotóxicas. Os exames foram realizados em equipamento de RM marca Philips, modelo ACS/NT, operando em alto campo magnético (1,5 T), com gradiente de 15 mT/m. Utilizamos bobina de corpo para transmissão e recepção de sinais. A injeção do contraste paramagnético foi realizada com bomba injetora. Os exames foram realizados utilizando-se as técnicas TSE, FFE e TFE, com seqüências ponderadas em T1 (em fase e oposição de fase), em T2 com dois tempos de eco diferentes (90 e 160 ms) e em T1 após a injeção do contraste paramagnético, cinco minutos após o início desta. No tempo transcorrido entre a injeção do contraste e a obtenção da seqüência T1 pós-contraste foram obtidas imagens angiográficas com técnica FFE no plano coronal. A injeção do contraste (Gd-DTPA) foi realizada por bomba injetora mecânica, com velocidade de injeção de 3 ml/s. A dose de contraste variou entre 0,1 mmol/kg (equivalente a 0,2 ml/kg) e 0,2 mmol/kg (equivalente a 0,4 ml/kg). No Quadro 1 apresentamos os parâmetros técnicos utilizados nas diversas seqüências do exame.
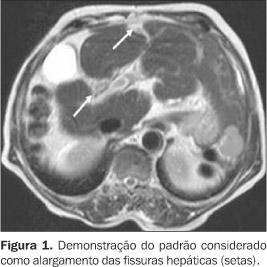
A interpretação das imagens foi feita por dois examinadores independentes, com experiência de pelo menos dois anos em RM do abdome. O intervalo entre as duas análises realizadas por cada observador foi de 30 dias. As imagens foram interpretadas buscando avaliar a presença ou ausência das seguintes alterações qualitativas hepáticas: a) alargamento de fissuras, caracterizado como identificação anormal de tecido adiposo entre as fissuras hepáticas (fissura transversa, fissura do ligamento venoso, fissura do ligamento redondo e a fossa da vesícula) (Figura 1);
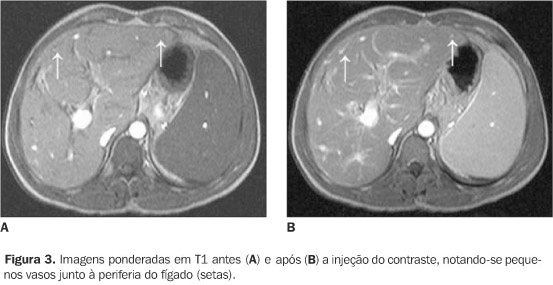
b) fibrose periportal, caracterizada por bandas hipointensas ao longo dos vasos periportais nas seqüências ponderadas em T1, hiperintensas nas seqüências em T2 e que apresentam realce após a injeção do contraste paramagnético(22,23,25) (Figura 2); c) heterogeneidade do parênquima hepático; d) irregularidade dos contornos hepáticos; e) presença de vasos periféricos hepáticos, caracterizada pela presença de pequenos vasos na periferia do parênquima hepático (Figura 3);
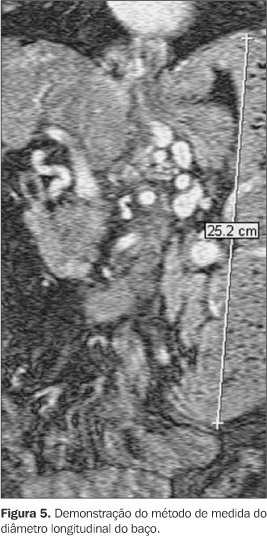
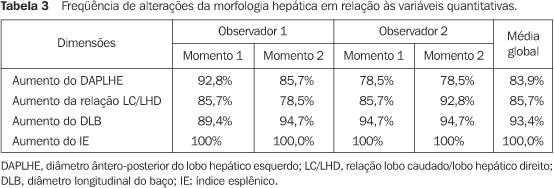
f) nódulos sideróticos esplênicos, caracterizados como imagens arredondadas com ausência de sinal em todas as seqüências estudadas e que não mostram realce após injeção do contraste(26-29) (Figura 4). Em uma estação de trabalho marca Philips modelo Easyvision® foram realizadas mensurações de diferentes variáveis morfológicas quantitativas hepáticas e esplênicas, seguindo padrões da literatura. Todas as medidas foram registradas em centímetros. As medidas realizadas foram: a) diâmetro transverso do lobo caudado: medida realizada da face externa lateral da veia porta até a face medial do lobo caudado, no nível imediatamente abaixo da bifurcação da veia porta(30); b) diâmetro transverso do lobo hepático direito: medida realizada da face externa lateral da veia porta até a face lateral do lobo direito, no nível imediatamente abaixo da bifurcação da veia porta(30); c) relação lobo caudado/lobo direito: valor obtido da divisão da medida do lobo caudado pela medida do lobo direito. O limite superior da normalidade é de 0,65(30); d) diâmetro ântero-posterior do lobo esquerdo: medida realizada da face anterior do lobo esquerdo até a sua face posterior. O limite superior da normalidade para este parâmetro é de 7 cm(31); e) diâmetro longitudinal do baço: medida realizada utilizando-se as imagens adquiridas no plano coronal na seqüência angiográfica FFE após injeção do contraste. O diâmetro foi medido da porção mais superior do baço até a sua extremidade inferior (Figura 5). O limite superior da normalidade descrito na literatura, utilizando a US, é de 12 cm(32);
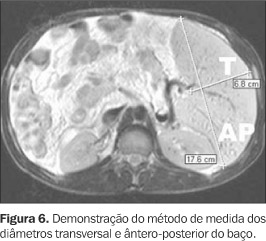
f) diâmetro transverso do baço: medida realizada no nível do hilo esplênico, obtida da face medial até a face lateral do baço (Figura 6);
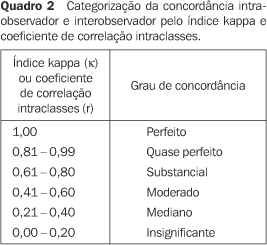
g) diâmetro ântero-posterior do baço: medida realizada no nível do hilo esplênico, obtendo-se a maior medida perpendicular à medida do diâmetro transverso do baço (Figura 6); h) índice esplênico: medida obtida através da multiplicação dos diâmetros longitudinal, transverso e ântero-posterior do baço(33). O limite superior da normalidade para este parâmetro é de 480(33). A análise da concordância intra-observador e interobservador das variáveis qualitativas foi feita através do índice kappa. Este índice é útil para a classificação da variabilidade obtida pela interpretação de dois grupos de informações contendo variáveis categóricas(34). Devido a particularidades na forma de cálculo, o índice kappa não pode ser aplicado em algumas situações, especialmente nos casos em que existem categorias nulas, ou seja, em uma matriz 2 × 2 existem categorias que não foram identificadas por um dos observadores, sendo representadas por NA (não aplicável). Quando possível, foi realizada a avaliação da concordância isolada dos dados obtidos, expressa em porcentual. Para o cálculo da concordância interobservador foram consideradas as avaliações realizadas na análise inicial de cada observador. A análise da concordância intra-observador e interobservador em relação às medidas das variáveis quantitativas foi feita através do coeficiente de correlação intraclasses. Este método é útil para a avaliação da concordância entre dois grupos de variáveis numéricas. A mensuração de variáveis quantitativas permitiu o cálculo de valores de média e desvio-padrão para cada uma das variáveis analisadas, que foram calculadas para os dois observadores, independentemente e em conjunto. O Quadro 2 apresenta os intervalos de categorização utilizados no índice kappa e coeficiente de correlação intraclasses.
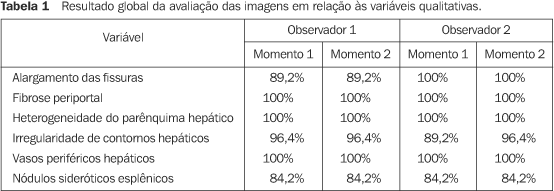
RESULTADOS Na Tabela 1 apresentamos os resultados globais da análise das imagens para as diferentes variáveis qualitativas através do porcentual de alterações identificadas pelos observadores nos dois momentos diferentes de avaliação.
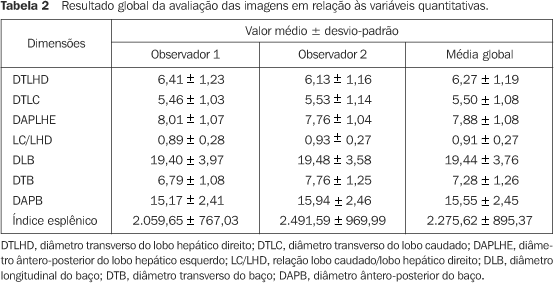
Na Tabela 2 apresentamos os valores médios encontrados para as diferentes medidas hepáticas e esplênicas.
Na Tabela 3 apresentamos a freqüência de alterações quantitativas em função de valores de normalidade descritos na literatura.
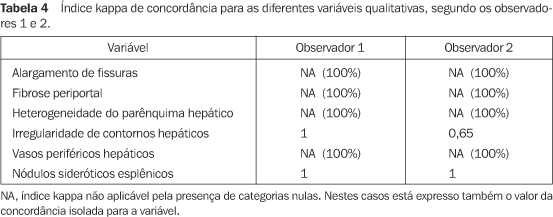
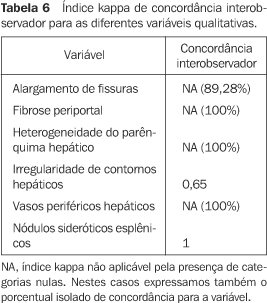
Em relação às variáveis qualitativas, a concordância intra-observador foi elevada em sua maior parte. Para o observador 1 a concordância pelo índice kappa foi perfeita (k = 1) ou a concordância isolada foi de 100% para todas as variáveis. Isto é, o observador concordou consigo mesmo em todos os casos. Em alguns casos não foi possível calcular o índice kappa, pois todas as observações tinham o mesmo valor, sendo então representado por NA. Exemplo: todos os casos foram interpretados como apresentando fibrose periportal. O observador 2 teve concordância perfeita pelo índice kappa (k = 1) ou concordância isolada de 100% em todas as variáveis, exceto quanto à irregularidade de contornos, em que o grau de concordância intra-observador foi substancial (k = 0,65). O índice kappa foi estatisticamente significante (p < 0,05) em todos os casos em que foi possível seu cálculo. A Tabela 4 apresenta o índice kappa para as diferentes variáveis, segundo cada observador.
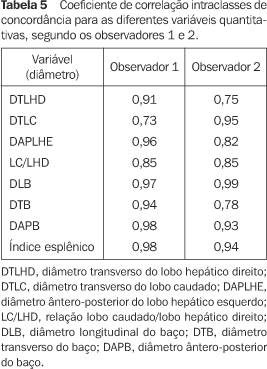
Através do teste do coeficiente de correlação intraclasses, o observador 1 apresentou elevada concordância entre os dois momentos diferentes de avaliação, sendo quase perfeita (r > 0,81) para todas as variáveis, exceto a medida do diâmetro transverso do lobo caudado, que apresentou concordância substancial (r = 0,73). O observador 2 também apresentou elevada concordância pelo coeficiente de correlação intraclasses, sendo quase perfeita (r > 0,81) em seis das oito variáveis e substancial (r entre 0,61 e 0,80) nas medidas do diâmetro transverso do lobo hepático direito e do diâmetro transverso do baço. Todos os valores de coeficiente de correlação intraclasses obtidos foram estatisticamente significantes (p < 0,05). A Tabela 5 apresenta os coeficientes de correlação intraclasses para as diferentes variáveis segundo o observador.
As concordâncias interobservador para as variáveis qualitativas também foram elevadas. A concordância isolada foi elevada (> 89%) ou a concordância pelo índice kappa foi perfeita (k = 1) nas variáveis referentes à fibrose periportal, heterogeneidade do parênquima hepático e quanto à presença de nódulos sideróticos esplênicos. A concordância foi substancial (k = 0,65) quanto à avaliação da irregularidade de contornos. O índice kappa foi estatisticamente significante (p < 0,05) em todos os casos em que foi possível seu cálculo. A Tabela 6 apresenta a concordância interobservador para as variáveis qualitativas e sua categorização.
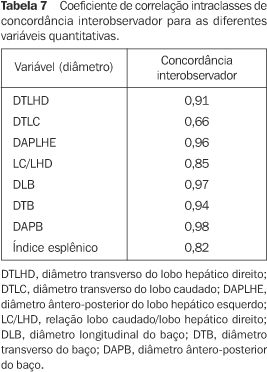
A análise da concordância interobservador para as variáveis quantitativas foi realizada através do coeficiente de correlação intraclasses. Como cada observador realizou a mesma medida duas vezes, utilizamos a média das medidas de cada observador para comparação. Todos os valores de coeficiente de correlação intraclasses obtidos foram estatisticamente significantes (p < 0,05). A Tabela 7 apresenta o coeficiente de correlação intraclasses para cada variável.
DISCUSSÃO A esquistossomose é doença de grande importância nacional e internacional, pela sua elevada prevalência e pela morbidade que provoca nos pacientes em seus estádios mais avançados(1,3). A US tem-se destacado entre os diversos métodos de diagnóstico por imagem como a forma mais amplamente utilizada para a avaliação dessa doença. Os principais fatores são o seu baixo custo, a não invasibilidade e a portabilidade dos aparelhos, possibilitando a sua utilização em comunidades rurais e de baixo poder econômico(3,7,12,35-42). Entretanto, a US tem como inconveniente o fato de apresentar considerável variabilidade interobservador, principalmente em relação às medidas do diâmetro dos vasos portais, elemento importante para a classificação da fibrose periportal, segundo os consensos de Cairo e Niamey(16,17). Por outro lado, a RM tem progressivamente se firmado como o melhor método para avaliação das hepatopatias focais ou difusas(43), mesmo apresentando os inconvenientes relacionados ao seu alto custo e pelo fato do equipamento não ser amplamente disponível. Um dos principais fatores que motivaram a realização deste trabalho foi o fato de não haver, na literatura médica, avaliação sistemática pela RM das alterações hepáticas e esplênicas promovidas pela esquistossomose mansônica. Neste sentido, já foi demonstrado que a angio-RM pode ser de utilidade na avaliação da circulação colateral que muitos dos pacientes possam vir a apresentar(44). A técnica de exame utilizada neste estudo é de ampla disponibilidade em equipamentos de RM, podendo tornar este trabalho base para outras investigações, mesmo utilizando equipamentos diferentes. Em nosso estudo foi utilizada bobina de corpo para geração das imagens. A literatura médica mais recente tem sugerido que bobinas de sinergia poderiam permitir imagens com qualidade melhor(45-47), porém estudo desenvolvido no equipamento por nós utilizado demonstrou que ambas as bobinas apresentam qualidade de imagem semelhante(48). A análise dos resultados da concordância inter e intra-observador para as variáveis qualitativas demonstra que a RM é um método reprodutível para a análise de dados subjetivos. Os altos graus de concordância podem ser interpretados também em função da população estudada. Os pacientes analisados neste trabalho são esquistossomóticos hepatoesplênicos, ou seja, têm doença em grau mais avançado do que o grupo com a forma hepatointestinal. A diferenciação entre os dois grupos é a presença de sinais de hipertensão portal e esplenomegalia no primeiro. De fato, nove dos pacientes já tinham inclusive sido submetidos a esplenectomia prévia. Em um grupo de doentes com esta forma mais avançada as alterações morfológicas causadas pela doença tendem a ser mais exuberantes, facilitando o seu reconhecimento por parte dos observadores. O alargamento das fissuras hepáticas, a irregularidade dos contornos e a heterogeneidade do parênquima são variáveis que traduzem o comprometimento do parênquima hepático pelo parasita. O encontro destas alterações pela RM corrobora as alterações descritas vistas na US(6,8,9,49). É interessante notar, no entanto, que outras afecções podem, eventualmente, cursar com essas alterações, mais notadamente a cirrose, seja ela de etiologia alcoólica ou viral(43,50). A fibrose periportal já foi considerada patognomônica de esquistossomose(6-9,51,52) e a sua caracterização é importante para a avaliação do estádio da doença, bem como para acompanhar o sucesso do tratamento(35,53-55). Sabe-se, no entanto, que a fibrose periportal pode também ser encontrada em outras doenças, como a cirrose; neste caso, a sua distribuição é mais central, limitando-se à veia porta e seus ramos principais(9). Em pacientes com doença na forma hepatoesplênica, como os aqui examinados, a fibrose tende a acometer todos os segmentos hepáticos, chegando inclusive à periferia do órgão, fato este observado em nossa amostra e não descrito anteriormente em exames de RM. Esta fibrose caracteriza-se também pelo realce após a injeção do contraste paramagnético. O realce pode ser explicado pela presença de tecido inflamatório periportal nas fases mais precoces da doença e de pequenos vasos colaterais periductais em suas formas mais crônicas. Tem sido questionado, na literatura, se o realce poderia ser diferente entre estas duas formas, sendo mais precoce nos primeiros em virtude do componente inflamatório(20). No nosso estudo todos os casos apresentaram realce das bandas de fibrose periportal nas imagens adquiridas na fase tardia, após cinco minutos do início da injeção do contraste. Não foram adquiridas imagens em fases de contrastação hepática mais precoces, como a arterial ou portal, pelo fato de que estes pacientes também foram submetidos a estudo de angio-RM após a administração do contraste(44). Entretanto, como os pacientes por nós estudados eram portadores da forma hepatoesplênica avançada da doença, acreditamos que o realce encontrado corresponde à fibrose observada em outros trabalhos da literatura(20,23). A escassa literatura sobre o uso da RM em esquistossomose sugere que este método possa diferenciar a fibrose periportal com componente inflamatório ativo daquela em que a fibrose se constituiria apenas de tecido com colágeno e alguns vasos colaterais de pequenas dimensões. Esta diferenciação poderia ser feita pelas imagens ponderadas em T2, já que nos processos agudos o componente de edema e inflamação periportal produziria hipersinal nesta seqüência, enquanto nos casos em que o componente de fibrose "pura" predominasse, o tecido colágeno produziria hipossinal em T2(22,23). Nos nossos casos, todos os pacientes apresentavam hipersinal nas seqüências ponderadas em T2, levando à suposição que mesmo em pacientes com a forma hepatoesplênica da doença existe ainda um componente inflamatório periportal(23). O esclarecimento para esta questão poderia ser dado pela correlação entre o aspecto da imagem por RM e os marcadores sorológicos para fibrose e inflamação, como o ácido hialurônico e a proteína C reativa(4,11,56-60). Cabe ressaltar que o realce do espaço periportal pode ocasionalmente ser encontrado em doenças como sarcoma de Kaposi e em pacientes submetidos à quimioterapia por linfoma e outras neoplasias. Entretanto, as áreas de realce são pequenas e não têm distribuição semelhante àquela encontrada em esquistossomóticos(61). Os nódulos sideróticos esplênicos representam uma manifestação do regime de hipertensão portal à que os pacientes estão submetidos. Também denominados nódulos de Gamna-Gandy, representam focos organizados de hemorragia contendo precipitados de cálcio e que têm como principal componente a hemossiderina, responsável pelo baixo sinal emitido por estes nódulos nas imagens ponderadas em T1 e T2(27,29,62). Sua caracterização em cerca de 84% dos pacientes foi bastante superior àquela descrita em estudos ultra-sonográficos, como os de Cerri et al., que os observaram em apenas 7% dos casos(8,9), e os de Richter et al., em 13% dos casos(63). A RM parece ter maior sensibilidade para detecção desses pequenos nódulos, fazendo-nos supor que as propriedades magnéticas do ferro tornem esta visualização mais fácil do que pela US, possivelmente superestimando as dimensões desses nódulos, pelo efeito de suscetibilidade magnética, principalmente nas seqüências gradiente-eco(26-29,64). Não encontramos, na literatura, referência comparando os dois métodos (US e RM) na avaliação dessa alteração. O lobo caudado pode estar hipertrofiado em casos de hepatopatia crônica ou mesmo em outras doenças como a síndrome de Budd-Chiari e a sarcoidose hepática(65). Nossos dados mostram que o mesmo pode ocorrer na esquistossomose. A concordância em relação à medida do lobo caudado do fígado, através do cálculo do coeficiente de correlação intraclasses, pode ser categorizada variando de substancial a quase perfeito para a concordância intra-observador e interobservadores. A relação lobo caudado/lobo direito é um dos principais indicadores de hepatopatia crônica. O trabalho de Harbin et al. demonstrou elevada sensibilidade (84%) e especificidade (100%) desta relação quando superior a 0,65 para o diagnóstico de cirrose(30). Em nosso estudo encontramos um valor médio de 0,91 para esta relação, obtendo-se valor superior a 0,65 em cerca de 86% das medições realizadas. A concordância para esta medida foi considerada como quase perfeita para a concordância interobservador e para os dois observadores separadamente. O lobo esquerdo também tem sido descrito, na literatura, com tamanho aumentado nos casos de esquistossomose e cirrose(8,9,66. O limite superior da normalidade descrito na literatura é de até 7 cm(67). Utilizando este valor nos casos aqui analisados, este lobo encontrava-se aumentado em 83,9% dos pacientes estudados, com diâmetro médio de 7,8 cm e diâmetro máximo encontrado de 10,8 cm. Este achado é semelhante ao descrito por Cerri et al.(8,9), que observaram aumento em 81% dos pacientes, e por Ruiz et al.(67), que encontraram esta alteração em 91,4%. O baço é órgão afetado secundariamente nos casos de esquistossomose crônica. A esplenomegalia comumente observada em pacientes hepatoesplênicos é derivada do regime de hipertensão portal desenvolvido com a progressão da doença(1,5,49,68,69). De fato, nove dos pacientes avaliados neste estudo já haviam sido submetidos a esplenectomia prévia, com realização de derivações vasculares, buscando reduzir a pressão no interior do sistema de circulação colateral. Em todos os outros casos observamos aumento volumétrico esplênico. Este aumento é avaliado através do índice esplênico, descrito inicialmente por Lackner et al.(33), e consiste na multiplicação do diâmetro longitudinal do baço pelos diâmetros ântero-posterior e transverso no nível do hilo esplênico. Aplicando estas medidas em 100 pacientes normais, esses autores encontraram valor máximo de 480, estabelecendo-o como limite superior da normalidade. O índice esplênico de todos os casos aqui estudados foi maior que 480, obtendo-se como menor valor 648, e como maior valor, 5.348. A média dos índices esplênicos dos pacientes foi de 2.275. As concordâncias intra-observador e interobservador foram classificadas como quase perfeitas, demonstrando que o método permite adequada avaliação da presença de esplenomegalia. Este estudo tem como principal característica o fato de ser uma avaliação sistemática inédita das alterações hepáticas e esplênicas através da RM, método este que tem sido cada vez mais utilizado para avaliação do abdome superior. As perspectivas abertas por este estudo são amplas e incluem a comparação das alterações aqui descritas com as encontradas em outras hepatopatias crônicas, como a cirrose, e também a tentativa de estabelecer relação entre as alterações de imagem com alterações laboratoriais, especialmente no que tange aos marcadores para fibrose. Outra linha proposta por este estudo é no sentido de estabelecer relação entre os achados da RM com os da US, medindo a sensibilidade de cada método para as diferentes alterações. Para tanto, acreditamos ser necessário também incluir uma avaliação anatomopatológica dos achados, garantindo assim a validação das alterações descritas pelos métodos de imagem. Concluindo, as alterações morfológicas hepáticas identificadas na RM caracterizam-se pela presença de redução do lobo direito e aumento dos lobos caudado e esquerdo. Observaram-se também presença de alargamento das fissuras, fibrose periportal, irregularidade de contornos, heterogeneidade do parênquima e identificação de vasos periféricos hepáticos. Por sua vez, as alterações morfológicas esplênicas caracterizam-se pela presença de esplenomegalia e nódulos sideróticos. A RM apresenta excelente reprodutibilidade para avaliação do paciente esquistossomótico, tanto em relação à concordância intra-observador como interobservador.
REFERÊNCIAS 1. Ross AG, Bartley PB, Sleigh AC, et al. Schistosomiasis. N Engl J Med 2002;346:1212-20. [ ] 2. Warren KS. Schistosomiasis: past, present and future. Mem Inst Oswaldo Cruz 1987;82 Suppl 4:25-9. [ ] 3. Hatz CF. The use of ultrasound in schistosomiasis. Adv Parasitol 2001;48:225-84. [ ] 4. Aguiar LAK. Ácido hialurônico sérico na hepatopatia esquistossomótica; seu papel na propedêutica hepática. (Tese de Mestrado). São Paulo, SP: Universidade Federal de São Paulo, 2000. [ ] 5. Prata A. Esquistossomose mansoni. In: Veronesi RF, Dietze R. Doenças infecciosas e parasitárias. Rio de Janeiro, RJ: Guanabara-Koogan, 1991: 838-55. [ ] 6. World Health Organization. Ultrasound in schistosomiasis. A practical guide to the standardized use of ultrasonography for the assessment of schistosomiasis-related morbidity. Disponível em: http://www.who.int/tdr/ publications/publications/pdf/ultrasound.pdf [ ] 7. No authors listed. The use of diagnostic ultrasound in schistosomiasis - attempts at standardization of methodology. Cairo Working Group. Acta Trop 1992;51(1):45-63. [ ] 8. Cerri GG. A ultra-sonografia no diagnóstico da forma hepato-esplênica da esquistossomose mansônica. Rev Imagem 1984;6:119-34. [ ] 9. Cerri GG, Alves VA, Magalhães A. Hepatosplenic schistosomiasis mansoni: ultrasound manifestations. Radiology 1984;153:777-80. [ ] 10. Fataar S, Bassiony H, Satyanath S, Vassileva J, Hanna RM. Characteristic sonographic features of schistosomal periportal fibrosis. AJR 1984;143: 11. Kopke-Aguiar LA, Martins JR, Passerotti CC, Toledo CF, Nader HB, Borges DR. Serum hyaluronic acid as a comprehensive marker to assess severity of liver disease in schistosomiasis. Acta Trop 2002; 84:117-26. [ ] 12. Abdel-Rahim IM, Ali QM, Kardorff R, et al. Sonographical morphometrical findings of the liver and spleen in Sudanese patients with Schistosoma mansoni induced periportal fibrosis. East Afr Med J 1994;71:311-3. [ ] 13. Pereira LM, Domingues AL, Spinelli V, McFarlane IG. Ultrasonography of the liver and spleen in Brazilian patients with hepatosplenic schistosomiasis and cirrhosis. Trans R Soc Trop Med Hyg 1998;92: 639-42. [ ] 14. Martins RD, Szejnfeld J, Lima FG, Ferrari AP. Endoscopic, ultrasonographic, and US-Doppler parameters as indicators of variceal bleeding in patients with schistosomiasis. Dig Dis Sci 2000;45: 1013-8. [ ] 15. Machado MM, Rosa ACF, Oliveira IRS, Cerri GG. Aspectos ultra-sonográficos da esquistossomose hepatoesplênica. Radiol Bras 2002;35:41-5. [ ] 16. Doehring-Schwerdtfeger E, Kaiser C, Franke D, Kardorff R, Ali QM, Abdel-Rahim IM. Inter-observer variance in ultrasonographical assessment of Schistosoma mansoni-related morbidity in young schoolchildren. Acta Trop 1992;51:85-8. [ ] 17. Thomas AK, Dittrich M, Kardorff R, et al. Evaluation of ultrasonographic staging systems for the assessment of Schistosoma mansoni induced hepatic involvement. Acta Trop 1997;68:347-56. [ ] 18. Cesmeli E, Vogelaers D, Voet D, et al. Ultrasound and CT changes of liver parenchyma in acute schistosomiasis. Br J Radiol 1997;70:758-60. [ ] 19. Lambertucci JR, Andrade LM, Pinto-Silva RA. Magnetic resonance imaging of the liver in hepatosplenic schistosomiasis mansoni. Rev Soc Bras Med Trop 2002;35:679-80. [ ] 20. Fataar S, Bassiony H, Satyanath S, et al. CT of hepatic schistosomiasis mansoni. AJR 1985;145:63-6. [ ] 21. Nompleggi DJ, Farraye FA, Singer A, Edelman RR, Chopra S. Hepatic schistosomiasis: report of two cases and literature review. Am J Gastroenterol 1991;86:1658-64. [ ] 22. Patel SA, Castillo DF, Hibbeln JF, Watkins JL. Magnetic resonance imaging appearance of hepatic schistosomiasis, with ultrasound and computed tomography correlation. Am J Gastroenterol 1993; 88:113-6. [ ] 23. Willemsen UF, Pfluger T, Zoller WG, Kueffer G, Hahn K. MRI of hepatic schistosomiasis mansoni. J Comput Assist Tomogr 1995;19:811-3. [ ] 24. Caldana RP, Bezerra AAS, Cecin AO, et al. Vias colaterais porto-sistêmicas exuberantes em portadores de hipertensão portal: demonstração pela angiografia por ressonância magnética com gadolínio. Rev Imagem 2003;25:1-4. [ ] 25. Monzawa S, Ohtomo K, Oba H, Nogata Y, Kachi K, Uchiyama G. Septa in the liver of patients with chronic hepatic schistosomiasis japonica: MR appearance. AJR 1994;162:1347-51. [ ] 26. Bernaerts A, Vanhoenacker FM, Op de Beeck B, De Schepper AM. Gamna-Gandy bodies. JBR-BTR 2001;84:202. [ ] 27. Dobritz M, Nomayr A, Bautz W, Fellner FA. Gamna-Gandy bodies of the spleen detected with MR imaging: a case report. Magn Reson Imaging 2001;19:1249-51. [ ] 28. Minami M, Itai Y, Ohtomo K, et al. Siderotic nodules in the spleen: MR imaging of portal hypertension. Radiology 1989;172:681-4. [ ] 29. Sagoh T, Itoh K, Togashi K, et al. Gamna-Gandy bodies of the spleen: evaluation with MR imaging. Radiology 1989;172:685-7. [ ] 30. Harbin WP, Robert NJ, Ferrucci JT Jr. Diagnosis of cirrhosis based on regional changes in hepatic morphology: a radiological and pathological analysis. Radiology 1980;135:273-83. [ ] 31. World Health Organization. Report of the WHO informal consultation on schistosomiasis control. Geneva, Switzerland: WHO, 1998. [ ] 32. Cerri GG. Baço. In: Rocha DC, Cerri GG, Prando A, eds. Ultra-sonografia abdominal. São Paulo: Sarvier, 1985:71-80. [ ] 33. Lackner K, Brecht G, Janson R, Scherholz K, Lutzeler A, Thurn P. The value of computer tomography in the staging of primary lymph node neoplasms (author's transl). ROFO 1980;132:21-30. [ ] 34. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics 1977; 33:159-74. [ ] 35. Lambertucci JR, Serufo JC, Gerspacher-Lara R, et al. Schistosoma mansoni: assessment of morbidity before and after control. Acta Trop 2000;77: 101-9. [ ] 36. Kardorff R, Gabone RM, Mugashe C, et al. Schistosoma mansoni-related morbidity on Ukerewe Island, Tanzania: clinical, ultrasonographical and biochemical parameters. Trop Med Int Health 1997;2:230-9. [ ] 37. Kardorff R, Traore M, Diarra A, et al. Lack of ultrasonographic evidence for severe hepatosplenic morbidity in schistosomiasis mansoni in Mali. Am J Trop Med Hyg 1994;51:190-7. [ ] 38. Houston S, Munjoma M, Kanyimo K, Davidson RN, Flowerdew G. Use of ultrasound in a study of schistosomal periportal fibrosis in rural Zimbabwe. Acta Trop 1993;53:51-8. [ ] 39. Doehring-Schwerdtfeger E, Kardorff R. Ultrasonography in schistosomiasis in Africa. Mem Inst Oswaldo Cruz 1995;90:141-5. [ ] 40. De Jesus AR, Miranda DG, Miranda RG, et al. Morbidity associated with Schistosoma mansoni infection determined by ultrasound in an endemic area of Brazil, Caatinga do Moura. Am J Trop Med Hyg 2000;63:1-4. [ ] 41. Bulsara MK, Sukwa TY, Wurapa FK. Risks of liver and spleen enlargement in schistosomiasis mansoni infection in a rural Zambian community. Trans R Soc Trop Med Hyg 1985;79:535-6. [ ] 42. Boisier P, Serieye J, Ravaoalimalala VE, Roux J, Esterre P. Ultrasonographical assessment of morbidity in schistosomiasis mansoni in Madagascar: a community-based study in a rural population. Trans R Soc Trop Med Hyg 1995;89:208-12. [ ] 43. Vitellas KM, Tzalonikou MT, Bennett WF, Vaswani KK, Bova JG. Cirrhosis: spectrum of findings on unenhanced and dynamic gadolinium-enhanced MR imaging. Abdom Imaging 2001;26:601-15. [ ] 44. Caldana RP. A angiografia por ressonância magnética com gadolínio no estudo da circulação hepatomesentérica em pacientes esquistossomóticos. (Tese de Doutorado). São Paulo, SP: Universidade Federal de São Paulo, 2003. [ ] 45. Campeau NG, Johnson CD, Felmlee JP, et al. MR imaging of the abdomen with a phased-array multicoil: prospective clinical evaluation. Radiology 1995;195:769-76. [ ] 46. Huber A, Scheidler J, Wintersperger B, et al. Moving-table MR angiography of the peripheral runoff vessels: comparison of body coil and dedicated phased array coil systems. AJR 2003;180:1365-73. [ ] 47. Schwartz LH, Panicek DM, Thomson E, et al. Comparison of phased-array and body coils for MR imaging of liver. Clin Radiol 1997;52:745-9. [ ] 48. Lima CA. Estudo comparativo das seqüências rápidas ponderadas em T2, utilizando sincronização respiratória, apnéia, supressão de gordura e bobina de sinergia para a avaliação do fígado pela ressonância magnética. (Tese de Doutorado). São Paulo, SP: Universidade Federal de São Paulo, 2002. [ ] 49. Gonçalves EG, Ferreira MS, Carvalho AM. Avaliação do método ultra-sonográfico no diagnóstico da hipertensão portal. Rev Imagem 1986;8:57-64. [ ] 50. Okazaki H, Ito K, Fujita T, Koike S, Takano K, Matsunaga N. Discrimination of alcoholic from virus-induced cirrhosis on MR imaging. AJR 2000;175:1677-81. [ ] 51. Abdel-Wahab MF, Esmat G, Milad M, Abdel-Razek S, Strickland GT. Characteristic sonographic pattern of schistosomal hepatic fibrosis. Am J Trop Med Hyg 1989;40:72-6. [ ] 52. Homeida M, Abdel-Gadir AF, Cheever AW, et al. Diagnosis of pathologically confirmed Symmers' periportal fibrosis by ultrasonography: a prospective blinded study. Am J Trop Med Hyg 1988;38: 86-91. [ ] 53. Lambertucci JR, Gerspacher-Lara R, Pinto-Silva RA, et al. O Projeto Queixadinha: a morbidade e o controle da esquistossomose em área endêmica no nordeste de Minas Gerais, Brasil. Rev Soc Bras Med Trop 1996;29:127-35. [ ] 54. Doehring-Schwerdtfeger E, Abdel-Rahim IM, Kardorff R, et al. Ultrasonographical investigation of periportal fibrosis in children with Schistosoma mansoni infection: reversibility of morbidity twenty-three months after treatment with praziquantel. Am J Trop Med Hyg 1992;46:409-15. [ ] 55. Boisier P, Ramarokoto CE, Ravaoalimalala VE, et al. Reversibility of Schistosoma mansoni-associated morbidity after yearly mass praziquantel therapy: ultrasonographic assessment. Trans R Soc Trop Med Hyg 1998;92:451-3. [ ] 56. Jaye DL, Waites KB. Clinical applications of C-reactive protein in pediatrics. Pediatr Infect Dis J 1997;16:735-46. [ ] 57. Ribeiro MA. Levels of C-reactive protein in serum samples from healthy children and adults in São Paulo, Brazil. Braz J Med Biol Res 1997;30:1055-9. [ ] 58. Oberti F, Valsesia E, Pilette C, et al. Noninvasive diagnosis of hepatic fibrosis or cirrhosis. Gastroenterology 1997;113:1609-16. [ ] 59. Ricard-Blum S, Hartmann DJ, Grenard P, Ravaoalimalala VE, Boisier P, Esterre P. Relationships between several markers of extracellular matrix turn-over and ultrasonography in human schistosomiasis mansoni. Am J Trop Med Hyg 1999;60:658-63. [ ] 60. Burchard GD, Guisse-Sow F, Diop M, et al. Schistosoma mansoni infection in a recently exposed community in Senegal: lack of correlation between liver morphology in ultrasound and connective tissue metabolites in serum. Trop Med Int Health 1998;3:234-41. [ ] 61. Hammerman AM, Kotner LM Jr, Doyle TB. Periportal contrast enhancement on CT scans of the liver. AJR 1991;156:313-5. [ ] 62. Andrade ZA, Andrade SG. Patologia do baço na esquistossomose hepatesplênica. Rev Inst Med Trop São Paulo 1965;7:218-27. [ ] 63. Richter J, Zwingenberger K, Ali QM, et al. Hepatosplenic schistosomiasis: comparison of sonographic findings in Brazilian and Sudanese patients — correlation of sonographic findings with clinical symptoms. Radiology 1992;184:711-6. [ ] 64. Palácio GAS, Francisco VV, Abbehusen CL, Tiferes DA, D'Ippolito G, Szejnfeld J. Artefatos em ressonância magnética do abdome: ensaio iconográfico. Radiol Bras 2002;35:371-6. [ ] 65. Watanabe S, Kimura Y, Nishioka M, et al. Assessment of hepatic functional reserve in cirrhotic patients by computed tomography of the caudate lobe. Dig Dis Sci 1999;44:2554-63. [ ] 66. Dodd GD 3rd, Baron RL, Oliver JH 3rd, Federle MP. Spectrum of imaging findings of the liver in end-stage cirrhosis: part I, gross morphology and diffuse abnormalities. AJR 1999;173:1031-6. [ ] 67. Ruiz R, Candia P, Garassini M, et al. Schistosomiasis mansoni in low transmission areas: abdominal ultrasound. Mem Inst Oswaldo Cruz 2002;97 Suppl 1:153-9. [ ] 68. Dumont AE, Becker FF, Warren KS, Martelli AB. Regulation of spleen growth and portal pressure in hepatic shcistosomiasis. Am J Pathol 1975;78:211-24. [ ] 69. Freitas CR, Barbosa Jr AA, Fernandes AL, Andrade ZA. Pathology of the spleen in hepatosplenic schistosomiasis. Morphometric evaluation and extracellular matrix changes. Mem Inst Oswaldo Cruz 1999;94:815-22. [ ]
Recebido para publicação em 3/9/2003. Aceito, após revisão, em 16/10/2003
* Trabalho realizado no Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554