Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 37 nº 4 - Jul. / Ago. of 2004
Vol. 37 nº 4 - Jul. / Ago. of 2004
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Douglas Guedes de Castro, Antônio Cássio Assis Pellizzon, Michael Jenwei Chen, Inês Nobuko Nishimoto, Maria Aparecida Conte Maia, Paulo Eduardo Ribeiro dos Santos Novaes, Ricardo César Fogaroli, Robson Ferrigno, João Victor Salvajoli |
|
|
Descritores: Câncer de próstata, Radioterapia, Braquiterapia de alta taxa de dose |
|
|
Resumo: IIICentro de Estudos do Hospital do Câncer A.C. Camargo, Mestre em Ciências em Oncologia pelo Hospital do Câncer A.C. Camargo
INTRODUÇÃO Em radioterapia, o controle local está diretamente relacionado à dose administrada(1,2). Esta, por sua vez, muitas vezes é limitada pela proximidade de estruturas críticas. Especificamente no câncer de próstata, há a limitação imposta pela tolerância de dose do reto e bexiga. O planejamento tridimensional e o tratamento conformado proporcionam aumento da precisão do tratamento, com maior dose restrita ao volume-alvo e relativa proteção das estruturas adjacentes. Assim, espera-se que o aumento da dose esteja diretamente ligado a um maior controle bioquímico. De fato, alguns protocolos de escalonamento de dose com teleterapia conformada têm mostrado aumento do controle bioquímico e mesmo da sobrevida livre de metástases a distância(3,4). Entretanto, no Brasil, poucas instituições dispõem de teleterapia conformada. Nesse contexto, outra estratégia para se obter o escalonamento de dose conformado com baixa toxicidade é a associação de teleterapia convencional (RT) a um reforço de dose com braquiterapia de alta taxa de dose (BT), haja vista que há grande disponibilidade de equipamentos de BT em território nacional, devido à alta incidência de câncer de colo uterino(5). Embora o reforço de dose com BT esteja associado a hipotéticas vantagens em relação à RT exclusiva, somente um estudo demonstrou o aumento do controle bioquímico quando utilizada BT em comparação à RT(6). Portanto, realizamos análise retrospectiva da resposta bioquímica e seus fatores prognósticos pré-tratamento, como o antígeno prostático-específico inicial (PSAi), escore de Gleason(7) (EG) da biópsia de próstata e estádio clínico (EC), em pacientes submetidos à RT ou à BT para tumores localizados da próstata.
MATERIAIS E MÉTODOS No período de novembro de 1997 a janeiro de 2000, 74 pacientes com câncer de próstata inicial foram submetidos à BT e, no período de outubro de 1996 a fevereiro de 2000, 29 pacientes com câncer de próstata inicial foram submetidos à RT, com ou sem hormonioterapia neoadjuvante associada, em nossa instituição. Todos os 103 pacientes elegíveis para radioterapia de próstata nesse período apresentaram EC inicial (T1 a T3a – American Joint Committee on Cancer, 1997)(8), dosagem sérica do PSA (PSAi) e biópsia comprobatória de câncer de próstata com EG. Além disso, foram solicitados radiografias de tórax e exames de laboratório (hemograma e bioquímico) a todos os pacientes e cintilografia óssea àqueles que apresentavam PSAi > 10 ng/mL. Foram elegíveis para BT aqueles pacientes com condições clínicas para anestesia, volume prostático < 60 cc, sem história de ressecção transuretral prévia e que não recusaram o procedimento. Inicialmente, todos os pacientes foram submetidos à teleterapia convencional com megavoltagem (fótons de 6 MeV) e dose de 45 Gy em 25 frações de 180 cGy em quatro campos pélvicos restritos à próstata e vesículas seminais. O grupo RT recebeu reforço de dose com arcoterapia (terapia rotatória) em duplo arco de 120 graus bilaterais e dose mediana de 24 Gy (20–24 Gy) em frações de 200 cGy. O grupo BT recebeu reforço de dose com 16 Gy em quatro inserções de 400 cGy, duas vezes ao dia e com intervalo de seis horas entre as inserções. O implante de próstata foi realizado 10 a 15 dias após o término da teleterapia com uso de raquianestesia e o paciente em posição de litotomia. Com o auxílio de ultra-sonografia transretal, foram visualizados a base, o ápice e a uretra prostática. Após a inserção, realizou-se tomografia computadorizada da pelve, a fim de se verificar o posicionamento das agulhas e auxiliar na definição do volume prostático e planejamento. Radiografias ortogonais foram utilizadas para o planejamento e cálculo dosimétrico, que foram gerados pelo sistema de planejamento Nucletron. O tratamento foi realizado pelo sistema remoto de pós-carregamento via micro-Selectron-HDR com fonte de 192Ir. Em ambas as modalidades de tratamento a dose biológica efetiva foi igual a 133,5 Gy2. O seguimento foi realizado com medidas seriadas do PSA a cada três meses até março de 2002. Recidiva bioquímica foi definida como três aumentos consecutivos do PSA após o tratamento e a data da recaída foi definida na metade do período entre o nadir do PSA e o primeiro dos três aumentos consecutivos(9). Sobrevida atuarial livre de doença em três anos (SB3) e fatores prognósticos pré-tratamento da resposta bioquímica (PSAi, EG e EC) foram analisados através da técnica de Kaplan-Meier(10), teste de log-rank(11) e análise multivariada pelo modelo de regressão de Cox(12), com 95% de significância.
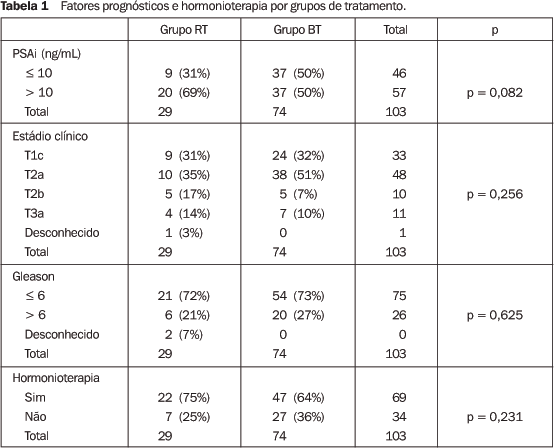
RESULTADOS O seguimento mediano foi de 25 meses para o grupo RT (4–52 meses) e 37 meses (3–49 meses) para o BT. A idade mediana foi de 69 (56–84 anos) e 68 anos (53–83 anos) para RT e BT, respectivamente. Os grupos mostraram-se homogêneos com relação aos fatores prognósticos e hormonioterapia neoadjuvante (Tabela 1).
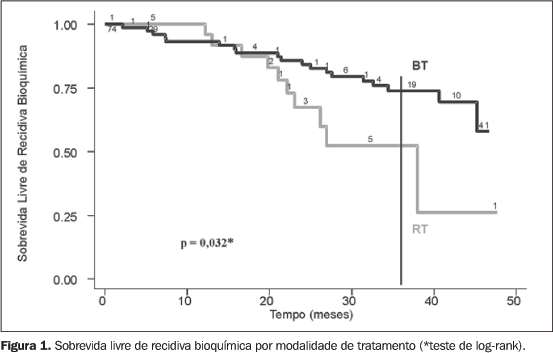
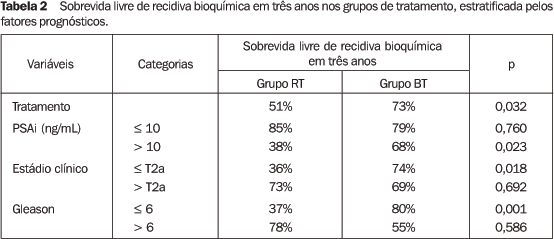
Houve recidiva bioquímica em 34,5% dos pacientes (dez casos) submetidos à RT e em 25,7% (19 casos) daqueles submetidos à BT (p = 0,371). Na análise atuarial, a SB3 foi de 51% e 73% (p = 0,032) para RT e BT, respectivamente (Figura 1). Na análise estratificada pelo PSAi, a SB3 para RT e BT foi de 85,7% e 79,1% (p = 0,76) para PSAi < 10 ng/mL e de 38% e 68% (p = 0,023) para PSAi > 10 ng/mL, respectivamente. Quando estratificado pelo EG, a SB3 para RT e BT foi de 37% e 80% (p = 0,001) para EG < 6 e 78% e 55% para EG > 6 (p = 0,58); estratificando-se pelo EC, a SB3 para RT e BT foi de 36% e 74% (p = 0,018) para EC < T2a e 73% e 69% para EC > T2a (p = 0,692), respectivamente (Tabela 2).
O risco relativo bruto de recidiva bioquímica foi de 2,3 (95% IC: 1,0–5,1) para os pacientes tratados com RT, em relação aos que receberam BT, e o risco relativo de recidiva bioquímica foi de 2,4 (95% IC: 1,0–5,7) quando ajustado pelo PSAi e EG (Tabela 3).
DISCUSSÃO Diversos estudos suportam que as combinações do EC, EG e PSAi podem ser utilizadas como fatores prognósticos da freqüência de neoplasia confinada à próstata e da falha bioquímica em pacientes submetidos ao tratamento local definitivo para o câncer localizado de próstata(13–15). No entanto, pouco se tem demonstrado a respeito da utilização da modalidade de tratamento como fator prognóstico, ainda menos quando nos restringimos à modalidade de radioterapia. Stromberg et al.(6) foram os primeiros a sugerir, em um estudo retrospectivo uninstitucional, a superioridade do controle bioquímico em pacientes com câncer de próstata localmente avançado tratados com RT e reforço de dose com BT, em comparação àqueles submetidos à teleterapia exclusiva com reforço de dose em arcoterapia. O tratamento com BT e o PSAi mostraram-se como fatores prognósticos isolados da resposta bioquímica, sendo que os pacientes com PSAi > 10 ng/mL foram os que mais se beneficiaram do reforço de dose conformado com BT. No presente estudo observamos a mesma tendência. Mediante análise multivariada, verificou-se que a modalidade de tratamento com BT, independentemente, mostrou-se como fator preditivo da resposta bioquímica, com um risco relativo bruto de recidiva bioquímica de 2,3 (95% IC: 1,0–5,1) para o grupo RT. Esta análise sugere a superioridade da modalidade com BT, mesmo quando ajustada para os potenciais fatores de confusão, como o PSAi e EG, pois o risco relativo de recidiva bioquímica ajustado para esses fatores para o grupo RT foi de 2,4 (95% IC: 1,0–5,7). Na análise estratificada, pacientes com PSAi > 10 ng/mL, EC < T2a e EG < 6 foram os mais beneficiados pelo reforço de dose conformado com BT. Quando se comparam duas diferentes modalidades de tratamento, a aparente vantagem do tratamento inovador pode estar relacionada ao fato de que o outro braço de tratamento obteve resultado mais pobre do que o esperado. Não é o que se observa neste estudo, quando comparamos com os resultados apresentados por Stromberg et al.(6), que relataram SB3 de 52% para o grupo RT, similar à SB3 de 51% observada em nossa série. Ao estratificarmos o controle bioquímico do grupo RT pelo PSAi, a SB3 apresentada nesta série também é similar a outras grandes séries que relataram resultados estratificados pelo PSAi(16,17). Por outro lado, ao estratificarmos pelos outros fatores prognósticos pré-tratamento, observamos que aqueles pacientes do grupo RT com EG < 6 e EC < T2a apresentaram resposta bioquímica aquém da demonstrada por outras séries. Tal fato pode ser explicado pelo pequeno número da nossa amostra no grupo RT. Com relação ao grupo BT, nossos dados também são próximos aos apresentados por Stromberg et al.(6), que relataram SB3 de 85% em pacientes submetidos ao reforço de dose conformado com BT. Em nossa série, observamos SB3 de 73% no grupo BT. No estudo de Stromberg et al. a estratificação pelo PSAi evidenciou SB3 para o grupo BT em relação ao RT de 83% e 72% para PSAi entre 4 e 10 ng/mL, 85% e 47% para PSAi entre 10 e 20 ng/mL e 89% e 29% para PSAi maior que 20 ng/mL, respectivamente. Considerando-se que a dose biológica efetiva em ambos os grupos foi praticamente a mesma, o maior controle bioquímico observado no grupo BT pode ser explicado pela possibilidade de se evitar a perda geográfica do tumor. A visualização em tempo real no momento do implante permite uma melhor definição do volume-alvo e maior acurácia na inserção das agulhas, a despeito da mobilidade inerente da próstata. Além disso, após o implante, há a possibilidade de se fazer um planejamento otimizado e que permita a verificação das curvas de isodose em relação à próstata, bem como a estimativa de dose na uretra e no reto. A associação de hormonioterapia neoadjuvante em alguns pacientes é um potencial fator de limitação em nosso estudo, pois está relacionada ao aumento do controle local e da sobrevida livre de recidiva bioquímica em pacientes submetidos à teleterapia(18). Porém, dois estudos falham em demonstrar benefício da hormonioterapia quando associada à radioterapia restrita à próstata, seja na forma de teleterapia(19) ou braquiterapia(20) e, além disso, observamos que 75% dos pacientes do grupo RT e 64% do grupo BT receberam hormonioterapia neoadjuvante. Ou seja, ainda que a adição de hormonioterapia tenha sido mais prevalente no grupo RT, tal fato não proporcionou maior controle bioquímico nesse grupo. Embora a modalidade de tratamento com BT tenha sido um fator preditivo independente do controle bioquímico neste estudo, os fatores prognósticos pré-tratamento, como o PSAi, o EG e o EC, não o foram. Porém, observamos diferença da resposta bioquímica entre as modalidades de tratamento para os pacientes com PSAi > 10 ng/mL, EG < 6 ou EC < T2a. Alguns estudos com radioterapia externa corroboram esses dados e demonstram o benefício do escalonamento de dose àqueles pacientes com PSAi > 10 ng/mL. Hanks et al.(21) relataram que o escalonamento de dose de 71 a 73 Gy foi benéfico para pacientes com PSA pré-tratamento > 10 ng/mL. Mais recentemente, Pollack et al.(4) demonstraram sobrevida livre de recidiva bioquímica em seis anos de 64% e 78% para doses de 70 Gy e 78 Gy, respectivamente (p = 0,03), sendo que o escalonamento de dose beneficiou preferencialmente os pacientes com PSAi > 10 ng/mL, os quais apresentaram 43% e 62%, respectivamente. Portanto, pacientes com valores reduzidos de PSAi (< 10 ng/mL) possuem melhor prognóstico e obtêm o controle bioquímico com doses menores, verificando-se que não há benefício no controle bioquímico com qualquer modalidade de radioterapia com doses maiores. Em pacientes com PSAi elevado (> 10 ng/mL), aparentemente, há uma relação dose-resposta efetiva com o escalonamento de dose. Da mesma forma que se tem demonstrado o valor de PSAi abaixo do qual o escalonamento de dose não é efetivo, são necessários estudos adicionais para se verificar o valor de PSAi acima do qual o benefício obtido com o escalonamento inexiste. Eventualmente, a associação de hormonioterapia ao escalonamento de dose beneficiaria esse subgrupo de pacientes. Portanto, ao compararmos a RT à BT, podemos concluir que a modalidade de tratamento foi fator prognóstico independente de recidiva bioquímica, com maior controle bioquímico associado ao reforço de dose com BT. Nossos resultados preliminares sugerem que o maior benefício com BT foi obtido naqueles pacientes com PSAi > 10 ng/mL, EC < T2a e EG < 6. O seguimento mais prolongado e estudos prospectivos adicionais são necessários para consubstanciar os resultados observados nesta série.
REFERÊNCIAS 1. Hanks GE, Martz KL, Diamond JJ. The effect of dose on local control of prostate cancer. Int J Radiat Oncol Biol Phys 1988;15:1299–305. [ ] 2. Hanriot RM, Salvajoli JV. Tumores de próstata. In: Salvajoli JV, ed. Radioterapia em oncologia. 1ª ed. São Paulo, SP: Medsi, 1999:643–89. [ ] 3. Zelefsky MJ, Fuks Z, Hunt M, et al. High dose radiation delivered by intensity modulated conformal radiotherapy improves the outcome of localized prostate cancer. J Urol 2001;166:876–81. [ ] 4. Pollack A, Zagars GK, Starkschall G, et al. Prostate cancer radiation dose response: results of the M.D. Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys 2002;53:1097–105. [ ] 5. Pellizzon AC, Nadalin W, Salvajoli JV, et al. Results of high dose rate afterloading brachytherapy boost to conventional external beam radiation therapy for initial and locally advanced prostate cancer. Radiother Oncol 2003;66:167–72. [ ] 6. Stromberg JS, Martinez AA, Horwitz EM, et al. Conformal high dose rate iridium-192 boost brachytherapy in locally advanced prostate cancer: superior prostate-specific antigen response compared with external beam treatment. Cancer J Sci Am 1997;3:346–52. [ ] 7. Gleason DF. Histologic grading and clinical staging of prostate carcinoma. In: Tannenbaum M, ed. Urologic pathology: the prostate. Philadelphia: Lea & Febiger, 1977:171–97. [ ] 8. Sobin LH, Wittekind CH, eds. International Union Against Cancer: TNM classification of malignant tumors. 5th ed. New York: Wiley-Liss, 1997:170–3. [ ] 9. American Society for Therapeutic Radiology and Oncology. Consensus statement: Guidelines for PSA following radiation therapy. Int J Radiat Oncol Biol Phys 1997;37:1035–41. [ ] 10. Kaplan EL, Meier P. Non-parametric estimation from incomplete observations. J Am Stat Assoc 1958;53:457–81. [ ] 11. Mantel N, Haenszel W. Statistical aspects of the analysis of data from restrospective studies of disease. J Natl Cancer Inst 1959;22:719–48. [ ] 12. Cox DR. Regression models and life tables. J R Stat Soc B 1972;34:187–220. [ ] 13. Kattan MW, Eastham JA, Stapleton AM, Wheeler TM, Scardino PT. A preoperative nomogram for disease recurrence following radical prostatectomy for prostate cancer. J Natl Cancer Inst 1998;90: 766–71. [ ] 14. D'Amico AV, Whittington R, Malkowicz SB, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998;280:969–74. [ ] 15. D'Amico AV, Keshaviah A, Manola J, et al. Clinical utility of the percentage of positive prostate biopsies in predicting prostate cancer-specific and overall survival after radiotherapy for patients with localized prostate cancer. Int J Radiat Oncol Biol Phys 2002;53:581–7. [ ] 16. Lee WR, Hanks GE, Schulteiss TE, Corn BW, Hunt MA. Localized prostate cancer treated by external-beam radiotherapy alone: serum prostate-specific antigen-driven outcome analysis. J Clin Oncol 1995;13:464–9. [ ] 17. Kuban DA, El-Mahdi AM, Schellhammer PF. Prostate-specific antigen for pretreatment prediction and post treatment evaluation of outcome after definitive irradiation for prostate cancer. Int J Radiat Oncol Biol Phys 1995;32:307–16. [ ] 18. Pilepich MV, Winter K, John MJ, et al. Phase III Radiation Therapy Oncology Group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001; 50:1243–52. [ ] 19. Roach M III, DeSilvio M, Lawton C, et al. Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 2003;21: 1904–11. [ ] 20. Potters L, Torre T, Ashley R, Leibel S. Examining the role of neoadjuvant androgen deprivation in patients undergoing prostate brachytherapy. J Clin Oncol 2000;18:1187–92. [ ] 21. Hanks GE, Lee WR, Hanlon AL, et al. Conformal technique dose escalation for prostate cancer: biochemical evidence of improved cancer control with higher doses in patients with pretreatment prostate-specific antigen > 10 ng/ml. Int J Radiat Oncol Biol Phys 1996;35:861–8. [ ]
Recebido para publicação em 11/8/2003. Aceito, após revisão, em 26/2/2004.
* Trabalho realizado no Departamento de Radioterapia do Hospital do Câncer A.C. Camargo, São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554