Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 37 nº 4 - Jul. / Ago. of 2004
Vol. 37 nº 4 - Jul. / Ago. of 2004
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Afrânio Coelho-Oliveira, Augusto César Peixoto Rocha, Bianca Gutfilen, Maria Carolina Pinheiro Pessoa, Léa Mirian Barbosa da Fonseca |
|
|
Descritores: Câncer de mama, Linfonodo sentinela, Linfocintilografia |
|
|
Resumo: IIIProfessor Adjunto do Departamento de Radiologia, Medicina Nuclear, da UFRJ
INTRODUÇÃO Os fatores prognósticos do câncer da mama bem estabelecidos e com grande aplicação clínica são o comprometimento linfonodal e o tamanho histológico do tumor (pT). No tratamento cirúrgico do câncer de mama, o papel da linfadenectomia axilar (LA) em modificar a sobrevida global da doença permanece ainda incerto. A LA é recomendada para estadiamento pós-cirúrgico da axila (pN) e determinação do benefício de terapias adjuvantes sistêmicas, podendo aumentar discretamente a sobrevida(1). Com a utilização da mamografia em programas de rastreamento, o diagnóstico do câncer de mama tem sido cada vez mais precoce. A LA nos tumores infiltrantes trouxe informações relevantes da relação do tamanho do tumor e a extensão do comprometimento linfonodal homolateral. O fator mais importante fortemente relacionado ao envolvimento linfonodal é o tamanho do tumor primário(2). A incidência do comprometimento metastático linfonodal axilar nos tumores (pT) de até 2,0 cm é de 21% a 35%(3); nos tumores de 0 a 5 mm a incidência de comprometimento linfonodal é de 3% a 20%(4). A LA informa o estadiamento pós-cirúrgico da axila (pN) e é um dos mais importantes fatores prognósticos no câncer de mama(5). O comprometimento axilar é reduzido no câncer de mama para os tumores menores que 2,0 cm, e a LA retira uma série de linfonodos hígidos. Entretanto, a LA, além das conseqüências estéticas, pode levar a algum grau de impotência funcional, diminuição de amplitude do movimento, parestesias, seromas, dor ou até o linfedema do membro superior homolateral, devido à extensão da cirurgia na axila. A incidência de linfedema no membro superior no pós-operatório imediato da LA pode chegar a 40% e geralmente é resolvida por medidas conservadoras. A incidência de linfedema crônico (mais que seis meses) nos estudos de 20 anos de seguimento oscila de 5% a 80%, dependendo da definição de linfedema e do uso de radioterapia na axila(6). A biópsia do linfonodo sentinela (LS) estudado por mapeamento linfático usando-se radiofármacos ou corante vital é uma abordagem cirúrgica conservadora da cadeia linfática regional para estadiamento da axila. O LS é definido como o primeiro linfonodo que recebe a drenagem linfática do tumor. Em relação ao câncer de mama, a biópsia do LS pode evitar a LA e minimizar as conseqüências funcionais do membro superior homolateral e parece ser altamente sedutora. A biópsia do LS pode ser definida como um teste diagnóstico capaz de prever o status linfonodal regional, e quando negativa, evitar dissecção completa dos linfonodos. Pode também oferecer parâmetros seguros para a definição de tratamento adjuvante sistêmico. O conceito de LS foi estabelecido por Cabanas, definido a partir do estudo da drenagem linfática do carcinoma do pênis. Por intermédio de linfoangiografia, observou o padrão de metástases regionais linfonodais, em que o LS seria o primeiro linfonodo sítio de metástase, e encontrou que freqüentemente somente este primeiro linfonodo estava comprometido pelo câncer após comparação com a linfadenectomia radical regional(7). A biópsia do LS no câncer de mama pretende diminuir a morbidade no estadiamento da axila e selecionar as pacientes que deverão ser submetidas à LA(8). O protocolo definitivo para identificação do LS no câncer de mama através de radiofármacos e/ou corantes vitais relacionados ao sítio de injeção, realização ou não de linfocintilografias, tempo entre a injeção e a cirurgia, uso combinado de corantes, ainda necessitam de mais estudos. O objetivo do presente estudo visa identificar o LS por meio da injeção exclusiva de radiofármaco periareolar subdérmico em quatro pontos, independente da topografia do tumor, ou da presença de biópsias e/ou cirurgias prévias. Visamos, assim, encontrar um método fácil para injeção do radiofármaco, independente dos procedimentos estereotáxicos e que possa obter ótimas taxas de identificação do LS.
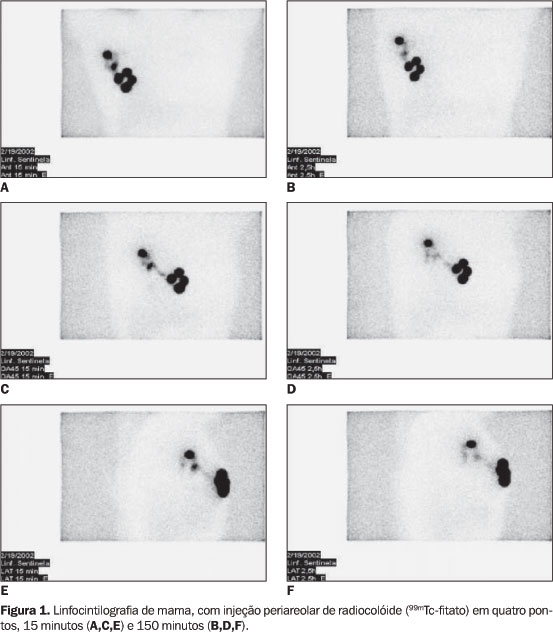
MATERIAIS E MÉTODOS No período de maio de 2001 a abril de 2003, foram estudados 57 casos de biópsias do LS, nos Serviços de Ginecologia do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ) e do Hospital Samaritano, em pacientes com câncer de mama, sendo os 25 casos iniciais (grupo A), com sítios de injeção peritumoral, utilizados como grupo controle do sítio de injeção e LA completa. Os 32 casos subseqüentes, com injeção periareolar subdérmica em quatro pontos, independentes do sítio tumoral ou presença de cicatriz prévia e LA completa quando a biópsia do LS fosse positiva, constituíram o grupo B. Foi realizada linfocintilografia basal (15 e 150 minutos) em ambos os grupos, utilizando-se exclusivamente o 99mTc-fitato. Este estudo foi aprovado pela Comissão de Ética e Pesquisa e da Comissão de Investigação Científica do HUCFF-UFRJ, sob as numerações 048/01 e 056/01, respectivamente. Para a detecção do LS no centro cirúrgico foi utilizado o "gama-probe" (NeoProbe 2000 da Johnson & Johnson, com sonda reutilizável BlueTip TM de 12 mm – modelo 2002 colimada). Os critérios de inclusão utilizados foram: diagnóstico cito-histopatológico de câncer de mama, tumores até 30 mm no maior diâmetro e axila clinicamente livre. Os critérios de exclusão foram: quimioterapia ou hormonioterapia prévias, radioterapia prévia e gravidez e aleitamento. As pacientes foram informadas da pesquisa e puderam participar desta ao concordarem em assinar o termo de consentimento livre e esclarecido. A técnica linfocintilográfica nos grupos em estudo consistiu na injeção de 0,6 a 1,0 mCi (22,2 a 37 MBq) de 99mTc-fitato subdérmico, peritumoral (grupo A) e periareolar subdérmico em quatro pontos (grupo B) (Figura 1).
A identificação cirúrgica do LS obedeceu a etapas bem definidas: injeção do radiofármaco; linfocintilografia basal nas incidências anterior, oblíqua e lateral, 15 e 90 minutos após a administração do radiofármaco; aferição da radiação de fundo com a sonda do "gama-probe" direcionada a 1 cm da pele do membro superior contralateral, na altura do braço; incisão na área de maior captação e identificação, com a sonda, do(s) ponto(s) de maior captação radioativa. A relação da área de maior captação/radiação de fundo deve ser igual ou maior que 10; verificação da radioatividade do LS excisado fora do campo cirúrgico e conseqüente demonstração do retorno aos níveis de radiação de fundo no leito cirúrgico; a sonda foi envolvida em bainha descartável estéril para utilização no ato cirúrgico. Após a identificação da área captante o(s) LS era(m) dissecado(s) para estudo anatomopatológico; nos LS foram feitos cortes paralelos ao maior eixo de até 4 mm e examinadas as superfícies de corte, à procura de evidência macroscópica de metástase, que foram estudadas no peroperatório por "imprint" citológico. Os "imprints" foram hidratados e corados com azul de toluidina, e após leitura as peças foram fixadas em formol a 10% e submetidas ao processamento em parafina para coloração com hematoxilina e eosina (HE).
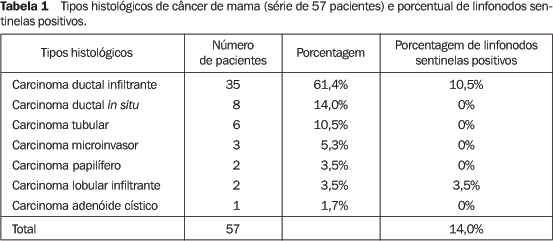
RESULTADOS Os 57 casos estudados apresentaram-se dentro dos critérios de seleção, tendo sido submetidos a tratamento cirúrgico do câncer de mama com estudo do LS. A faixa etária das pacientes variou de 43 a 80 anos, média de 49,4 anos (DP = 8,6) e mediana de 50 anos. O diagnóstico de câncer de mama foi obtido em 50,87% (29/57), por meio de procedimentos estereotáxicos. O tipo histológico mais comum foi o carcinoma ductal infiltrante, com 61,4% (35/57); o porcentual de LS positivos foi de 14% em toda série. Os resultados podem ser vistos na Tabela 1.
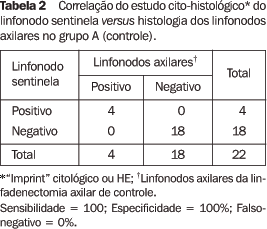
O predomínio da topografia das lesões ocorreu na mama esquerda, com 57,89% (33/57), e no quadrante superior externo, com 63,15% (36/57) dos casos. O número de LS variou de 1 a 7, moda de 1 e média de 2,7; a relação entre a área de maior captação do radiofármaco e a radiação de fundo variou de 10 a 100 vezes. No grupo A foram identificados 88% (22/25) dos LS e 100% (25/25) estavam localizados na axila. A média do pT foi de 15 mm. Em 40% (10/25) dos casos as pacientes tinham biópsia aberta prévia. A biópsia do LS foi positiva em 18,2% (4/22) e negativa em 81,8% dos casos (18/22). A LA de controle mostrou valor preditivo positivo de 100% e ausência de falso-negativos (Tabela 2).
No grupo B foram identificados 96% (31/32) dos LS, e 100% (32/32) se encontravam na axila. A linfocintilografia (Figura 1) mostrou migração do radiofármaco para a axila em 93,7% dos casos. Em um destes, o LS foi identificado somente com o "gama-probe". Houve apenas um caso não identificado pela técnica radioguiada e também não visualizado através da linfocintilografia; tratava-se de uma paciente muito obesa. A média do pT foi de 14 mm, e 62% (20/32) das pacientes tinham sido submetidas a biópsias abertas prévias. Em 9,6% (3/31) das vezes em que o LS foi positivo, diagnosticado no "imprint" citológico, essas pacientes foram submetidas à LA. Foi constatado na parafina (HE) que outros linfonodos axilares também se encontravam comprometidos, resultando em valor preditivo positivo de 100%.
DISCUSSÃO O trabalho inicial de LS em câncer de mama utilizando radiotraçadores e detector de raios gama peroperatório foi realizado por Krag et al., em 1993, que obtiveram 82% de taxa de identificação, com 100% de exatidão em relação ao comprometimento linfonodal axilar(9). Em 1994, Giuliano et al., utilizando exclusivamente corantes vitais ("isosulfan blue dye"), obtiveram taxa de identificação de 66%, com 96% de exatidão(10). A associação de métodos de identificação do LS foi descrita por Albertini et al. em 1996, e demonstrou taxa de identificação de 92%, com 100% de exatidão(11). Em nosso estudo, no grupo A, encontramos taxa de identificação do LS de 88%, semelhante à dos pioneiros da técnica. No grupo B, encontramos taxa de identificação superior, de 96%. Entretanto, estes melhores resultados podem não ser atribuídos exclusivamente ao sítio de injeção, pois a curva de aprendizado na equipe cirúrgica ainda estava em desenvolvimento. O desenvolvimento da técnica de identificação do LS continua em investigação e uma variedade de radiotraçadores e técnicas de injeção tem sido experimentada(12). Nos trabalhos pioneiros, o enxofre coloidal, a albumina coloidal, o sestamibi e o dextran foram os mais utilizados. No Brasil, o dextran 500 é utilizado por Xavier et al. no Rio Grande do Sul e por Piato et al. em São Paulo(13,14). Em nosso estudo utilizamos o fitato, assim como Paz et al. em Belo Horizonte(15). Durante muito tempo, a maioria dos cirurgiões acreditou enfaticamente no paradigma halstediano, que estabelecia que a retirada em monobloco da mama, músculos peitorais e conteúdo axilar era procedimento curativo, e que se a retirada do tumor com margem de ressecção com sua drenagem linfática fosse realizada antes que o tumor tivesse se disseminado, as chances de cura seriam elevadas(16). Entretanto, seguimentos de longo prazo demonstraram que 30% das pacientes com axila histologicamente negativa morriam de câncer metástatico(17). A LA influenciou na sobrevida das pacientes? Obviamente, a LA incompleta pode resultar em subestadiamento da axila, privando a paciente de tratamento adjuvante adequado e influenciando a sobrevida global das pacientes. A LA promove estadiamento e determina o prognóstico, previne a recorrência local na axila, e em pacientes com linfonodos positivos pode modestamente aumentar a sobrevida(18). O papel da biópsia do LS em prever o status axilar é um procedimento de diagnóstico de consenso(19), necessitando de maiores ensaios clínicos para padronizar as técnicas de identificação e homogeneizar os resultados. Com esta nova técnica, o LS foi identificado em 96,2% dos casos (25/26 pacientes), valores superiores aos de Giuliano et al.(10). Apesar de 41% das pacientes (12/29) apresentarem-se com cirurgia prévia, a técnica utilizada permitiu a identificação do LS, sugerindo que o sítio utilizado, além de simples, é seguro e permite a abordagem de lesões palpáveis e impalpáveis. A injeção peritumoral nos tumores localizados nos quadrantes superiores externos da mama (localização mais freqüente, que se confirmou em nosso material) freqüentemente dificulta a cirurgia radioguiada para o discernimento entre o sítio de injeção e a área de captação do material radioativo pelo LS. Em nosso estudo, 65% das lesões estavam localizadas nos quadrantes superiores externos da mama. Com a injeção periareolar em quatro pontos, não foi encontrada dificuldade na identificação do LS. A biópsia do LS permite estudo anatomopatológico mais acurado do LS, por meio do "imprint" citológico peroperatório, cortes seriados pelo HE ou estudos imuno-histoquímicos, podendo aumentar em 30% o diagnóstico de micrometástases quando comparados aos cortes de rotina(8,10,20). Entretanto, o significado biológico das micrometástases, diagnosticados pela HE ou pela imuno-histoquímica, permanece incerto. Neste estudo foram realizados apenas cinco exames de imuno-histoquímica para pesquisa de células epiteliais nos casos que não se dissecou a axila, não sendo observado, nessa pequena casuística, aumento no diagnóstico de micrometástases, como descrito na literatura(8). No tratamento conservador da axila, utilizando-se a biópsia do LS, deve-se considerar que a possibilidade de recorrência axilar está diretamente relacionada ao tamanho do tumor inicial, podendo ocorrer em cerca de 10% das pacientes com tumores até 10 mm e em até 33% das pacientes com tumores maiores que 20 mm(10). Os nossos resultados de biópsia do LS mostraram metástases em 13,2% (7/53) dos casos. Dos LS positivos, o tamanho histológico do tumor foi de 10–20 mm (dois casos) e 20–30 mm (cinco casos), compatíveis com achados da literatura(3,21). Na biópsia do LS as taxas de falso-negativos têm papel relevante, pois podem levar a subestadiamento e tratamentos adjuvantes incorretos, afetando a sobrevida global das pacientes. Porém, o papel da LA nos tumores iniciais do câncer de mama é incerto, pelo aumento da morbidade e retirada da maioria de linfonodos hígidos da axila. Na maioria dos protocolos atuais de terapia adjuvante, todas as pacientes com tumores maiores que 10 mm recebem tratamento sistêmico, independentemente do comprometimento linfonodal axilar(1). Independentemente do uso de corantes vitais, radiotraçadores com sonda peroperatória ou associação de ambos os métodos, todos os cirurgiões que vêm utilizando o estudo do LS têm validado o método, realizando nos casos iniciais a LA(22). As estatísticas relacionadas à biópsia do LS freqüentemente são confusas e, notadamente para o cálculo do falso-negativo do método de identificação, é necessária a LA para um adequado numerador e denominador neste cálculo. Em todas as séries, os investigadores demonstraram taxas razoáveis de identificação do LS, que melhoram com a padronização do sítio de injeção e marcadores utilizados(23). Atualmente, na curva de aprendizado da equipe interdisciplinar, a meta inicial deve ser de taxa de identificação de no mínimo 85%, com falso-negativo de 5% a 10%(1). Nesta série, estudando-se o sítio de injeção periareolar subdérmico em quatro pontos, a taxa de identificação foi de 96% quando a curva de aprendizado já estava estabelecida pelo mesmo cirurgião ou sob sua supervisão direta. Os tumores de até 10 mm de diâmetro (T1a e T1b – TNM) apresentam possibilidade de 10% a 15% de comprometimento linfonodal axilar. Certamente, a LA, quando realizada nos tumores T1a e T1b, em 85% das vezes resulta em estudo histológico da axila negativo. Outrossim, a biópsia do LS, por ser método propedêutico sensível, específico e menos agressivo, é altamente recomendável na abordagem conservadora da axila. A utilização deste sítio de injeção em pacientes com cirurgia prévia não afetou as taxas de identificação do LS. Na nossa série, as taxas de identificação de 85% foram alcançadas com 16 casos, entretanto, a literatura tem citado em torno de 30 casos o número mínimo para a curva de aprendizado e obtenção de taxas de identificação razoáveis do LS(24). Há vários relatos que a injeção subareolar reduz em muito a curva de aprendizado e é muito mais rápida quando se inicia o método associado a grupo com experiência prévia; a American Society of Breast Surgeons (ASBS) sinaliza que dez casos seriam suficientes. Nos casos em que se consegue identificar o LS, o método se mostra altamente sensível e específico. O LS pode predizer o status axilar e, nos casos iniciais do câncer de mama, utilizando-se protocolos bem estabelecidos, já é procedimento de consenso(19). A injeção periareolar em quatro pontos se apresenta como excelente método no mapeamento linfático para a identificação do LS. A possibilidade de padronizar o sítio de injeção, e a identificação da principal via de metástases (axilares), independente da topografia da lesão, parece ser altamente promissora, sendo necessário um maior número de casos para a confirmação destes achados.
REFERÊNCIAS 1. Cody HS III. Sentinel lymph node mapping in breast cancer. Oncology (Huntingt) 1999;13:25–34. [ ] 2. Seidman JD, Schnaper LA, Aisner SC. Relationship of the size of the invasive component of the primary breast carcinoma to axillary lymph node metastasis. Cancer 1995;75:65–71. [ ] 3. Chadha M, Chabon AB, Friedmann P, Vikram B. Predictors of axillary lymph node metastases in patients with T1 breast cancer. A multivariate analysis. Cancer 1994;73:350–3. [ ] 4. Cady B. The need to reexamine axillary lymph node dissection in invasive breast cancer. Cancer 1994; 73:505–8. [ ] 5. Gervasoni JE Jr, Taneja C, Chung MA, Cady B. Biologic and clinical significance of lymphadenectomy. Surg Clin North Am 2000;80:1631–73. [ ] 6. Bland KI, Copeland EM, eds. The breast: comprehensive management of benign and malignant diseases. 2nd ed. Philadelphia: WB Saunders, 1998: 1631. [ ] 7. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer 1977;39:456–66. [ ] 8. Dowlatshahi K, Fan M, Bloom KJ, Spitz DJ, Patel S, Snider HC Jr. Occult metastases in the sentinel lymph nodes of patients with early stage breast carcinoma: a preliminary study. Cancer 1999;86:990–6. [ ] 9. Krag DN, Weaver DL, Alex JC, Fairbank JT. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993;2:335–40. [ ] 10. Giuliano AE, Kirgan DM, Guenther JM, Morton DL. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994;220: 391–8. [ ] 11. Albertini JJ, Lyman GH, Cox C, et al. Lymphatic mapping and sentinel node biopsy in the patient with breast cancer. JAMA 1996;276:1818–22. [ ] 12. Motomura K, Komoike Y, Nagumo S, et al. Sentinel node biopsy to avoid axillary lymph node dissection in breast cancer. Breast Cancer 2002;9: 337–43. [ ] 13. Xavier NL, Amaral BB, Cerski CT, et al. Sentinel lymph node identification and sampling in women with early breast cancer using 99m-Tc labelled dextran 500 and patent blue V dye. Nucl Med Commun 2001;22:1109–17. [ ] 14. Piato JR, Barros AC, Pincerato KM, Sampaio AP, Pinotti JA. Sentinel lymph node biopsy in breast cancer after neoadjuvant chemotherapy. A pilot study. Eur J Surg Oncol 2003;29:118–20. [ ] 15. Paz AP, Mello GL, Rangel KK, et al. Biópsia do linfonodo sentinela – experiência clínica. Rev Bras Cancerol 2001;47:309–15. [ ] 16. Halsted W. The results of radical operations for the cure of carcinoma of the breast. Ann Surg 1907;46: 1–19. [ ] 17. Bonadonna G, Valagussa P. The contribution of medicine to the primary treatment of breast cancer. Cancer Res 1988;48:2314–24. [ ] 18. Petrek JA, Blackwood MM. Axillary dissection: current practice and technique. Curr Probl Surg 1995;32:257–323. [ ] 19. Schwartz GF, Giuliano AE, Veronesi U, Consensus Conference Committee. Proceedings of the consensus conference on the role of sentinel lymph node biopsy in carcinoma of the breast, April 19-22, 2001, Philadelphia, Pennsylvania. Cancer 2002;94: 2542–51. [ ] 20. Bochner MA, Farshid G, Dodd TJ, Kollias J, Gill PG. Intraoperative imprint cytologic assessment of the sentinel node for early breast cancer. World J Surg 2003;27:430–2. [ ] 21. Cady B. Sentinel lymph node biopsy as an alternative to routine axillary lymph node dissection in breast cancer patients. J Surg Oncol 2001;77:149–52. [ ] 22. Chua B, Olivotto AI, Donald JC, et al. Outcomes of sentinel node biopsy for breast cancer in British Columbia, 1996 to 2001. Am J Surg 2003;185: 118–26. [ ] 23. Patel NA, Dusi D, Bragdon G, Julian TB. Technical limitations of sentinel node biopsy in breast cancer: a single surgeon's experience. Am Surg 2003; 69:111–6. [ ] 24. Krag D, Weaver D, Ashikaga T, et al. The sentinel node in breast cancer – a multicenter validation study. N Engl J Med 1998;339:941–6. [ ]
Recebido para publicação em 11/8/2003. Aceito, após revisão, em 12/9/2003.
* Trabalho realizado no Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ. Auxílio financeiro da Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (Faperj) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554