Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 37 nº 3 - Maio / Jun. of 2004
Vol. 37 nº 3 - Maio / Jun. of 2004
|
ATUALIZAÇÃO
|
|
|
|
|
Autho(rs): Giuseppe D'Ippolito, Marcelo Ribeiro |
|
|
Descritores: Laser, Termoablação, Fígado, Tumores hepáticos, Metástases |
|
|
Resumo:
INTRODUÇÃO Atualmente a cirurgia é considerada o tratamento de escolha para tumores hepáticos primários(1?3) e secundários(4?6). No caso do hepatocarcinoma (HCC), as alternativas cirúrgicas de tratamento são a hepatectomia e o transplante hepático. No entanto, menos de 20% dos pacientes são candidatos à cirurgia, por causa do seu estado clínico ou pelo estádio avançado da doença; entre aqueles submetidos a tratamento cirúrgico, apenas uma pequena parcela será curada(7,8). Mesmo após o transplante hepático em pacientes portadores de HCC, a sobrevida em cinco anos varia entre 19% e 36%, com recidiva tumoral em até 10% dos casos(3). Tumores pequenos, menores que 3,0 cm de diâmetro, apresentam taxas de ressecabilidade mais elevadas, chegando a 70%(1), porém a morbidade e a mortalidade desta cirurgia são de até 26% e 7%, respectivamente(2). De maneira análoga, a ressecção cirúrgica tem sido a melhor opção para o tratamento de metástases hepáticas(4?6). Metástases hepáticas de câncer colorretal não ressecadas levam a uma sobrevida em cinco anos menor que 1% e uma vida média de cerca de nove meses(4). Por outro lado, diversos trabalhos têm demonstrado sobrevida em cinco anos de até 25?90% em pacientes ressecados por metástases hepáticas e com até quatro lesões(5,9,10). A morbi-mortalidade pré-operatória, por sua vez, tem variado entre 2% e 10%(4?6,9?11). Apesar desses resultados animadores, é importante lembrar que boa parte desses pacientes não é candidata à cirurgia, em função da extensão ou distribuição da doença(12). A quimioterapia sistêmica, por sua vez, não tem demonstrado melhora significativa na sobrevida desse grupo de pacientes(13,14). Portanto, apesar de a ressecção cirúrgica ser o melhor tratamento para aumentar a sobrevida de pacientes com tumores hepáticos primários e secundários, apenas pequena porcentagem destes pode se beneficiar desta terapêutica, em função do estadiamento do tumor no momento do diagnóstico, extensão da cirrose hepática e condições clínicas do paciente(15). A evolução dos diversos métodos de diagnóstico por imagem, aliada ao desenvolvimento de técnicas seguras de punção percutânea dirigida por esses métodos, facilitaram o emprego de uma série de opções terapêuticas para tumores hepáticos, denominadas minimamente invasivas(16) e também utilizadas no tratamento de lesões em outros órgãos como tireóide, mama, pâncreas, rins, adrenais e pulmões(16). A termoablação por raio laser encontra-se neste grupo de procedimentos terapêuticos. A primeira termoablação tumoral foi realizada por Bown em 1983(17), e as primeiras realizadas em tumores hepáticos primários e secundários foram realizadas, respectivamente, por Hashimoto et al. em 1985(18) e Steger et al. em 1989(19). Outras aplicações de raio laser têm sido utilizadas no tratamento de tumores do esôfago, estômago, cólon, brônquios, linfonodos, tumores pélvicos e da cabeça e pescoço(20?23). Nos últimos anos, diversos artigos têm sido publicados mostrando os resultados obtidos, principalmente no tratamento de metástases hepáticas(24?32) e do HCC(25,26, 30,32?37), com resultados bastante satisfatórios, tornando o método aceito como alternativa terapêutica eficiente e segura para pacientes considerados inoperáveis ou irressecáveis, com intuito curativo(38,39). O objetivo deste trabalho é apresentar uma revisão bibliográfica atualizada da termoablação por raio laser dos tumores hepáticos, abordando o mecanismo de ação deste método terapêutico, indicações e contra-indicações, complicações, resultados clínicos e métodos de diagnóstico por imagem envolvidos no procedimento.
MECANISMOS DE AÇÃO A elevação da temperatura acima de 46?50°C, por alguns minutos, produz necrose de coagulação e apoptose celular(24). Diversos métodos podem ser utilizados para se obter este aquecimento em um determinado alvo, entre eles a radiofreqüência e o raio laser. A termoablação intersticial induzida por laser utiliza uma fina fibra ótica, inserida por via percutânea, no interior de determinada lesão. Esta fibra ótica, ao emitir um raio laser, deposita calor na lesão, elevando a sua temperatura e produzindo desnaturação protéica e morte celular(29). As temperaturas obtidas não devem ultrapassar 100°C, para se evitar a carbonização e vaporização, que dificultam a difusão do calor, reduzindo assim a área tratada(24,29). A extensão da necrose depende da duração do tratamento, potência enviada pelo raio laser, características térmicas e óticas do tecido tratado(24); depende, também, do fluxo sanguíneo da lesão e do parênquima hepático circunstante(40?42). Quanto maior o fluxo sanguíneo, maior será a perda de calor e, portanto, será necessário um tempo maior de tratamento para se obter uma determinada área de necrose. Ao contrário, lesões hepáticas hipovascularizadas e distantes de grandes vasos são tratadas mais eficientemente. Seguindo este conceito, Germer et al. demonstraram, em modelo animal, que a combinação de embolização arterial e termoterapia laser aumenta consideravelmente a eficiência do laser no tratamento de metástases hepáticas(42). A alteração do fluxo vascular (arterial ou portal) pode também ser obtida por meio de medicamentos(40), embolização intra-arterial com balão(42) e manobra de Pringle(41). A manobra de Pringle pode ser realizada apenas por via aberta ou via laparoscópica(41). A extensão da necrose de coagulação depende também da quantidade de energia depositada(24,29). No entanto, utilizando-se potências excessivamente elevadas obtém-se elevação muito rápida da temperatura, promovendo a vaporização do tecido em contato com a fibra ótica, impedindo a propagação do calor para áreas mais distantes da agulha e reduzindo-se, assim, a capacidade de tratar lesões maiores. Por outro lado, quando se utiliza fibra ótica única e baixa energia (3?8 W), permite-se penetração e propagação mais profunda da luz e do calor, resultando em maiores volumes de necrose de coagulação(25). Mesmo assim, obtêm-se áreas de coagulação que não excedem 1,6 cm de diâmetro, em modelo animal(43,44). Utilizando-se fibras óticas múltiplas ou resfriadas é possível aumentar a potência do sistema para até 30 W, o que permite depositar mais energia, alcançar maiores volumes de necrose de coagulação e tratar lesões mais volumosas(26). Recentemente, Vogl et al. demonstraram, em estudo clínico, que o uso de laser resfriado internamente com solução salina permite aumentar em até cinco vezes a área de necrose obtida in vitro, com fibra ótica simples, no mesmo período de tratamento, sem provocar carbonização ou vaporização. Em pacientes portadores de metástases hepáticas esses autores obtiveram diâmetro médio de 3,3 ± 1,4 cm, utilizando o sistema resfriado internamente(26). Em trabalho anterior, usando-se fibra ótica simples e não resfriada, a área de necrose obtida foi inferior a 2,0 cm de diâmetro(25). O sistema de resfriamento interno do aplicador de raio laser baseia-se na introdução de solução salina resfriada no espaço entre o invólucro e a fibra ótica contida no seu interior. O resfriamento interno da superfície do aplicador laser modifica a distribuição radial das temperaturas, permitindo, desta forma, que temperaturas mais elevadas se propaguem para camadas mais profundas de tecido. Dessa forma, é possível aumentar a área tratada de 2?3 cm para 3?4,5 cm(26).
INDICAÇÕES E CONTRA-INDICAÇÕES A termoablação por raio laser apresenta as mesmas indicações e contra-indicações de outras técnicas minimamente invasivas. O método é indicado no tratamento de HCC e de metástases hepáticas em pacientes com lesões em ambos os lobos hepáticos e lesões recidivadas pós-hepatectomia, em pacientes inoperáveis ou que recusam a cirurgia, ou ainda naqueles com lesões irressecáveis do ponto de vista curativo(16, 24?26,29). Em uma série de 705 pacientes com 1.981 metástases hepáticas tratadas por raio laser, Mack et al. notaram que a distribuição das indicações foi: metástase recidivada em 36% dos casos, metástases em ambos os lobos hepáticos em 35%, contra-indicação clínica para cirurgia ou lesões irressecáveis em 22% e pacientes que recusaram a cirurgia em 7% dos casos(29). Apesar de a metástase de câncer colorretal ser a mais freqüentemente tratada, também têm sido abordadas com termoterapia por laser as metástases de câncer do estômago, mama, faringe, testículo, pulmão e tumores neuroendócrinos(16,26). O procedimento é contra-indicado em pacientes com distúrbios de coagulação não corrigidos ou que apresentam mais que cinco metástases, lesões maiores que 4?5 cm ou com evidência de doença extra-hepática(24,26,41).
TÉCNICA E MATERIAL Assim como outros métodos de termoablação, a termoterapia por raio laser pode ser realizada por via percutânea, via aberta ou por laparoscopia(41). A via percutânea é a mais comumente utilizada por diversas razões, entre elas o menor custo, menor morbi-mortalidade e menores tempos de recuperação(24,29). Quando por via percutânea, o procedimento pode ser realizado em regime ambulatorial, sendo, no entanto, preferível observação de 24 horas. O paciente é sedado com benzodiazepínico e realiza-se anestesia local na parede abdominal e cápsula hepática. Eventualmente, é possível realizar o procedimento com anestesia geral, o que é aconselhável para maior conforto do paciente. O procedimento é dirigido inicialmente por tomografia computadorizada (TC) ou ultra-som (US), quando se insere, por via percutânea, uma agulha de Chiba até 10 mm da margem mais superficial da lesão, para em seguida passar um fio-guia e dilatador 7F, que permitirá acomodar um cateter de plástico termorresistente (resiste a temperaturas de até 300?400°C), posicionado a 25 mm da lesão. Este cateter plástico tem fundo cego, para impedir o contato direto do aplicador laser com a lesão e permitir que seja retirado completamente, mesmo em caso de ruptura da fibra ótica. O aplicador laser, composto de fibras óticas, é então introduzido no interior do cateter plástico. A parte distal do aplicador laser é revestida de material magnético (magnetita), identificável no exame de ressonância magnética (RM). A termocoagulação por laser é obtida pela emissão de raio laser por um gerador apropriado e conduzida através da fibra ótica de quartzo contida no aplicador. A potência emitida pelo aplicador simples varia entre 3,0 e 8,8 W (média: 5,3 W)(25). Com o sistema de resfriamento interno é possível utilizar potências de até 30 W(26). Uma vez inserido o aplicador, a termoablação pode ser acompanhada por US ou, preferencialmente, por RM. Após terminada a termoablação, que dura entre 10 e 35 minutos por lesão (média: 19 minutos), retira-se o cateter plástico e introduz-se cola de fibrina para se obter hemostasia(25). O tempo de aplicação do raio laser depende do sistema utilizado, potência aplicada, localização da lesão, sua relação com grandes vasos (veia porta, veias hepáticas) e as características térmicas e óticas da lesão(16,25,26). Lesões hipervasculares podem ser alcoolizadas antes da termoablação, para se desvascularizar a lesão e obter, assim, melhores resultados(16). O procedimento dura aproximadamente duas horas. O paciente permanece em observação, no hospital, por cerca de 24 horas. São realizados exames de RM ou TC helicoidal com contraste de controle, um dia e um mês após o procedimento, e então a cada três ou quatro meses.
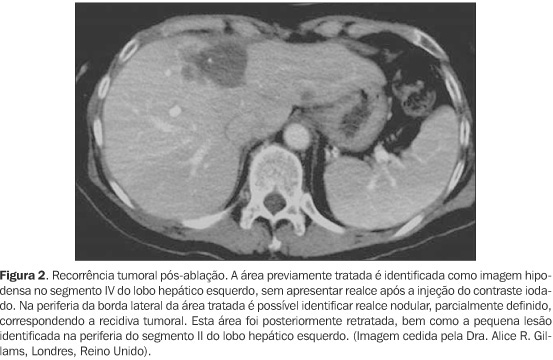
DIAGNÓSTICO POR IMAGEM A termoablação por laser inicia-se com a detecção e caracterização da lesão hepática. Para isto, é possível utilizar o US, a TC helicoidal ou a RM com contraste. É necessário obter-se um exame na semana que precede o procedimento, para ser utilizado como parâmetro de medida do resultado da termoablação(25). Os métodos mais eficazes são a TC helicoidal e a RM com contraste(16,29,30) (Figuras 1 e 2). O US tem sido mais utilizado para orientar a primeira parte do procedimento e, eventualmente, a termoablação propriamente dita, acompanhando o resultado do tratamento em tempo real, assim como é possível fazê-lo por meio da RM(30). É importante observar que o sucesso do procedimento depende da precisa colocação da agulha no interior da lesão e do acompanhamento contínuo durante a termoablação, o que é obtido preferencialmente pela RM(30).
O US foi inicialmente utilizado na orientação e acompanhamento da termoablação por laser de lesões hepáticas, por Nolsoe et al. em 1991(45). Nesse trabalho e em outro, posteriormente publicado pelo mesmo grupo(27), os autores demonstraram que uma lesão hepática maligna, originalmente hipoecogênica ou isoecogênica, torna-se progressivamente hiperecogênica durante a aplicação do laser, em função da formação de microbolhas. Uma vez terminada a termoablação, a lesão apresenta aspecto "em alvo", composto por uma área central hipoecogênica, correspondendo à necrose, e dois halos periféricos mais ecogênicos, o interno correspondendo a tecido carbonizado e o externo correspondendo a coagulação e hiperemia. Os autores obtiveram excelente correlação (r = 0,89) entre o diâmetro da lesão medido ao US e à macroscopia(45). Porém, trabalhos de outros autores demonstraram que a avaliação por US de lesões hepáticas tratadas por termoablação tende a superestimar o volume de necrose de coagulação, quando comparada com a análise histopatológica(46). A TC com contraste também tem sido esporadicamente utilizada para orientar o procedimento e acompanhar os resultados obtidos, mas com eficácia inferior à RM(30). Em 1986, Dickinson et al. demonstraram, in vitro e in vivo, que existe uma dependência linear entre a temperatura e o tempo de relaxamento T1 (spin-retículo). Os autores demonstraram que ocorre um aumento do T1 na razão de 5?18 ms/°C, e que esta alteração é reversível, retornando aos valores originais após a queda de temperatura(28). McDannold et al. utilizaram este conceito para monitorar a termoablação por meio da RM, aplicando técnicas denominadas termossensíveis gradiente-eco e que utilizam tempo de repetição (TR) e "flip angle" curtos(47). O aumento da temperatura provoca um aumento do T1 e, portanto, queda do sinal da lesão. Estima-se que para uma potência de raio laser aplicado por 20 minutos a 30 W o T1 aumenta em até 205%, com queda de sinal proporcional(26). Vogl et al. demonstraram, retrospectivamente, que todas as lesões hepáticas que apresentaram queda de sinal superior a 50%, imediatamente após a termoterapia por laser, foram completamente tratadas, sem recorrência tumoral nos exames de controle tardio, sem esclarecer, no entanto, em que intervalo de tempo foram realizados os controles(26). Uma outra forma de se avaliar a resposta ao tratamento pela RM é realizando-se fase dinâmica com contraste paramagnético e adquirindo-se imagens nas fases de contrastação arterial, portal e de retardo. O realce nodular ou central é indicativo de persistência ou recorrência da lesão. É importante notar que realce anelar periférico indicando hiperemia e processo inflamatório é observado em até 75% das lesões, desaparecendo após oito semanas em 75% dos casos. Nos 25% restantes, o realce periférico pode ser observado até seis meses após o tratamento, não indicando presença de tecido tumoral(25). Também notam-se defeitos de perfusão no parênquima hepático adjacente em até 75% das lesões examinadas com a RM com injeção de contraste paramagnético(25). A queda de sinal em T1 é indicativa de elevação de temperatura, mas não necessariamente de necrose. A melhor maneira de se verificar o resultado do tratamento é pela identificação direta de áreas não perfundidas, indicando necrose, e isto somente é possível após a injeção endovenosa de contraste(48). O contraste paramagnético só pode ser injetado uma ou duas vezes por procedimento, limitando este recurso, que poderá, no entanto, ser utilizado novamente no pós-procedimento imediato. Apesar de a RM apresentar os melhores resultados no acompanhamento do procedimento, ressalta-se que, idealmente, dever-se-ia utilizar magneto aberto, ainda não amplamente disponível em todos os centros.
RESULTADOS CLÍNICOS Diversos trabalhos têm demonstrado os resultados obtidos com a termoablação por laser no tratamento de tumores hepáticos primários e secundários, apesar das escassas referências quanto ao acompanhamento no longo prazo (três a cinco anos). Vogl et al., em 1995, ao tratarem 15 pacientes com metástases hepáticas e cinco pacientes com tumores primários, obtiveram melhores resultados terapêuticos nas lesões menores que 2,0 cm de diâmetro do que naquelas maiores que 3,0 cm de diâmetro, em que obtiveram necrose completa em apenas 8% dos casos. No seguimento desses pacientes, aqueles com lesões menores ou iguais a 2,0 cm apresentaram-se livre de doença em 69% dos casos em seis meses e em 44% dos casos em 12 meses após o tratamento. Para lesões maiores que 2,0 cm de diâmetro, os índices de sucesso foram significativamente inferiores, respectivamente, de 41% e 27%. Os autores consideram como sucesso lesões inalteradas ou menores em relação ao controle pós-tratamento imediato(25). Em 2001, Vogl et al. publicaram a sua experiência em 705 pacientes com 1.981 metástases hepáticas submetidos a termoablação por laser em um período de sete anos. A sobrevida média foi de 41,8 meses. A sobrevida após um, dois, três e cinco anos foi de 93%, 74%, 50% e 30%, respectivamente, naqueles pacientes portadores de metástase por câncer colorretal. Resultados semelhantes foram observados no grupo de pacientes com metástase por neoplasia de mama. Os melhores resultados foram obtidos em pacientes com menos de três lesões hepáticas(29). Em 2001, Christophi e Muralidharan descreveram os seus resultados em oito pacientes cirróticos, Child B e C, portadores de HCC com diâmetro variando entre 3,0 e 7,0 cm, tratados com termoablação por laser. Necrose completa da lesão foi obtida em todos os tumores menores ou iguais a 4,0 cm, mas em nenhuma maior que 4,0 cm. A sobrevida dos pacientes variou entre 8 e 18 meses(34). Pacella et al., em 2001, combinaram a termoablação por laser com a quimioembolização intra-arterial em 30 pacientes portadores de grandes HCC (3,5?9,6 cm de diâmetro) e pequenos HCC (0,8?3,0 cm de diâmetro; média de 1,9 cm). Obtiveram necrose completa demonstrada pela TC em 27/30 grandes HCC (90%) e em todos os pequenos HCC. A sobrevida global após um, dois e três anos de tratamento foi, respectivamente, 92%, 68% e 40%(35).
COMPLICAÇÕES Ocorrem complicações em 1,2% a 7,5% dos casos(24,29) e são consideradas clinicamente relevantes em apenas 1,3% deles(29). As mais freqüentes são: derrame pleural (73%), hematoma subcapsular hepático (31%), abscesso hepático (0,4?0,6%) e infarto hepático segmentar (1%)(16,29). Implantes no trajeto da agulha são descritos em até 6/500 (1,2%) dos casos(16). Foram também descritos alguns casos de óbito em decorrência do tratamento: um caso em 500 pacientes tratados, devido a infarto hepático espontâneo(16), um caso em 705 tratados, aparentemente relacionado ao procedimento, mas de causa não esclarecida(29), e, finalmente, um caso relacionado a embolia pulmonar, em conseqüência da introdução de gás para esfriar o aplicador do raio laser(49).
LASER × RADIOFREQÜÊNCIA Estes métodos atuam de forma semelhante, elevando a temperatura no interior da lesão-alvo, provocando, assim, necrose de coagulação. Ambos os métodos podem ser usados por via percutânea, laparoscópica ou por laparotomia. Atualmente, a termoablação a laser é a única rotineiramente utilizada em conjunto com a RM(16,24). Aparentemente, a RF é mais simples de ser manipulada e de se obter maiores lesões em tempo mais curto(50). A RF tem-se beneficiado de maior experiência clínica em um número maior de centros de pesquisa. No entanto, ainda não foram publicados estudos randomizados comparando com rigor as duas modalidades terapêuticas. Também serão necessários estudos randomizados e controlados para estabelecer o papel destes métodos de termoablação em comparação com a ressecção hepática e quimioterapia intra-arterial e sistêmica.
CONCLUSÃO Os estudos clínicos preliminares, utilizando a termoablação por raio laser, demonstram que esta técnica, considerada "minimamente invasiva", é uma alternativa válida à ressecção hepática no tratamento de tumores primários e secundários em pacientes que, por diversas razões, não são candidatos ao tratamento cirúrgico. A termoterapia por laser é um método bastante seguro e eficiente quando utilizado com critério e de forma adequada, valendo-se dos diversos métodos de diagnóstico por imagem para planejar, guiar e acompanhar os resultados do procedimento. No entanto, serão necessários ulteriores estudos para confirmar a eficácia do método em maior número de pacientes, acompanhados por um longo prazo, e para se comparar a eficiência deste método com outras técnicas de termoablação (por exemplo, a RF) e com a própria cirurgia.
REFERÊNCIAS 1. Tang ZY, Yu YQ, Zhou XD, et al. Surgery of small hepatocellular carcinoma: analysis of 144 cases. Cancer 1996;64:536?41. [ ] 2. Holbrook RF, Koo K, Ryan J. Resection of malignant primary liver tumors. Am J Surg 1996;171: 453?5. [ ] 3. Mazzaferro V, Regalia E, Doci R. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996;334:693?9. [ ] 4. Ballantyne GH, Quin J. Surgical treatment of liver metastases in patients with colorectal cancer. Cancer 1993;71:4252?66. [ ] 5. Nakamura S, Yokoi Y, Suzuki S, Baba S, Muro H. Results of extensive surgery for liver metastases in colorectal carcinoma. Br J Surg 1992;79:35?8. [ ] 6. Saenz NC, Cady B, McDermott WV Jr, Steele GD Jr. Experience with colorectal carcinoma metastatic to the liver. Surg Clin North Am 1989;69:361?70. [ ] 7. Ravoet C, Bleiberg H, Gerard B. Non-surgical treatment of hepatocarcinoma. J Surg Oncol Suppl 1993;3:104?11. [ ] 8. Venook A. Treatment of hepatocellular carcinoma: too many options? J Clin Oncol 1994;12:1323?34. [ ] 9. Steele G Jr, Bleday R, Mayer RJ, Lindblad A, Petrelli N, Weaver D. A prospective evaluation of hepatic resection for colorectal carcinoma metastases to the liver: Gastrointestinal Tumor Study Group Protocol 6584. J Clin Oncol 1991;9:1105?12. [ ] 10. Gayowski TJ, Iwatsuki S, Madariaga JR, et al. Experience in hepatic resection for metastatic colorectal cancer: analysis of clinical and pathologic risk factors. Surgery 1994;116:703?11. [ ] 11. Cady B, Stone MD. The role of surgical resection of liver metastases in colorectal carcinoma. Semin Oncol 1991;18:399?406. [ ] 12. Steele G Jr, Ravikumar TS. Resection of hepatic metastases from colorectal cancer. Biologic perspective. Ann Surg 1989;210:127?38. [ ] 13. Benson AB. Therapy for advanced colorectal cancer. Semin Oncol 1998;25:2?11. [ ] 14. Schachschal G, Lochs H, Plauth M. Controlled clinical trial of doxorubicin and tamoxifen versus tamoxifen monotherapy in hepatocellular carcinoma. Eur J Gastroenterol Hepatol 2000;12: 281?4. [ ] 15. Usatoff V, Habib NA. Update of laser-induced thermotherapy for liver tumors. Hepatogastroenterology 2001;48:330?2. [ ] 16. Dodd GD III, Soulen MC, Kane RA, et al. Minimally invasive treatment of malignant hepatic tumors: at the threshold of a major breakthrough. RadioGraphics 2000;20:9?27. [ ] 17. Bown SG. Phototherapy in tumors. World J Surg 1983;7:700?9. [ ] 18. Hashimoto D, Takami M, Idezuki Y. In depth radiation therapy by YAG laser for malignant tumors in the liver under ultrasonic imaging (abstract). Gastroenterology 1985;88:1663. [ ] 19. Steger AC, Lees WR, Walmsley K, Bown SG. Interstitial laser hyperthermia: a new approach to local destruction of tumours. BMJ 1989;299:362?5. [ ] 20. Fleischer D, Sivak MV. Endoscopic Nd:YAG laser therapy as palliative treatment for advanced adenocarcinoma of the gastric cardia. Gastroenterology 1984;87:815?20. [ ] 21. Swain CP, Bown SG, Edwards DA, Kirkham JS, Salmon PR, Clark CG. Laser recanalization of obstructing foregut cancer. Br J Surg 1984;71:112?5. [ ] 22. Bown SG, Barr H, Matthewson K, et al. Endoscopic treatment of inoperable colorectal cancers with the Nd YAG laser. Br J Surg 1986;73:949?52. [ ] 23. Hetzel MR, Nixon C, Edmondstone WM, et al. Laser therapy in 100 tracheobronchial tumours. Thorax 1985;40:341?5. [ ] 24. Gillams AR. Thermal ablation of liver metastases. Abdom Imaging 2001;26:361?8. [ ] 25. Vogl TJ, Muller PK, Hammerstingl R, et al. Malignant liver tumors treated with MR imaging-guided laser-induced thermotherapy: technique and prospective results. Radiology 1995;196:257?65. [ ] 26. Vogl TJ, Mack MG, Roggan A, et al. Internally cooled power laser for MR-guided interstitial laser-induced thermotherapy of liver lesions: initial clinical results. Radiology 1998;209:381?5. [ ] 27. Nolsoe CP, Torp-Pedersen S, Burcharth F, et al. Interstitial hyperthermia of colorectal liver metastases with a US-guided Nd-YAG laser with a diffuser tip: a pilot clinical study. Radiology 1993; 187:333?7. [ ] 28. Dickinson RJ, Hall AS, Hind AJ, Young IR. Measurement of changes in tissue temperature using MR imaging. J Comput Assist Tomogr 1986;10:468?72. [ ] 29. Mack MG, Straub R, Eichler K, et al. Percutaneous MR imaging-guided laser-induced thermotherapy of hepatic metastases. Abdom Imaging 2001;26:369?74. [ ] 30. Vogl TJ, Eichler K, Straub R, et al. Laser-induced thermotherapy of malignant liver tumors: general principals, equipment(s), procedure(s)-side effects, complications and results. Eur J Ultrasound 2001; 13:117?27. [ ] 31. Masters A, Steger AC, Lees WR, Walmsley KM, Bown SG. Interstitial laser hyperthermia: a new approach for treating liver metastases. Br J Cancer 1992;66:518?22. [ ] 32. Hahl J, Haapiainen R, Ovaska J, Puolakkainen P, Schroder T. Laser-induced hyperthermia in the treatment of liver tumors. Lasers Surg Med 1990;10: 319?21. [ ] 33. Bremer C, Allkemper T, Menzel J, Sulkowski U, Rummeny E, Reimer P. Preliminary clinical experience with laser-induced interstitial thermotherapy in patients with hepatocellular carcinoma. J Magn Reson Imaging 1998;8:235?9. [ ] 34. Christophi C, Muralidharan V. Treatment of hepatocellular carcinoma by percutaneous laser hyperthermia. J Gastroenterol Hepatol 2001;16:548?52. [ ] 35. Pacella CM, Bizzarri G, Cecconi P, et al. Hepatocellular carcinoma: long-term results of combined treatment with laser thermal ablation and transcatheter arterial chemoembolization. Radiology 2001;219:669?78. [ ] 36. Wang TH, Huang GT, Sheu JC, Daikuzono N, Sung JL, Chen DS. Laserthermia for the treatment of small hepatocellular carcinoma: a preliminary study. J Clin Laser Med Surg 1991;9:195?7. [ ] 37. Dowlatshahi K, Bhattacharya AK, Silver B, Matalon T, Williams JW. Percutaneous interstitial laser therapy of a patient with recurrent hepatoma in a transplanted liver. Surgery 1992;112:603?6. [ ] 38. Muralidharan V, Christophi C. Interstitial laser thermotherapy in the treatment of colorectal liver metastases. J Surg Oncol 2001;76:73?81. [ ] 39. Hargreaves GM, Adam R, Bismuth H. Results after nonsurgical local treatment of primary liver malignancies. Langenbecks Arch Surg 2000;385: 185?93. [ ] 40. Goldberg SN, Hahn PF, Halpern EF, Fogle RM, Gazelle GS. Radio-frequency tissue ablation: effect of pharmacologic modulation of blood flow on coagulation diameter. Radiology 1998;209:761?7. [ ] 41. Germer CT, Albrecht D, Roggan A, Isbert C, Buhr HJ. Experimental study of laparoscopic laser-induced thermotherapy for liver tumours. Br J Surg 1997;84:317?20. [ ] 42. Germer CT, Isbert C, Albrecht D, et al. Laser-induced thermotherapy combined with hepatic arterial embolization in the treatment of liver tumors in a rat tumor model. Ann Surg 1999;230:55?62. [ ] 43. Dachman AH, McGehee JA, Beam TE, Burris JA, Powell DA. US-guided percutaneous laser ablation of liver tissue in a chronic pig model. Radiology 1990;176:129?33. [ ] 44. Bosman S, Phoa SS, Bosma A, van Gemert MJ. Effect of percutaneous interstitial thermal laser on normal liver of pigs: sonographic and histopathological correlations. Br J Surg 1991;78:572?5. [ ] 45. Nolsoe CP, Torp-Pedersen S, Holm HH, et al. Ultrasonically guided interstitial Nd-YAG laser diffuser tip hyperthermia: an in vitro study. Scand J Urol Nephrol Suppl 1991;137:119?24. [ ] 46. Hansen PD, Rogers S, Corless CL, Swanstrom LL, Siperstien AE. Radiofrequency ablation lesions in a pig liver model. J Surg Res 1999;87:114?21. [ ] 47. McDannold N, Hynynen K, Jolesz F. MRI monitoring of the thermal ablation of tissue: effects of long exposure times. J Magn Reson Imaging 2001;13: 421?7. [ ] 48. Germer C, Isbert CM, Albrecht D, et al. Laser-induced thermotherapy for the treatment of liver metastasis. Correlation of gadolinium-DTPA-enhanced MRI with histomorphologic findings to determine criteria for follow-up monitoring. Surg Endosc 1998;12:1317?25. [ ] 49. Schroder TM, Puolakkainen PA, Hahl J, Ramo OJ. Fatal air embolism as a complication of laser-induced hyperthermia. Lasers Surg Med 1989;9:183?5. [ ] 50. Lees WR, Gillams AR. Comparison of the effectiveness of cooled tip radiofrequency and interstitial laser photocoagulation in liver tumour ablation. Radiology 1999;213:123. [ ]
Recebido para publicação em 21/5/2003
* Trabalho realizado nos Serviços de Diagnóstico por Imagem e Cirurgia Hepática do Hospital São Luiz, São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554