Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 37 nº 2 - Mar. / Abr. of 2004
Vol. 37 nº 2 - Mar. / Abr. of 2004
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Renato José Affonso Júnior, Celina Tizuko Fujiyama Oshima, Edna Teruko Kimura, Maria Regina Regis Silva, Mizue Imoto Egami, Roberto Araújo Segreto, Helena Regina Comodo Segreto |
|
|
Descritores: Radiação ionizante, Fibrose cardíaca, Fator beta de transformação do crescimento (TGFbeta) |
|
|
Resumo: IIIProfessora Associada Doutora do Departamento de Histologia do Instituto de Ciências Biomédicas da Universidade de São Paulo (USP)
Introdução A resposta do coração à radiação constitui importante fator a ser respeitado quando o tórax é irradiado em campos restritos, para diferentes patologias tais como a doença de Hodgkin e câncer de mama, bem como nos protocolos para irradiação de corpo inteiro(1,2). O aparecimento e a gravidade das alterações cardíacas radioinduzidas dependem do volume de coração irradiado, da dose total de radiação, da dose por fração e da taxa de dose utilizada(3,4). As principais alterações histopatológicas no coração irradiado são o estreitamento ou substituição da média e adventícia dos vasos por tecido fibrótico, alteração dos fibroblastos e fibrose intersticial difusa quando há envolvimento miocárdico e/ou pericárdico. Incidência de 5% de trombose coronária também pode ser observada(3). Devido à complexidade funcional e estrutural do coração, as alterações cardíacas podem ser classificadas em pericardite aguda (durante a irradiação), pericardite tardia, pancardite (fibrose pericárdica e miocárdica) e doença arterial coronária(5). Quanto ao mecanismo da fibrose cardíaca após irradiação, observa-se importante papel do fator transformador de crescimento b (TGFb) no processo(6). A TGFb é uma citoquina multifuncional que exerce in vivo três principais atividades biológicas: modula o crescimento celular com principal atividade inibitória do mesmo(7), exerce atividades imunossupressoras e regula a deposição dos componentes da matriz extracelular(8,9). Parte da resposta fibrótica induzida pela TGFb parece estar relacionada com o descontrole da modulação do sistema fibroblasto/fibrócito, levando ao acúmulo de colágeno tipo I e tipo II(10-12). Em células de mamíferos, a TGFb está presente sob três isoformas — TGFb1, TGFb2 e TGFb3 —, sendo as proteínas produzidas na forma inativa e ligadas ao peptídio associado à latência (LAP)(13-16). Assim, a atividade biológica desta proteína depende da dissociação da TGFb madura do complexo latente(17). In vivo, são ativadas por proteases que clivam o complexo latente, e a plasmina é uma das proteases envolvidas no processo de ativação(18). Observou-se ativação da proteína TGFb1 em células da glândula mamária(17), megacariócitos da medula óssea(19), brônquios e alvéolos pulmonares em horas e dias depois da irradiação(20). É relatado, na literatura, aumento dos níveis do RNAm da TGFb1 aos 12 dias e aos 3 meses após irradiação em tecido cardíaco(6). Não é referido, porém, se é a TGFb1 latente ou a ativa, em quais células a proteína está presente e se é ativada in situ. À vista das alterações que podem ser produzidas no coração irradiado, a relevância clínica dessas alterações e o desejo de minimizá-las é que existe grande interesse em esclarecer os mecanismos envolvidos, em especial no que diz respeito à fibrose. Dessa forma, o objetivo do presente trabalho é investigar, no coração, por imuno-histoquímica, a localização das proteínas TGFb1 latente e TGFb1 ativa, se ocorre ativação radioinduzida da proteína TGFb1 latente e a distribuição das fibras colágenas em diversos períodos de tempo após irradiação.
Materiais e Métodos Animais: Foram utilizados 32 camundongos da linhagem C57BL, machos, com idade média de 75 dias, pesando aproximadamente 22 g. O estudo foi aprovado pelo Comitê de Ética da Universidade Federal de São Paulo/Escola Paulista de Medicina/Hospital São Paulo. Durante o experimento, os animais foram mantidos em número de quatro por gaiola de plástico, contendo serragem, recebendo alimento e água ad libitum. Os camundongos foram numerados, sorteados e distribuídos em dois grupos: grupo I - GI (não irradiado), com 12 animais, e grupo II - GII (irradiado), com 20 animais. Os animais do grupo II foram subdivididos em quatro subgrupos com cinco camundongos cada, de acordo com o período de tempo escolhido para o sacrifício, isto é, 1 (n = 5), 14 (n = 5), 30 (n = 5) e 90 (n = 5) dias após a irradiação. Os animais do grupo I (controle) foram manipulados, subdivididos e sacrificados de maneira semelhante àqueles do grupo II, sendo três para cada subgrupo. Os dias de sacrifício foram escolhidos após a realização de estudo piloto para determinar quais os melhores períodos de tempo para evidenciar os parâmetros escolhidos para análise. Para isto, os animais foram sacrificados em diversos dias após irradiação (1, 3, 6, 14, 20, 30 e 90 dias). Irradiação: Os camundongos do GII foram submetidos à radiação gama em aparelho de telecobaltoterapia da marca CGR, modelo Acyon II, contendo fonte de 60Co, com rendimento de 0,97 Gy/min., em campo 20 × 20 cm, à distância de 80 cm da fonte. Na ocasião da exposição à radiação, os camundongos foram colocados em caixas de madeira de 20 × 20 cm, com tampa de acrílico e divisões internas que possibilitaram a imobilização dos animais e, portanto, não foram anestesiados. Os camundongos foram irradiados com dose de 7 Gy em corpo inteiro, calculado em todo volume corporal, com a técnica de paralelo oposto, num campo de 20 × 20 cm, com distância foco-superfície de 80 cm. Nos períodos de tempo pré-estabelecidos (1, 14, 30 e 90 dias) os animais foram sacrificados por estiramento cervical, e os pulmões retirados. Morfologia: Após o sacrifício dos animais por estiramento cervical, os corações foram retirados e submetidos a técnicas histopatológicas rotineiras. Em cada amostra de coração dos animais do GI (não irradiado) e GII (irradiado) realizou-se cuidadosa análise morfológica de regiões do miocárdio dos átrios e ventrículos e também do pericárdio, em seções coradas pelo HE, e das regiões onde ocorreram deposição de fibras colágenas após coloração por picro sirius e prata de Gomori, em todos os períodos de tempo escolhidos. Realizou-se, também, quantificação utilizando-se uma ocular histométrica, em microscópio de luz, das fibras colágenas com aspecto morfológico característico, coradas pelo picro sirius, que não discrimina subtipos de colágeno, e pela prata de Gomori, que evidencia o colágeno III, contando-se ao acaso as regiões do miocárdio dos átrios, ventrículos e do pericárdio(21) dos animais dos grupos I (1 dia, n = 3; 14 dias, n = 3; 30 dias, n = 3; 90 dias, n = 3) e II (1 dia, n = 5; 14 dias, n = 5; 30 dias, n = 5; 90 dias, n = 5). Usou-se ocular integradora de 100 pontos da marca Carl Zeiss. Foram contados dez campos com 100 pontos em cada lâmina, sendo 1.000 pontos por lâmina (picro sirius e reticulina), totalizando 2.000 pontos por animal. As contagens foram realizadas "às cegas", ou seja, as lâminas tinham suas identificações encobertas. Os resultados numéricos obtidos foram submetidos a análise estatística. Análise estatística: A análise de variância por postos de Kruskal-Wallis(22) foi utilizada para comparar os resultados obtidos nos diferentes períodos de tempo de sacrifício (1, 14, 30 e 90 dias), dentro de cada grupo, isto é, GI (não irradiado) e GII (irradiado), para os dois métodos utilizados (picro sirius e prata de Gomori). Foi aplicado o teste não paramétrico de Mann-Whitney(22) para duas amostras independentes, para comparar o grupo não irradiado (GI) com o grupo irradiado (GII), em cada um dos quatro períodos de sacrifício, para os dois métodos empregados (picro sirius e prata de Gomori). Em todos os testes fixou-se em 0,05 ou 5% (p < 0,05) o nível de rejeição da hipótese de nulidade, assinalando-se com um asterisco os valores significantes. Anticorpos: Foram utilizados os seguintes anticorpos: anticorpo policlonal anti LAP (TGFb1) recombinante humano, obtido em cabra (R&D Systems Inc., Minneapolis, MN), específico para evidenciar a expressão da proteína TGFb1 latente, e o anticorpo policlonal anti TGFb1 de rato, camundongo e humano, obtido em coelho (Santa Cruz Biotechnology, Santa Cruz, CA), para observação da imunoexpressão da proteína TGFb1 ativa. Dessa forma, o uso de diferentes anticorpos permite detectar a proteína na forma latente e inativa (ligada ao complexo latente) e na forma ativa (após clivagem do complexo latente), e evidenciar se ocorre ou não a ativação in situ da proteína(17). Imuno-histoquímica: O ensaio imuno-histoquímico baseou-se no método imunoenzimático indireto em três etapas, utilizando-se o complexo estreptoavidina-biotina-fosfatase alcalina. Os cortes foram colocados em lâminas silanizadas (Sigma, St. Louis, MD), e após desparafinização foram incubados com os anticorpos primários, em temperatura ambiente, a noite toda. Após lavagem em solução de PBS, as seções foram incubadas com os anticorpos secundários biotinilados por três horas. Posteriormente, foram incubadas com a solução do complexo estreptoavidina-fosfatase alcalina (Sigma) por duas horas, para detectar as proteínas TGFb1 latente e TGFb1 ativa. Para a revelação da fosfatase alcalina, os cortes foram incubados com solução substrato-cromógeno recém-preparada, contendo naftol- AS - MX-fosfato (Sigma), levamizol (Sigma) e o sal cromogênico "fast red TR" (Sigma), diluídos em solução tempão acetato de veronal, pH 8,3. Os complexos de imunoglobulina foram demonstrados pela positividade expressa em vermelho para as proteínas TGFb1 latente e TGFb1 ativa. Os cortes foram então lavados durante toda a noite, contracorados com hematoxilina de Gill e montados com immu-mount (Shandon, Pittsburgh, PA). Controles com omissão do anticorpo primário foram incluídos em todos os experimentos. A análise imuno-histoquímica foi realizada em corações dos animais de ambos os grupos, GI e GII, sendo um animal para cada período de sacrifício (GI) e dois animais para cada período de sacrifício (GII).
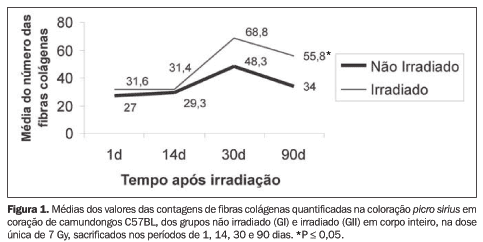
RESULTADOS Alterações morfológicas e histométricas: comparação entre os corações irradiados (GII) e não irradiados (GI) Observaram-se alterações das fibras musculares, que apresentaram os núcleos ora mais volumosos com cromatina fina, ora pequenos com cromatina condensada, estriações menos nítidas e acentuação do colágeno intersticial. Estas alterações ocorreram aos 30 dias, e de modo mais evidente aos 90 dias após irradiação. Nos períodos de 1 e 14 dias depois da irradiação não foram observadas alterações cardíacas significantes. Após análise dos resultados morfológicos que sugeriram aumento da deposição de colágeno, foi realizada quantificação deste. Esta contagem mostrou aumento significante das fibras colágenas em geral, perivascular e ao longo das fibras musculares, evidenciadas pelo picro sirius, aos 90 dias depois da irradiação (Figura 1).
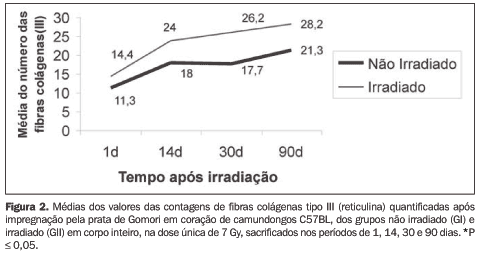
Quanto ao colágeno III, evidenciado pela prata de Gomori, não ocorreu aumento significante deste nos períodos de tempo estudados (Figura 2).
Análise imuno-histoquímica TGFb latente: A imunoexpressão da proteína TGFb1 latente, demonstrada pela cor vermelha, foi observada positiva, com padrão granular e de distribuição difusa nos cardiomiócitos em extensas áreas cardíacas. Foram observadas algumas regiões que apresentavam cardiomiócitos com fraca imunopositividade. No tecido conjuntivo ocorreu forte imunorreatividade para a proteína TGFb1 latente. Este padrão foi observado em todos os períodos do grupo controle (GI) (Figuras 3A e 3B). Quanto aos animais irradiados (GII) e sacrificados um dia depois, a imunoexpressão da proteína TGFb1 latente manteve a mesma localização e forte positividade nos cardiomiócitos, semelhantes ao controle. Porém, a forte imunopositividade para a proteína TGFb1 latente no tecido conjuntivo ocorreu em menor extensão do coração em relação ao controle. Nos períodos de 14 e 30 dias após irradiação foram observadas várias e extensas regiões com cardiomiócitos fracamente positivos e negativos sugerindo diminuição da expressão desta proteína. Este mesmo padrão ocorreu nas células do conjuntivo. Aos 90 dias depois da irradiação foram observados cardiomiócitos imunopositivos para a proteína TGFb1 latente. Porém, ocorreram várias áreas com cardiomiócitos fracamente positivos. O tecido conjuntivo apresentou imunoexpressão da proteína TGFb1 latente em menores regiões em relação ao controle, e foram observadas poucas células positivas e várias negativas (Figuras 3C e 3D). TGFb1 ativa: O coração dos animais controles (GI), nos diversos períodos de sacrifício, revelou várias áreas com cardiomiócitos imunopositivos para a proteína TGFb1, ativa com padrão granular e de distribuição difusa. Foram observadas algumas regiões com fraca imunopositividade e escassas negativas. O tecido conjuntivo apresentou fraca imunorreatividade para a proteína TGFb1 ativa e raras células imunopositivas (Figuras 3E e 3F). No período de um dia após a irradiação verificou-se aparente aumento da imunoexpressão da proteína TGFb1 ativa nos cardiomiócitos, em comparação com o controle. Este aspecto foi observado em extensas áreas cardíacas com cardiomiócitos fortemente positivos com padrão granular e de distribuição difusa. Em algumas regiões ocorreu fraca imunorreatividade. O tecido conjuntivo apresentou aspecto imuno-histoquímico semelhante ao controle. Este padrão foi mantido aos 14 dias após a irradiação, tanto para os cardiomiócitos quanto para o tecido conjuntivo. Aos 30 dias após a irradiação os cardiomiócitos apresentaram aspecto imuno-histoquímico semelhante aos períodos anteriores. Porém, o tecido conjuntivo aparentemente apresentou imunorreatividade para a proteína TGFb1 ativa e em maiores extensões em relação aos períodos anteriores. No período de 90 dias depois da irradiação foram observadas várias áreas de cardiomiócitos fortemente positivos com padrão granular, de distribuição difusa, ao lado de algumas regiões negativas. No tecido conjuntivo foi observada forte imunoexpressão da proteína TGFb1 ativa em regiões mais extensas do que nos demais períodos estudados (Figuras 3G e 3H).
DISCUSSÃO Os resultados histopatológicos obtidos nos corações irradiados evidenciam alterações das fibras musculares, que apresentam núcleos ora mais volumosos com cromatina fina, ora pequenos com cromatina condensada, menor nitidez das estriações e acentuação do colágeno. Estas alterações foram observadas aos 30 dias e ficaram mais evidentes aos 90 dias após irradiação. Alterações histopatológicas nas células musculares miocárdicas, no periocárdio e vasos do coração foram relatados por diversos autores na literatura, em modelos experimentais com coelhos e ratos, utilizando-se diferentes doses de radiação(1,23-27). Importante ressaltar o estudo de Gillette et al.(28), que determinou a razão a/b em coração de cães e coelhos irradiados, de 2,4 Gy para o miocárdio, 2,9 Gy para o pericárdio e 1,8 a 2,8 Gy para os vasos. Relataram, também, que o risco de doença arterial coronariana aumenta com o aumento da dose por fração. Esses resultados foram obtidos com o uso de doses da ordem de 20 Gy localizadas em região torácica e administradas em diferentes doses por fração. Neste trabalho, para o estudo das alterações cardíacas radioinduzidas, a dose total utilizada foi menor que 7 Gy, porém, administrada como fração única e em corpo inteiro. Dessa forma, foi possível a indução de lesão cardíaca e possibilitou o estudo de fatores envolvidos na mesma. Para análise quantitativa da deposição do colágeno foram realizadas colorações com picro sirius e com a prata de Gomori. Em relação especificamente ao picro sirius, a quantificação do colágeno não foi realizada em microscópio de luz polarizada(29), porque o fundo escuro deste, associado ao retículo em preto da ocular histométrica, dificultava consideravelmente a contagem. Por isso, foi utilizado o microscópio de luz comum, tomando-se o cuidado de considerar, para as contagens, as estruturas com características morfológicas de fibras colágenas coradas em vermelho. Isto possibilitou estimar o colágeno em geral. Esta análise foi complementada pela coloração com a prata de Gomori eletiva para colágeno III, que permitiu, assim, quantificar a fibrose reticulínica inicial(30). O aumento significante da deposição do colágeno em geral, verificado no período de 90 dias, constitui importante efeito radioinduzido no coração e de implicações clínicas para o paciente irradiado. Os resultados encontrados corroboram os da literatura, que relatam que a alteração histopatológica mais expressiva radioinduzida no coração é evidenciada na forma de fibrose. Esta é constituída por uma rede de fibras colágenas que separam os cardiomiócitos individualmente ou em pequenos grupos(1,25). O estudo de Krüse et al.(6), realizado com diversas doses de radiação, evidencia que a severidade da resposta fibrogênica é dose dependente. Relata, também, aumento do RNAm do procolágeno III logo nos primeiros três meses e do procolágeno I ao longo de 12 meses no coração de ratos irradiados na região torácica com a dose única de 20 Gy. Pelo exposto, observa-se que o efeito relevante induzido pela radiação na dose empregada são as alterações nucleares e diminuição das estriações das células musculares cardíacas, e aumento da deposição do colágeno em geral, que pode levar ao processo de fibrose miocárdica e pericárdica. O colágeno III não parece ter papel relevante no processo de fibrose cardíaca radioinduzida nas condições do experimento do presente estudo. Em relação ao mecanismo ou fatores envolvidos no aumento do colágeno após irradiação, a proteína TGFb1 parece exercer relevante papel(16). Os resultados encontrados demonstraram que a imunoexpressão da proteína TGFb1 latente ocorreu com forte intensidade nos cardiomiócitos e no tecido conjuntivo dos corações não irradiados. A proteína TGFb1 ativa também foi detectada nos cardiomiócitos dos corações não irradiados, sendo que no tecido conjuntivo apresentou fraca imunopositividade. Estes achados nas células e estruturas do coração diferem daqueles encontrados em outros tecidos como as células alveolares do pulmão(20) e em megacariócitos da medula óssea(19). Nestas células, a TGFb1 ativa não foi detectada em condições fisiológicas por imuno-histoquímica. Diferentes padrões de expressão para as diferentes isoformas da proteína também foram observadas em outros tipos de células(31). Talvez estes achados estejam relacionados ao controle fisiológico de proliferação e diferenciação das células cardíacas pela proteína TGFb1. Após irradiação, ocorreram áreas cardíacas mais extensas com cardiomiócitos fortemente imunopositivos para a proteína TGFb1 ativa em 1, 14, 30 e 90 dias, quando comparados aos controles. O tecido conjuntivo que apresentava fraca imunorreatividade para esta proteína nos animais controles também apresentou forte imunoexpressão da TGFb1 ativa aos 30 e mais evidente aos 90 dias depois da irradiação. Ambos os tipos celulares (cardiomiócitos e células do conjuntivo) apresentaram diminuição da imunorreatividade para a proteína TGFb1 latente após irradiação. Porém, para os cardiomiócitos, esta diminuição foi detectada nos períodos de 14, 30 e 90 dias, e para as células do conjuntivo, a diminuição da imunoexpressão da proteína TGFb1 latente foi observada em todos os períodos de tempo estudados. No caso dos cardiomiócitos, é possível que um dia depois da irradiação tenha ocorrido apenas uma discreta diminuição desta proteína, que não foi possível visibilizar por imuno-histoquímica. Em relação às células do tecido conjuntivo, o fato de ter havido diminuição da imunoexpressão da proteína TGFb1 latente em todos os períodos de tempo após irradiação e o aumento da imunoexpressão da proteína TGFb1 ativa ter sido detectada apenas aos 30 e 90 dias, é possível que nos períodos iniciais de 1 e 14 dias depois da irradiação já tenha ocorrido ativação da proteína TGFb1, porém de forma discreta, e a baixa concentração da proteína não permitiu sua detecção por imuno-histoquímica. Estes resultados, no entanto, sugerem ativação in situ da proteína TGFb1. A ativação da proteína TGFb1 foi observada em horas e dias depois da irradiação em glândula mamária(17,32) aos 10 e 30 dias depois da irradiação em megacariócitos in vivo(19) e em 14 dias depois da irradiação em células alveolares pulmonares(20). Sugere-se que a ativação precoce seria conseqüente ao "stress" oxidativo induzido pelos radicais livres produzidos pela radiação, e a elevação continuada e tardia da proteína, devida a mecanismos celulares via plasmina. A plasmina é uma protease que ativa a proteína TGFb1 latente in vivo. A indução do ativador do plasminogênio tecidual (tPA) e do inibidor do ativador do plasminogênio (PAI) foi demonstrada em vários tecidos após irradiação(33). Demonstrou-se, também, aumento da ativação da proteína TGFb1 latente pelo tPA, pelo ativador do plasminogênio tipo uroquinase e pelo plasminogênio após irradiação(34). No que se refere à ativação da proteína TGFb1 latente observada em 1, 14, 30 e 90 dias nos cardiomiócitos e a evidente ativação detectada aos 30 e 90 dias nas células do tecido conjuntivo sugerem a importância da via celular de ativação da TGFb1 latente no coração. Porém, o papel da ativação desta proteína induzida pelos radicais livres, que apresentam meia vida curta, não foi verificado no presente experimento, uma vez que o período mais precoce estudado foi o de um dia após irradiação. Talvez ambos os mecanismos possam ser importantes para a ativação da proteína TGFb1 latente no coração irradiado. Os achados do presente trabalho evidenciaram elevação da proteína TGFb1 em células do coração irradiado e corroboram aqueles de outros autores(6,35). No entanto, esses trabalhos não estudaram especificamente a ativação in situ da proteína TGFb1 no coração. O esclarecimento desses aspectos é relevante, especialmente quando se deseja prevenir o desenvolvimento da fibrose cardíaca radioinduzida. Uma possibilidade é o uso de drogas antioxidantes. A literatura mostra que o aumento da oxidação intracelular induzido pela TGFb1 é abolido com o uso de drogas antioxidantes(36). É também relatado na literatura que a amifostina inibe a transdução da sinalização da proteína TGFb1 em megacariócitos irradiados in vivo(19). Em conclusão, analisados em conjunto, os resultados mostraram alterações morfológicas, aumento da deposição de fibras colágenas e ativação da proteína TGFb1 em coração, após irradiação. Sugerem também a importância da participação da proteína TGFb1 no processo de fibrose cardíaca radioinduzida, e que células do parênquima (cardiomiócitos) e do tecido conjuntivo podem participar deste mecanismo atuando como fontes da proteína TGFb1 ativa.
REFERÊNCIAS 1.Stewart JR, Fajardo LF. Radiation-induced heart disease: an update. Prog Cardiovasc Dis 1984;27:173-94. [ ] 2.Emami B, Lyman J, Brown A, et al. Tolerance of normal tissue to therapeutic irradiation. Int J Radiat Oncol Biol Phys 1991;21:109-22. [ ] 3.Stewart JR, Fajardo LF, Gillette SM, Constine LC. Radiation injury to the heart. Int J Radiat Oncol Biol Phys 1995;31:1205-11. [ ] 4.Cohn KE, Stewart JR, Fajardo LF, Hancock EW. Heart disease following radiation. Medicine (Baltimore) 1967;46:281-98. [ ] 5.Fajardo LF, Stewart JR. Pathogenesis of radiation-induced myocardial fibrosis. Lab Invest 1973;29:244-57. [ ] 6.Krüse JJCM, Zurcher C, Strootman EG, et al. Structural changes in the auricles of the rat heart after local ionizing irradiation. Radiother Oncol 2001;58:303-11. [ ] 7.Derynck R, Feng XH. TGF-b receptor signaling. Biochem Biophys Acta 1997;1333:F105-50. [ ] 8.Sporn MB, Roberts AB, Wakefield LM, Assoian RK. Transforming growth factor-beta: biological function and chemical structure. Science 1986;233:532-4. [ ] 9.Rubin P, Johnston CJ, Willians JP, McDonald S, Finkelstein JN. A perpetual cascade of cytokines postirradiation leads to pulmonary fibrosis. Int J Radiat Oncol Biol Phys 1995;33:99-109. [ ] 10.Ruifrok ACC, McBride WH. Growth factors: biological and clinical aspects. Int J Radiat Oncol Biol Phys 1999;43:877-81. [ ] 11.Bernstein EF, Harisiadis L, Salomon G. Transforming growth factor b improves healing of radiation-impaired wounds. J Invest Dermatol 1991;97:430-4. [ ] 12.Bernstein EF, Sullivan FJ, Mitchell JB, Salomon GD, Glatstein E. Biology of chronic radiation effect on tissues and wound healing. Clin Plast Surg 1993;20:435-53. [ ] 13.Roberts AB, Sporn MB. The transforming growth factor bs. In: Sporn MB, Roberts AB, eds. Peptide growth factors and their receptors. New York, NY: Springer-Verlag, 1991:419-72. [ ] 14.O'Malley Y, Zhao W, Barcellos-Hoff MH, Robbins MEC. Radiation-induced alterations in rat mesangial cell Tgfb1 and Tgfb3 gene expression are not associated with altered secretion of active Tgfb isoforms. Radiat Res 1999;152:622-8. [ ] 15.Miyazono K, Hellman U, Wernsted C, Heldin CH. Latent high molecular weight complex of transforming growth factor b1: purification from human platelets and structural characterization. J Biol Chem 1988;263:6407-15. [ ] 16.Barnard JA, Lyons RM, Moses HL. The cell biology of transforming growth factor b. Biochem Biophys Acta 1990;1032:79-87. [ ] 17.Barcellos-Hoff MH, Derynck R, Tsang MLS, Weatherbee JA. Transforming growth factor b-activation in irradiated murine mammary gland. J Clin Invest 1994;93:892-9. [ ] 18.Lyons RM, Moses HL. Transforming growth factors and the regulation of cell proliferation. Eur J Biochem 1990;187:467-73. [ ] 19.Segreto HRC, Ferreira AT, Kimura ET, et al. Amifostine does not prevent activation of TGFb1 but induces smad 7 activation in megakaryocytes irradiated in vivo. Am J Hematol 2002;71:300-9. [ ] 20.Mattos MD, Kimura ET, Silva MRR, Egami MI, Segreto RA, Segreto HRC. Ativação da proteína TGFb latente em pulmão irradiado in vivo. Rev Assoc Med Bras 2002;48:329-34. [ ] 21.Weibel ER. Principles and methods for the morphometric study of the lung and other organs. Lab Invest 1963;12:131-55. [ ] 22.Siegel S. Estadistica no paramétrica. México: Trillas, 1975. [ ] 23.Fajardo LF, Stewart JR. Experimental radiation-induced heart disease. I. Light microscopic studies. Am J Pathol 1970;59:299-316. [ ] 24.Fajardo LF. Radiation-induced coronary artery disease. Chest 1977;71:563-4. [ ] 25.Fajardo LF. Pathology of radiation injury. New York: Masson, 1982. [ ] 26.Lauk S. Endothelial alkaline phosphatase activity loss as an early stage in the development of radiation induced heart disease in rats. Radiat Res 1987;110:118-28. [ ] 27.Corn BW, Trock BJ, Goodman RL. Irradiation-related ischemic heart disease. J Clin Oncol 1990;8:741-50. [ ] 28.Gillette EL, McChesney SL, Hoopes PJ. Isoeffect curves for radiation-induced cardiomyopathy in the dog. Int J Radiat Oncol Biol Phys 1985;11:2091-7. [ ] 29.Junqueira LCU, Bignolas G, Brentani RR. Picrosirius staining plus polarization microscopy: a specific method for collagen detection in tissue sections. Histochem J 1979;11:447-55. [ ] 30.Piguet PF, Rosen H, Vesin C, Grau GE. Effective treatment of the pulmonary fibrosis elicited in mice by bleomicyn or silica with anti-CD-11 antibodies. Am Rev Respir Dis 1993;147:435-41. [ ] 31.Pelton RW, Saxena B, Jones M, Moses HL, Gold LI. Immunohistochemical localization of TGFb1, TGFb2, and TGFb3 in the mouse embryo: expression patterns suggest multiple roles during embryonic development. J Cell Biol 1991;115:1091-105. [ ] 32.Ehrhart EJ, Segarini P, Tsang MLS, Carroll AG, Barcellos-Hoff MH. Latent transforming growth fator b1 activation in situ: quantitative and functional evidence after low-dose gama-irradiation. FASEB J 1997;11:991-1003. [ ] 33.Fukunaga N, Burrows HL, Meyers M, Schea RA, Boothman DA. Enhanced induction of tissue-type plasminogen activator in normal human cells compared to cancer-prone cells following ionizing radiation. Int J Radiat Oncol Biol Phys 1992;24:949-57. [ ] 34.Flaumenhaft R, Abe M, Mignatti P, Rifkin DB. Basic fibroblast growth factor induced activation of latent transforming growth factor b in endothelial cells: regulation of plasminogen activator activity. J Cell Biol 1992;118:901-9. [ ] 35.Moulin V. Growth factors in skin wound healing. Eur J Cell Biol 1995;68:1-7. [ ] 36.Ohba M, Shibanuma M, Kuroki T, Nose K. Production of hydrogen peroxide by transforming growth factor b1 and its involvement in induction of egr-1 in mouse osteoblastic cells. J Cell Biol 1994;126:1079-88. [ ]
Recebido para publicação em 26/11/2002. Aceito, após revisão, em 14/7/2003.
* Trabalho baseado em Tese de Mestrado realizada no Laboratório de Radioterapia Experimental Prof. Dr. Camillo Segreto - Setor de Radioterapia do Departamento de Medicina da Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554