Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 38 nº 6 - Nov. / Dez. of 2005
Vol. 38 nº 6 - Nov. / Dez. of 2005
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Emerson L. Gasparetto, Sergio E. Ono, Dante L. Escuissato, Carolina A. Souza, Gabriela de Melo Rocha, Cezar Inoue, João M. Falavigna, Edson Marchiori |
|
|
Descritores: Tomografia computadorizada de alta resolução, Transplante de medula óssea, Infecções pulmonares |
|
|
Resumo: IIIAcadêmicos de Medicina da UFPR
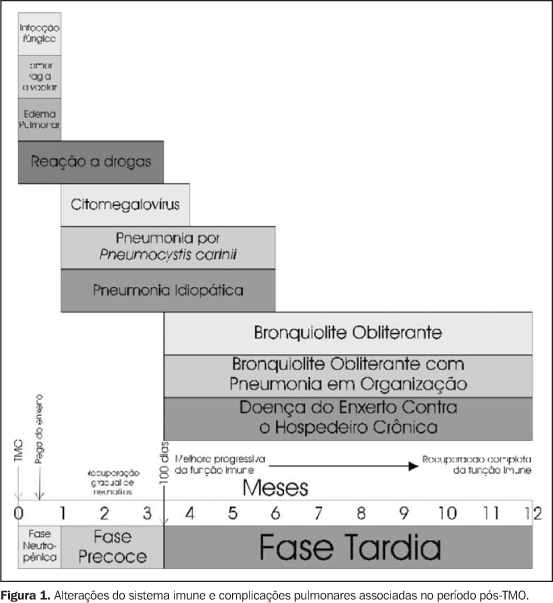
INTRODUÇÃO O transplante de medula óssea (TMO) consiste na infusão intravenosa de células progenitoras hematopoiéticas para restabelecer a função da medula óssea, sendo que este procedimento tem seu papel definido no tratamento de doenças hematológicas. As principais complicações do TMO são a doença do enxerto contra hospedeiro (DECH) aguda ou crônica, a rejeição e as complicações pulmonares. As complicações pulmonares ocorrem em 40% a 60% dos pacientes submetidos ao TMO(1,2) e estão associadas a morbidade e mortalidade significativas. A tomografia computadorizada de alta resolução (TCAR) é um excelente método para detecção de anormalidades pulmonares, porém deve ser ressaltado que os achados vistos na TCAR em geral são inespecíficos e necessitam de correlação clínica e temporal, baseada no estado imunológico do paciente(3). Neste estudo serão discutidas e ilustradas as TCAR das principais complicações pulmonares que ocorrem em pacientes submetidos a TMO. O período pós-TMO é dividido em três fases (Figura 1):
– A primeira fase, também conhecida como neutropênica, compreende as três primeiras semanas pós-TMO e é caracterizada por infecções fúngicas, hemorragias alveolares, edema pulmonar e reações a drogas; – a segunda fase, ou fase precoce, compreende o período entre a terceira semana e o 100º dia pós-TMO, sendo comum nesta fase as infecções por citomegalovírus (CMV) e vírus sincicial respiratório (VSR); – a terceira fase, ou fase tardia (após 100 dias pós-TMO), é caracterizada pela ocorrência de bronquiolite obliterante com pneumonia em organização (BOOP) e DECH crônica(2–4).
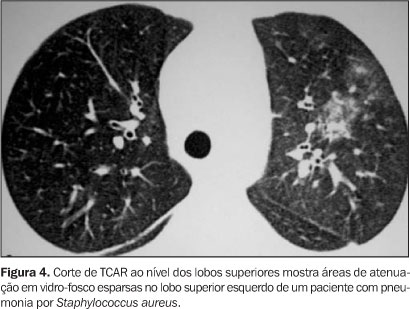
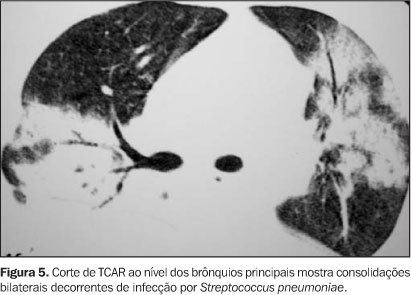
FASE NEUTROPÊNICA Na fase imediatamente após o transplante há um período de neutropenia profunda que dura de duas a três semanas. As complicações pulmonares são predominantemente infecções fúngicas (mais comumente a aspergilose angioinvasiva), hemorragia alveolar difusa, edema pulmonar e toxicidade a drogas(3). Infecções fúngicas Os fungos são causa comum de pneumonia em pacientes pós-TMO, com incidência entre 12% e 45%. O Aspergillus sp. é o fungo mais isolado no período pós-TMO, sendo causa de pneumonia em até 20% dos pacientes(2). Aspergilose invasiva Os fatores de risco desta infecção incluem granulocitopenia prolongada, uso de antibióticos de amplo espectro, lesão de mucosa e tratamento com corticosteróides. O diagnóstico pode ser feito por culturas positivas de tecido pulmonar obtido por biópsia percutânea, biópsia a céu aberto ou por autópsia. Os achados radiográficos são variados, podendo ser observados infiltrações focais ou difusas, com ou sem escavações, nódulos, massas, ou a combinação de nódulos e massas(5,6). O principal achado no exame de TCAR é o de nódulo circundado por atenuação em vidro-fosco, conhecido como o sinal do halo(3). A escavação do nódulo ocorre na fase de recuperação da neutropenia e aparece como o sinal do crescente aéreo. Pode ainda haver áreas de consolidação segmentar causadas por infarto pulmonar, devido à invasão vascular. A invasão de vias aéreas ocorre em 30% dos casos(7), e anormalidades à TCAR incluem nódulos centrolobulares ou peribroncovasculares (Figuras 2 e 3). Infecções bacterianas São complicações comuns, ocorrendo em 20% a 50% dos pacientes, e correlacionam-se com o período de granulocitopenia antes da pega do enxerto. O grupo predominante é o de bactérias Gram-negativas, provenientes do trato gastrintestinal ou da mucosa oral(2). O diagnóstico pode ser definido a partir de culturas do lavado broncoalveolar (LBA). Os achados radiográficos e de TCAR não diferem daqueles observados em pacientes imunocompetentes com pneumonia bacteriana. A TCAR é útil no diagnóstico precoce desta infecção, quando as radiografias ainda são normais. Nesta fase a TCAR pode demonstrar áreas de atenuação em vidro-fosco, sugerindo o diagnóstico e a instituição terapêutica precoces (Figuras 4 e 5).
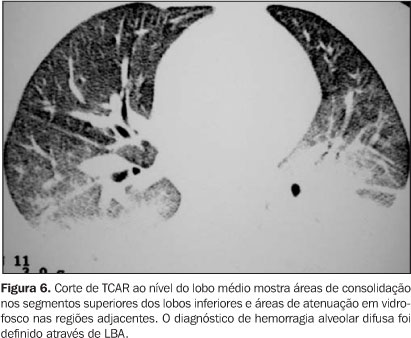
Hemorragia alveolar difusa (HAD) A HAD ocorre em até 20% dos pacientes submetidos a TMO autólogo, e é diagnosticada entre o 7º e 40º dias pós-TMO (média D+12). É caracterizada por estabelecimento súbito de dispnéia progressiva, tosse não produtiva, febre e hipoxemia(2). O LBA define o diagnóstico, evidenciando macrófagos contendo hemossiderina. As radiografias de tórax demonstram consolidação difusa, geralmente envolvendo mais de um lobo. Os achados mais comuns na TCAR são áreas de atenuação em vidro-fosco bilaterais e consolidações(3) (Figura 6).
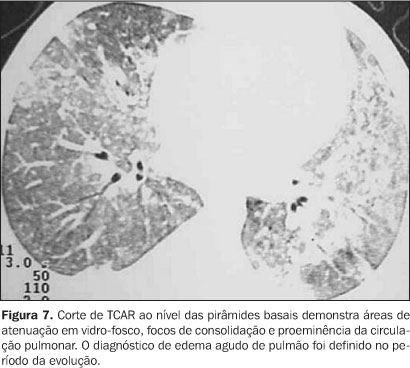
Edema pulmonar O edema pulmonar em geral ocorre na segunda ou terceira semana pós-TMO. Esta alteração resulta da infusão de grandes quantidades de fluidos para administração de drogas, produtos sanguíneos e nutrição parenteral total, combinada a disfunções cardíaca e renal, secundárias a quimioterapia e imunossupressão prévias(2). As anormalidades na radiografia de tórax incluem redistribuição vascular e aumento difuso da trama intersticial. As TCAR mostram vasos pulmonares proeminentes, espessamento de septos interlobulares, áreas de atenuação em vidro-fosco e derrame pleural(3) (Figura 7).
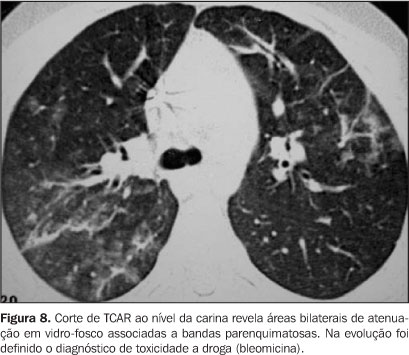
Toxicidade a drogas Complicações pulmonares relacionadas a drogas citotóxicas são freqüentes e podem ser potencializadas pela irradiação do parênquima pulmonar nos pacientes submetidos à irradiação corporal total no período pré-TMO. As principais drogas implicadas nesta complicação são bleomicina, bussulfan e metotrexate. Os achados na TCAR são variados e inespecíficos, incluindo áreas de atenuação em vidro-fosco(7), consolidações, ou em estágios mais tardios, áreas de infiltração intersticial reticular (Figura 8).
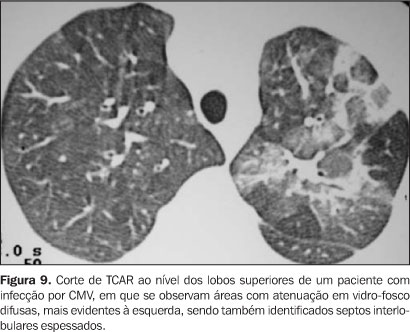
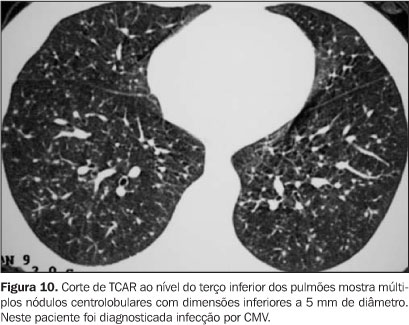
FASE PRECOCE A próxima fase vai do dia 21 até os 100 dias pós-TMO, quando ocorre recuperação gradual dos neutrófilos e do sistema imune. Nesta fase predominam as infecções virais, sendo o CMV e o VSR os vírus com maior freqüência diagnosticados. Pneumonia por CMV A infecção pelo CMV ocorre em até 70% dos pacientes submetidos a TMO, sendo que um terço destes desenvolve pneumonia. Os sintomas iniciam entre 6 e 12 semanas pós-TMO(7). As características clínicas da pneumonia por CMV são febre, tosse não produtiva, dispnéia e hipoxemia. O diagnóstico pode ser feito por imunofluorescência indireta aplicada ao LBA. O diagnóstico histológico é confirmado pelo achado de macrófagos pulmonares contendo inclusões intranucleares típicas. Os achados radiográficos incluem infiltração intersticial difusa, opacidades parenquimatosas e a presença de inúmeros pequenos nódulos. O aspecto mais comum na TCAR são pequenos nódulos associados a áreas de consolidação ou de atenuação em vidro-fosco(3,8) (Figuras 9 e 10).
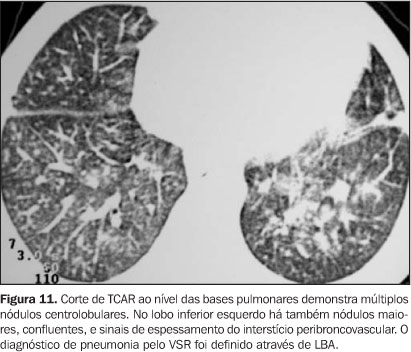
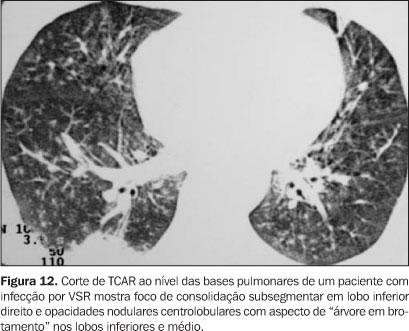
Vírus sincicial respiratório Estudos recentes têm mostrado que vírus respiratórios da comunidade, como o VSR, influenza vírus, parainfluenza vírus, adenovírus e picornavírus têm papel importante na etiologia de doenças respiratórias no pós-TMO(4). Clinicamente, estes pacientes se apresentam com quadro de infecção das vias aéreas superiores, sendo que até 50% dos pacientes desenvolvem pneumonia na evolução. A incidência é maior no primeiro mês pós-TMO. Há poucos trabalhos na literatura que descrevem os achados radiográficos em pacientes submetidos a TMO. Até 20% dos pacientes com pneumonia pelo VSR apresentam TCAR normal. Naqueles casos com alterações, os principais achados são pequenos nódulos centrolobulares, áreas de consolidação, opacidades em vidro-fosco, espessamento de paredes brônquicas e opacidades em árvore em brotamento (Figuras 11 e 12).
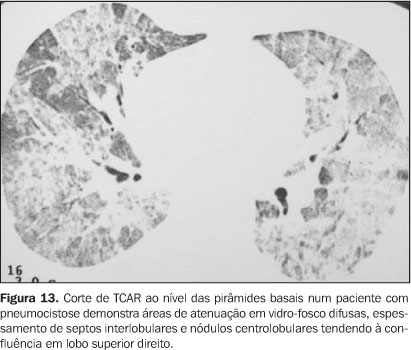
Pneumonia por Pneumocystis carinii (PPC) A incidência de PPC tem diminuído com a instituição de profilaxia de rotina (trimetoprim/sulfametoxazol). Atualmente, a PPC é vista em menos de 10% dos pacientes submetidos a TMO, geralmente naqueles que não toleram a profilaxia(2). O tempo médio de estabelecimento da doença é de dois meses pós-TMO. O Pneumocystis carinii pode ser diagnosticado quando a forma cística do organismo é identificada no LBA ou em biópsia com coloração de Grocott-Gomori. As radiografias de tórax demonstram opacidades peri-hilares ou nos lobos superiores. As TCAR mostram áreas de atenuação em vidro-fosco, que podem ser difusas ou predominarem nas regiões peri-hilares ou em lobos superiores. Outro padrão descrito é a presença de um padrão em mosaico, poupando lóbulos pulmonares secundários adjacentes(3,7) (Figura 13).
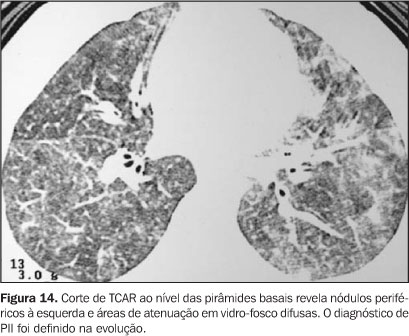
Pneumonia intersticial idiopática (PII) A PII ocorre em cerca de 12% dos pacientes submetidos a TMO, sendo definida como lesão pulmonar difusa que se manifesta na ausência de qualquer infecção, entre 40 e 50 dias após o TMO. É essencialmente um diagnóstico de exclusão. A causa parece estar relacionada à toxicidade durante o preparo pré-transplante(2). Os principais achados radiográficos e tomográficos são opacidades alveolares difusas ou multifocais, opacidades reticulares, espessamento de septos interlobulares e nódulos de vários tamanhos (Figura 14).
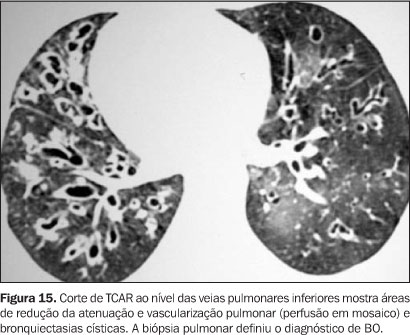
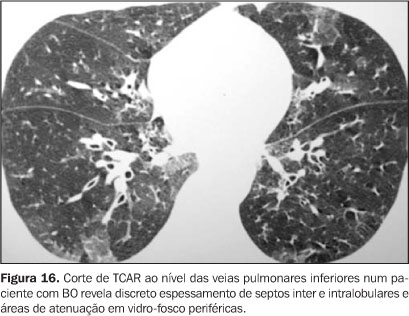
FASE TARDIA Ocorre em um período após o 100º dia pós-transplante, em que a função imune recuperou-se em grande parte, e as complicações são do tipo não infecciosas. Complicações pulmonares infecciosas ocorrem nesta fase quando os pacientes apresentam DECH ou falha na pega do enxerto. Bronquiolite obliterante (BO) Ocorre em até 10% dos pacientes pós-TMO(7), sendo rara em pacientes submetidos a TMO autólogo. Clinicamente desenvolve-se após o terceiro mês pós-TMO e os sintomas iniciais lembram infecção de via aérea superior. A etiologia é incerta e pacientes com DECH têm risco aumentado. Observa-se deterioração gradual das provas de função pulmonar e o diagnóstico é baseado na clínica e nestes exames. O diagnóstico é confirmado histologicamente nas amostras de biópsia de tecido pulmonar(2). Nas radiografias de tórax observa-se hiperinsuflação pulmonar na ausência de infiltrações. A TCAR revela dilatação brônquica e padrão de perfusão em mosaico, com evidência de aprisionamento de ar nos cortes em expiração(3,7) (Figuras 15 e 16).
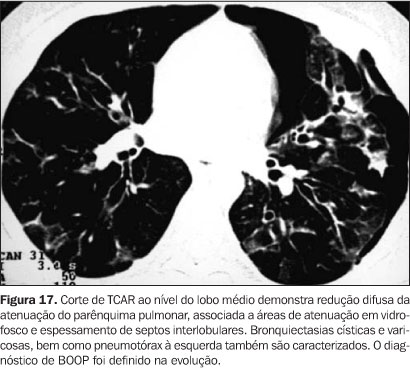
Bronquiolite obliterante com pneumonia em organização A BOOP é uma complicação tardia em pacientes pós-TMO. As manifestações clínicas incluem tosse não produtiva, dispnéia e febre. Os achados à TCAR incluem consolidações com distribuição subpleural ou peribrônquica, áreas de atenuação em vidro-fosco e pequenos nódulos. Os nódulos e as áreas de atenuação em vidro-fosco tendem a ser distribuídos aleatoriamente, e os nódulos em geral têm margens bem definidas(3,7) (Figura 17).
Doença do enxerto contra o hospedeiro crônica A DECH crônica resulta de uma reação imune de células doadoras imunocompetentes contra tecido de hospedeiro imunodeprimido. Ocorre em até 50% dos pacientes que sobrevivem seis meses ou mais após o TMO(7). Não tem manifestação pulmonar específica, sendo que as lesões pulmonares nestes pacientes são secundárias às alterações no sistema imune e incluem infecções por bactérias capsuladas, Aspergillus e Pneumocystis carinii, aspiração crônica, BO e pneumonia intersticial linfóide.
CONCLUSÃO A TCAR é um excelente método para avaliação do parênquima pulmonar e pode ser útil no diagnóstico de doenças respiratórias em pacientes submetidos a TMO. Ressalte-se que os achados são isoladamente inespecíficos, porém, quando correlacionados com a clínica e a fase em que a anormalidade pulmonar ocorre, diminui-se a lista de diagnósticos diferenciais. A TCAR é ferramenta adicional no auxílio da definição diagnóstica em um momento em que o quadro clínico do paciente pode deteriorar-se rapidamente, sendo necessária à instituição de terapêutica imediata.
REFERÊNCIAS 1. Krowka MJ, Rosenow EC III, Hoagland HC. Pulmonary complications of bone marrow transplantation. Chest 1985;87:237–246. [ ] 2. Soubani AO, Miller KB, Hassoun PM. Pulmonary complications of bone marrow transplantation. Chest 1996;109:1066–1077. [ ] 3. Worthy SA, Flint JD, Müller NL. Pulmonary complications after bone marrow transplantation: high-resolution CT and pathologic findings. RadioGraphics 1997;17:1359–1371. [ ] 4. Whimbey E, Champlin RE, Couch RB, et al. Community respiratory virus infections among hospitalized adult bone marrow transplant recipients. Clin Infect Dis 1996;22:778–782. [ ] 5. Leung AN, Gosselin MV, Napper CH, et al. Pulmonary infections after bone marrow transplantation: clinical and radiographic findings. Radiology 1999;210:699–710. [ ] 6. Mori M, Galvin JR, Barloon TJ, Gingrich RD, Stanford W. Fungal pulmonary infections after bone marrow transplantation: evaluation with radiography and CT. Radiology 1991;178:721–726. [ ] 7. Wah TM, Moss HA, Robertson RJH, Barnard DL. Pulmonary complications following bone marrow transplantation. Br J Radiol 2003;76:373–379. [ ] 8. Kang EY, Patz EF Jr, Müller NL. Cytomegalovirus pneumonia in transplant patients: CT findings. J Comput Assist Tomogr 1996;20:295–299. [ ]
Recebido para publicação em 28/10/2004. Aceito, após revisão, em 15/12/2004.
* Trabalho realizado na Disciplina de Radiologia Médica do Departamento de Clínica Médica da Universidade Federal do Paraná (UFPR), Curitiba, PR. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554