Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 38 nº 5 - Set. / Out. of 2005
Vol. 38 nº 5 - Set. / Out. of 2005
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Fabrício M. Tuji, Solange M. Almeida, Frab Norberto Bóscolo, Flávio Ricardo Manzi |
|
|
Descritores: Radiação ionizante, Selênio, Radicais livres |
|
|
Resumo: IIIProfessor Titular da Disciplina de Radiologia Odontológica da FOP-Unicamp
INTRODUÇÃO A produção de radicais livres constitui um dos fatores decorrentes da interação da radiação com a matéria. Quando a radiação interage com a água, por exemplo, ocorre a formação de radicais hidroxil (OH), prótons (H+) e, principalmente, peróxido de hidrogênio (H2O2), causando danos às estruturas celulares, como o DNA, enzimas e constituintes da membrana(1?4), culminando em efeitos deletérios ao organismo. Após a realização do primeiro estudo sobre radioproteção in vivo, por Patt et al.(5), em 1949, em que se administrou cisteína previamente a uma dose letal de radiação, diversas substâncias químicas têm sido estudadas. Embora o mecanismo de ação das substâncias radioprotetoras ainda não seja claro, alguns autores citam que sua ação é decorrente de ligação química realizada entre certas enzimas ativadas por estas substâncias e os radicais livres produzidos pela radiação(1,6?9). A administração de sais de selênio, como o selenito de sódio, tem aumentado a sobrevida de ratos expostos a doses letais de radiação X. Uma das explicações para este fato é o mecanismo antioxidante do selênio, que aumenta o nível da atividade da enzima glutationa peroxidase(10?16). Já foi demonstrado que a radiação ionizante afeta desfavoravelmente o processo de cicatrização de feridas induzidas(5,17,18), mesmo quando administrada em baixas doses(19?21), mostrando que o tecido de granulação de feridas expostas à radiação ionizante apresenta uma menor produção de moléculas de glicosaminoglicanas, inibição no início da hidroxilação da prolina e na redução da quantidade de colágeno depositado, além de diminuir a resistência do tecido à tensão. Visto que a radiação ionizante interfere no processo de reparação tecidual, retardando-o, esta pesquisa tem como objetivo avaliar o efeito do selenito de sódio como radioprotetor no processo de reparação tecidual de feridas de ratos.
MATERIAIS E MÉTODOS Foram utilizados, para a presente pesquisa, 50 ratos machos de mesma linhagem (Rattus norvegicus albinus, Wistar), com idade entre 60 e 90 dias e peso variando entre 150 e 300 gramas. Todos os animais foram submetidos a procedimento cirúrgico, sendo produzida uma ferida de 2,0 cm x 1,5 cm na região dorsal anterior de cada animal. Após este procedimento, a amostra foi dividida, aleatoriamente, em quatro grupos experimentais: controle, selênio, irradiado e selênio-irradiado. Nos animais do grupo controle foi realizada somente a cirurgia. Nos animais dos grupos selênio e selênio-irradiado foram administrados, intraperitonealmente, 48 horas após a cirurgia, solução de selenito de sódio contendo 2,0 mg de Na2SeO3/kg b.w (Vetek) diluído em água destilada. Já os animais pertencentes aos grupos irradiado e selênio-irradiado 72 horas após a cirurgia tiveram 1,0 cm, lateralmente à cada borda da ferida, exposto a 6,0 Gy de radiação com elétrons. Para caracterizar irradiação local, todo o restante do animal, incluindo o centro da ferida produzida, foram protegidos por uma lâmina de chumbo de 4,0 mm de espessura. A irradiação foi realizada com um acelerador linear, modelo Mevatron 74 (Siemens) com feixe de elétrons de 6 MeV e distância foco?alvo de 100 cm. Não foi utilizado superficializador de dose, tendo em vista que para a configuração do campo irradiado a dose superfície é de 96% da dose máxima a 5 mm. Para irradiar a região de interesse com a dose desejada foram realizadas medidas utilizando câmara de placas paralelas de volume sensível de 2 mm de diâmetro em um simulador de acrílico, que permitiram determinar um fator que relaciona a dose na situação do experimento com a dose no campo de calibração do aparelho (campo 10 cm x 10 cm), na profundidade de máximo de 12 mm. Após 4, 7, 13 e 21 dias, tempo previamente estabelecido para ser avaliado o processo de reparação tecidual, foram removidas as amostras teciduais, sendo constituídas por uma porção de tecido, contendo a ferida ou cicatriz no centro, circundada por tecido normal, de acordo com Manzi et al.(22). Depois de fixadas e devidamente tratadas, foram confeccionadas lâminas histológicas, sendo utilizados para a avaliação do processo de reparação tecidual os seguintes métodos: coloração por hematoxilina-eosina, para a avaliação morfológica do tecido; coloração por picro-sírius, para o exame da birrefringência dos feixes de colágeno do tecido de granulação; e reação histoquímica de metacromasia com azul de toluidina pH 4, em concentração de 0,025%, de acordo com a técnica de Lison(23), para a observação das glicosaminoglicanas. As observações morfológicas e em polarização foram realizadas em fotomicroscópio Zeiss ? Pol 01.
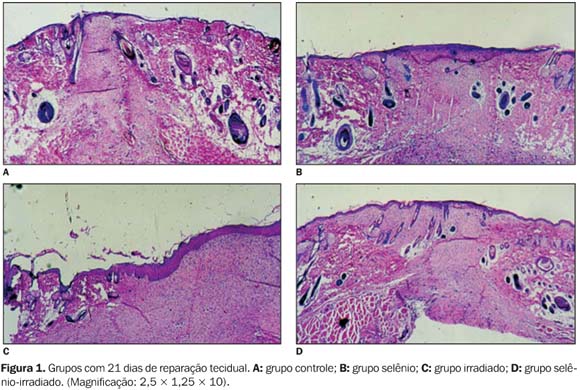
RESULTADOS Avaliação morfológica: coloração por hematoxilina-eosina Quarto dia de reparação tecidual ? Os grupos apresentaram-se bastante semelhantes em relação à evolução do processo de reparação. Uma crosta de material necrótico recobria um tecido bastante incipiente, visto que no período inicial do processo de reparo predominam os fenômenos exsudativos vasculares. Sétimo dia de reparação tecidual ? Os grupos controle, selênio e selênio-irradiado apresentavam tecido com aspecto típico de tecido de granulação, observando-se grande número de vasos neoformados e presença de fibroblastos, embora estas células se encontrassem em menor número no grupo selênio-irradiado. No grupo irradiado, predominavam células inflamatórias entre a crosta e o tecido de granulação. Décimo-terceiro dia de reparação tecidual ? O epitélio recobria a área da ferida no grupo controle. O tecido apresentava-se fibroso, com pequena quantidade de vasos neoformados. A diferença entre o grupo selênio-irradiado e o grupo irradiado tornou-se evidente, onde este apresentava a área da ferida mais extensa, ainda com a presença de tecido necrótico. O tecido de granulação encontrava-se menos fibroso, com maior quantidade de fibroblastos. Já o grupo selênio-irradiado apresentava-se semelhante aos grupos controle e selênio, com o tecido de granulação bastante fibroso, havendo pequena quantidade de fibroblastos e vasos neoformados, demonstrando o estágio avançado da maturação do tecido. Vigésimo-primeiro dia de reparação tecidual ? A área correspondente à ferida encontrava-se recoberta por epitélio nos grupos controle, selênio e selênio-irradiado. No grupo irradiado havia evidente atraso no processo de reparação tecidual, visto que o epitélio que recobria a área da ferida ainda apresentava-se espesso em relação ao epitélio do tecido normal. Embora o tecido de granulação estivesse ausente em todos os grupos, algumas alterações eram evidentes no grupo irradiado, como a presença de grande número de fibroblastos (Figura 1).
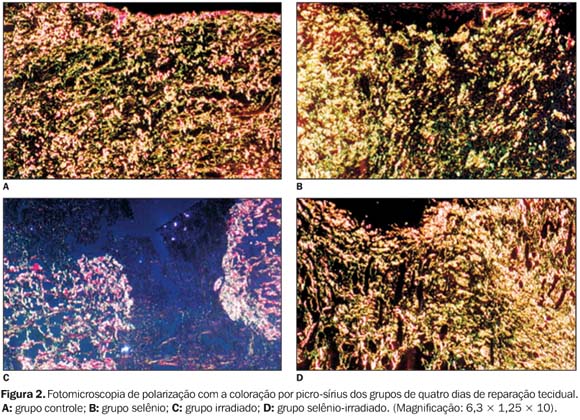
Aspectos quantitativos Exame da birrefringência pela técnica do picro-sírius ? A birrefringência de forma avalia a organização macromolecular do tecido, através da orientação das moléculas de colágeno. Esta é representada pelo brilho do tecido ao ser examinado no microscópio de polarização. Assim, quanto mais organizado e mais maduro o tecido, mais brilhante este se apresenta. Os grupos controle, selênio e selênio-irradiado apresentaram padrão semelhante em relação ao surgimento da birrefringência dos tecidos, indicando que o tecido nesses grupos atingiu maturação e orientação macromolecular antes que o grupo irradiado em todos os períodos avaliados, o que permite evidenciar o atraso na reparação do grupo irradiado e a radioproteção no grupo selênio-irradiado (Figura 2).
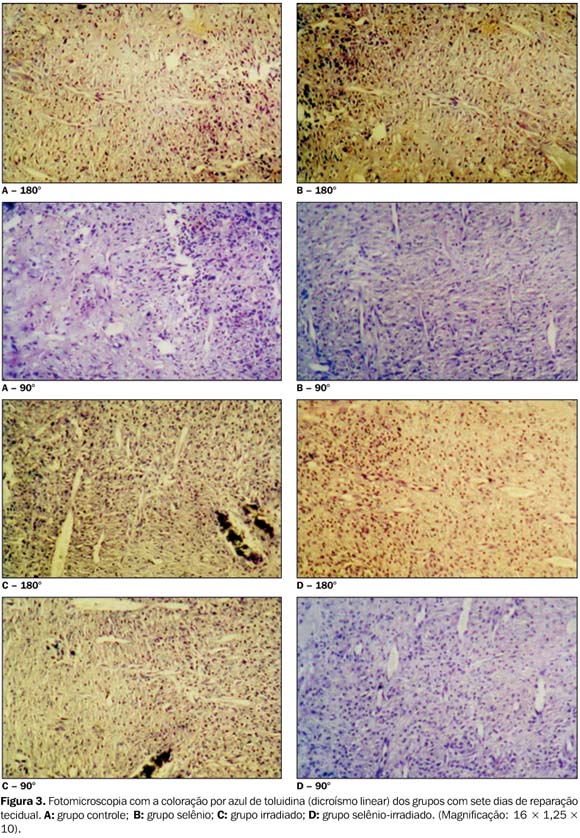
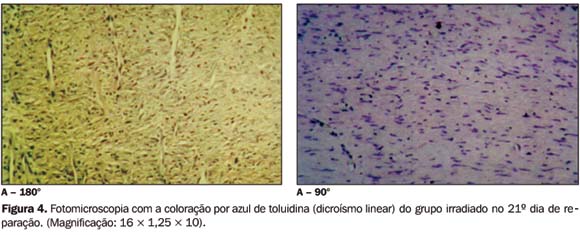
Exame do dicroísmo linear pelo azul de toluidina ? Dicroísmo é a propriedade que uma substância tem de, ao ser observada ao microscópio de polarização, exibir duas cores quando corada com um único corante metacromático, como o azul de toluidina. O tecido corado e analisado ao microscópio de polarização mostra-se azul ortocromático quando os feixes de fibras colágenas encontram-se paralelas ao plano de polarização da luz. Ao girar-se a platina do microscópio, posicionando-a paralela ao plano de polarização da luz, os feixes de fibras colágenas que apresentam organização macromolecular passam a exibir coloração rosa metacromática, indicando, portanto, a evolução do tecido. O grupo controle apresentou o dicroísmo no sétimo dia de reparação, o que também foi verificado nos grupos selênio e selênio-irradiado, ou seja, estes grupos apresentaram maturação tecidual evidente a partir deste período (Figura 3). Já no grupo irradiado o fenômeno do dicroísmo foi observado somente no 21º dia de reparação tecidual (Figura 4).
DISCUSSÃO A enzima glutationa peroxidase foi primeiramente avaliada por Rotruck et al.(7), em 1973. Desde então se levantou a suspeita de que o selênio poderia ser um componente desta enzima, podendo ser esta a explicação do seu efeito radioprotetor, visto que o mecanismo primário desta enzima é a degradação do peróxido de hidrogênio nas células, mostrando ser um importante protetor dos lipídios da membrana celular contra a desintegração a partir da oxidação. Ainda em 1973, Flohe et al.(12) classificaram a enzima glutationa peroxidase como uma selenoenzima, comprovando que a deficiência do selênio leva a uma diminuição na atividade desta enzima, considerando o selênio como um componente essencial da glutationa peroxidase, o que posteriormente também foi demonstrado por outros autores(1,11,13?15). Os resultados obtidos nesta pesquisa mostraram que o grupo irradiado apresentou retardo no processo de reparação tecidual desde o quarto dia. Isto pode ter sido decorrente de uma inibição na proliferação dos fibroblastos através do uso de radiação ionizante, fato que também foi verificado por diversos autores(2,3,19?21). Em contrapartida, o grupo selênio-irradiado comportou-se semelhantemente aos grupos controle e selênio, desde o primeiro dia de avaliação (quarto dia de reparo tecidual) até o último período avaliado (21º dia do processo de reparo), sendo observado esse comportamento em todos os métodos utilizados. Isto indica que o selenito de sódio não interfere no processo de reparação tecidual, concordando com os achados de Bang e Dashti(10). Entretanto, a principal observação a ser feita é que o selênio agiu como um elemento radioprotetor no processo de reparação tecidual. Ward et al.(4) e Drake e Oishi(16) citam que o dano provocado pela radiação no processo de reparação tecidual é causado pela ionização de átomos, criando radicais livres. Por sua vez, Shimazu e Tappel(2) e Tappel(3) relacionam a ação radioprotetora do selênio à captura destes radicais, o que também é explicado por outros autores(11,13?15), que citam ser esta radioproteção decorrente de um aumento no nível da enzima glutationa peroxidase decorrente da administração do selenito de sódio. Esta enzima é classificada como antioxidante e, conseqüentemente, captura radicais livres. Entretanto, Sandström et al.(15) verificaram que embora o selênio induza a variação no nível da atividade da enzima glutationa peroxidase, não apresenta efeito na proteção contra quebra de DNA e lise celular provocada pela radiação. Outro fator que pode ter influenciado para que o grupo selênio-irradiado apresentasse a mesma evolução tecidual em relação ao grupo controle deve-se, possivelmente, à ação dessa substância no sentido de evitar a inibição da proliferação de fibroblastos causada pela radiação, o que fica caracterizada pela interação das moléculas de glicosaminoglicanas que já se encontram presentes no tecido, sendo capazes de interagir com o corante metacromático, sendo concordante com os achados de Leccia et al.(1), que explicam que a ação radioprotetora do selenito de sódio se dá nos fibroblastos. Nesta pesquisa foi possível avaliar a reparação tecidual no seu aspecto estrutural e morfológico, através da qualidade e da maturação do tecido, observando-se um retardo provocado pela irradiação. Todavia, o retardo no processo de reparação tecidual de feridas irradiadas foi evitado quando foi administrado selenito de sódio nos animais, indicando que o selenito de sódio exerceu uma ação radioprotetora no processo de reparação tecidual.
Agradecimentos À Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), pela concessão da bolsa de mestrado nº 99/03146-7, para o desenvolvimento desta pesquisa. Ao físico José Renato de Oliveira Rocha, do Centro de Engenharia Biomédicas da Unicamp, pelo auxílio no processo de irradiação dos animais utilizados nesta pesquisa.
REFERÊNCIAS 1. Leccia MT, Richard MJ, Beani JC, et al. Protective effect of selenium and zinc on UV ? a damage in human skin fibroblasts. Photochem Photobiol 1993;58:548?553. [ ] 2. Shimazu F, Tappel AL. Selenoamino acids: decrease of radiation damage to amino acids and proteins. Science 1964;143:369?371. [ ] 3. Tappel AL. Free-radical lipid peroxidation damage and its inhibition by vitamin E and selenium. Fed Proc 1965;24:73?78. [ ] 4. Ward JF, Evans JW, Limoli CL, Calabro-Jones PM. Radiation and hydrogen peroxide induced free radical damage to DNA. Br J Cancer Suppl 1987;6:105?129. [ ] 5. Patt HM, Tyree EB, Straube RL, Smith DE. Cysteine protection against x-irradiation. Science 1949;110:213?214. [ ] 6. Borek C. Molecular mechanisms in cancer induction and prevention. Environ Health Perspect 1993;101 (Suppl 3):237?245. [ ] 7. Rotruck JT, Pope AL, Ganther HE, et al. Selenium: biochemical role as a component of glutathione peroxidase. Science 1973;179:588?590. [ ] 8. Sandström BE, Carlsson J, Marklund SL. Selenite-induced variation in glutathione peroxidase activity of three mammalian cell lines: no effect on radiation-induced cell killing or DNA strand breakage. Radiat Res 1989;117:318?325. [ ] 9. Scott DL, Kelleher J, Losowsky MS. The influence of dietary selenium and vitamin E on glutathione peroxidase and glutathione in the rat. Biochim Biophys Acta 1977;497:218?224. [ ] 10. Bang RL, Dashti H. Keloid and hypertrophic scars: trace element alteration. Nutrition 1995;11(5 Suppl):527?531. [ ] 11. Chow CK, Tappel AL. Response of glutatione peroxidase to dietary selenium in rats. J Nutr 1974;104:444?451. [ ] 12. Flohe L, Gunzler WA, Schock HH. Glutathione peroxidase: a selenoenzyme. FEBS Lett 1973;32:132?134. [ ] 13. Hafeman DG, Sunde RA, Hoekstra WG. Effect of dietary selenium on erythrocyte and liver glutathione peroxidase in the rat. J Nutr 1974;104:580?587. [ ] 14. Lawrence RA, Burk RF. Glutathione peroxidase activity in selenium-deficient rat liver. Biochem Biophys Res Commun 1976;71:952?958. [ ] 15. Sandström BE, Grankvist K, Marklund SL. Selenite-induced increase in glutathione peroxidase activity protects human cells from hydrogen peroxide-induced DNA damage, but not from damage inflicted by ionizing radiation. Int J Radiat Biol 1989;56:837?841. [ ] 16. Drake DB, Oishi SN. Wound healing considerations in chemotherapy and radiation therapy. Clin Plast Surg 1995;22:31?7. [ ] 17. Silvado RAB. Aspectos morfológicos e morfométricos da ação dos raios beta em feridas provocadas na pele de ratos. (Tese de Doutorado). São Paulo: Universidade Federal de São Paulo/Escola Paulista de Medicina, 1992. [ ] 18. Wang Q, Dickson GR, Abram WP, Carr KE. Electron irradiation slows down wound repair in rat skin: a morphological investigation. Br J Dermatol 1994;130:551?560. [ ] 19. Almeida SM. Efeito da radiação de elétrons na reparação tecidual. (Tese de Doutorado). Piracicaba: Faculdade de Odontologia de Piracicaba ? Universidade Estadual de Campinas, 1997. [ ] 20. Lourenço RL. Efeito de baixas doses de radiação X em feridas suturadas. (Tese de Mestrado). Piracicaba: Faculdade de Odontologia de Piracicaba ? Universidade Estadual de Campinas, 1998. [ ] 21. Monteiro SAC. Efeito da irradiação por elétrons em feridas e em tecidos de granulação. (Tese de Doutorado). Piracicaba: Faculdade de Odontologia de Piracicaba ? Universidade Estadual de Campinas, 1999. [ ] 22. Manzi FR, Bóscolo FN, Almeida SM, Tuji FM. Estudo morfológico do efeito redioprotetor da vitamina E (dl-alfa-tocoferil) na reparação tecidual em ratos. Radiol Bras 2003;36:367?371. [ ] 23. Lison L. Histochimie et citochimie animales: principes et méthodes. Paris: Gauthier-Villais, 1960;280. [ ]
Recebido para publicação em 24/3/2004. Aceito, após revisão, em 7/1/2005.
Endereço para correspondência: Profa. Dra. Solange M. de Almeida. Disciplina de Radiologia Odontológica, Faculdade de Odontologia de Piracicaba ? Unicamp. Avenida Limeira, 901, Areião. Piracicaba, SP, 13414-903. E-mail: solangea@fop.unicamp.br |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554