Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 38 nº 3 - Maio / Jun. of 2005
Vol. 38 nº 3 - Maio / Jun. of 2005
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Vinicius França de Mendonça, Antonio Carlos Pires Carvalho, Emilson Freitas, Edson Mendes Boasquevisque |
|
|
Descritores: Tumores, Câncer, Cavidades nasais, Tomografia computadorizada |
|
|
Resumo: IIICirurgião de Cabeça e Pescoço do INCa/MS
INTRODUÇÃO As neoplasias malignas da cabeça e pescoço são raras, constituindo apenas 3% dos casos de câncer em geral, sendo o carcinoma epidermóide o tipo histológico mais freqüente. Apesar da baixa incidência, estes tumores são clinicamente significativos, por seu prognóstico reservado(1,2). A gravidade da doença se deve ao estágio avançado no momento do diagnóstico e às dificuldades em se propor tratamento cirúrgico adequado devido à complexidade da anatomia da região, onde a proximidade da lesão com estruturas nobres, muitas vezes, limita a abordagem cirúrgica(1,3,4). O advento da tomografia computadorizada (TC) proporcionou melhor compreensão da anatomia da face, indispensável à adequada avaliação das lesões quanto às suas características e extensão, bem como no planejamento cirúrgico ou do tratamento por radioterapia(1). Objetivos Este trabalho foi realizado com o objetivo de: avaliar a freqüência dos tumores malignos das cavidades nasais; avaliar a relação topográfica das lesões com os sinais radiológicos e sintomas clínicos de sinusopatia inflamatória; determinar a freqüência dos tumores malignos de acordo com o tipo histológico; determinar a freqüência e os tipos de lesões do septo nasal associadas aos tumores; determinar a relação do volume dos tumores com o seu estadiamento clínico; avaliar a importância do uso de meio de contraste venoso para o diagnóstico diferencial e a extensão dos tumores malignos.
MATERIAIS E MÉTODOS Foram revistos os prontuários médicos e exames tomográficos de 18 pacientes — dez homens e oito mulheres — matriculados no Instituto Nacional de Câncer do Rio de Janeiro, com massa expansiva da fossa nasal e diagnóstico histopatológico por biópsia ou excisão cirúrgica. Os pacientes tinham entre 27 e 73 anos de idade (média de 47,6 anos e mediana de 47 anos). Todos os pacientes tinham pelo menos um exame de TC das cavidades sinonasais nos planos axial e coronal. A administração endovenosa do meio de contraste foi realizada em 15 dos 18 pacientes (83,3% dos casos). A cavidade nasal foi subdividida em três andares (superior, médio e inferior) por meio de linhas horizontais passando pela margem superior dos cornetos nasais médio e inferior, para se localizar anatomicamente as lesões. As lesões foram analisadas quanto ao volume, envolvimento das estruturas vizinhas, comprometimento do septo nasal e grau de impregnação pelo meio de contraste. O envolvimento do septo nasal foi classificado em erosão, fratura ou apenas envolvimento (incluindo septo intacto ou deslocado). Para o cálculo do volume foram utilizadas as maiores medidas da lesão, aplicando a fórmula matemática da elipse: 4/3 × p × L² × h, onde p = 3,14159(5). A análise estatística foi feita usando o teste do qui-quadrado, e para a análise do volume foi usado o teste t de Student (não pareado), considerando-se p < 0,05.
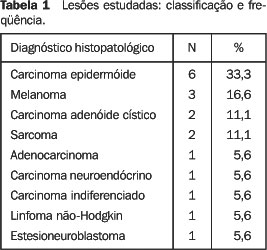
RESULTADOS Dos 18 pacientes estudados, houve pequeno predomínio do sexo masculino (55,5%), sem significado estatístico, e a faixa etária variou da terceira à oitava décadas de vida, com maior freqüência na quinta e sexta décadas. A amostra consistiu de seis casos de carcinomas epidermóides, três de melanomas, dois de carcinomas adenóides císticos, um de adenocarcinoma polimórfico de baixo grau, um de carcinoma indiferenciado, um de carcinoma neuroendócrino, um de linfoma não-Hodgkin, um de rabdomiossarcoma alveolar, um de sarcoma fusocelular grau II e um de estesioneuroblastoma (Tabela 1).
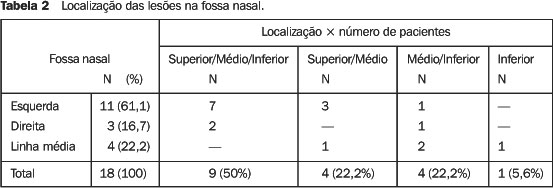
Houve predomínio dos tumores de linhagem epitelial (77,8%), sendo mais freqüente o carcinoma epidermóide (33,3%). Quanto à localização na fossa nasal, foram mais freqüentes as lesões da cavidade esquerda, constituindo 61,1% dos casos, e os demais, 16,7% eram à direita e 22,2% na linha média. Cinqüenta por cento comprometiam, simultaneamente, os andares superior, médio e inferior; 22,2%, os andares superior e médio ou médio e inferior; e somente 5,6% comprometiam apenas o andar inferior (Tabela 2).
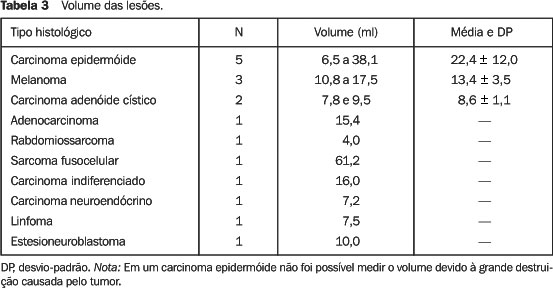
Isoladamente, os andares superior e médio não foram comprometidos, porém associados a outros compartimentos foram encontrados, respectivamente, em 72,2% e 94,4%; portanto, é no compartimento médio que mais se encontrou doença. O inferior foi envolvido em 77,8% dos casos e isoladamente em apenas 5,6%. A freqüência das lesões na cavidade nasal esquerda foi significativamente maior do que à direita (p < 0,05), porém, em relação aos andares da cavidade nasal, não houve diferença estatística (p > 0,05), exceto quanto ao inferior isoladamente. Todas as lesões da linha média foram causadas por neoplasias de origem epitelial, com o carcinoma epidermóide responsável por 75% (Figura 1) e o carcinoma adenóide cístico por 25% dos tumores nessa localização. O volume das lesões variou de 4,0 a 61,2 ml, com média de 16,5 ml e mediana de 13,8 ml (Tabela 3). O maior volume foi visto no sarcoma, seguido do carcinoma epidermóide. Não houve diferença significativa, quanto ao volume, entre os grupos de carcinoma epidermóide, melanoma e carcinoma adenóide cístico (p > 0,05). Em apenas um caso não foi medido o volume da lesão, devido à grande erosão causada pelo carcinoma epidermóide.
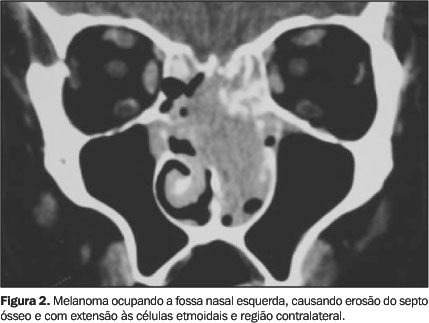
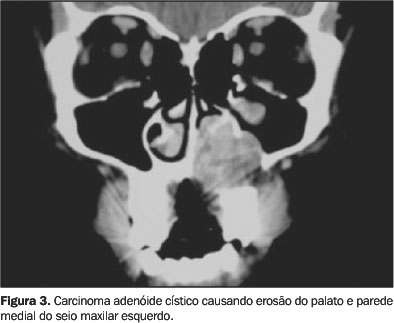
Dentre os carcinomas epidermóides, quatro apresentaram-se como processos expansivos com grau de destruição diretamente relacionado ao volume. Em 14 pacientes houve invasão das estruturas vizinhas, caracterizada por erosão das limitantes ósseas adjacentes, com extensão, principalmente, às células etmoidais (50%) (Figura 2), seguido do seio maxilar (27,8%), osso nasal (16,6%), órbita (11,1%) e maxila (11,1%) (Figura 3).
Expansão associada a remodelamento ósseo foi vista no linfoma não-Hodgkin e no estesioneuroblastoma (Figura 4A). A extensão das lesões à rinofaringe foi observada em quatro pacientes: dois carcinomas epidermóides, um sarcoma fusocelular e no estesioneuroblastoma (Figura 4A,B). Houve impregnação variável pelo meio de contraste, sendo a maioria (72,2%) semelhante à musculatura mastigatória. Destruição do septo nasal ocorreu em 72,2% dos pacientes (dez com erosão da porção óssea e três da porção cartilaginosa) (Figuras 1A,B e 2), fratura em 11,1%, e em 16,6% dos pacientes não houve alteração detectável à TC. Em 15 (83,3%) pacientes havia sinusite e obstrução dos óstios de drenagem dos seios paranasais. Calcificações foram encontradas somente no estesioneuroblastoma (Figura 4B). Apenas um paciente apresentava linfonodos cervicais positivos ao exame tomográfico (carcinoma indiferenciado). Os achados clínicos variaram conforme o tipo histológico e o volume da lesão, sendo os principais a epistaxe e a obstrução nasal, presentes em 77,8% dos pacientes.
DISCUSSÃO A maioria dos trabalhos que abordam as neoplasias da cavidade nasal engloba, na sua casuística, tumores dos seios paranasais e espaços adjacentes(4,6–8), dificultando uma análise crítica do comportamento das lesões originadas nas fossas nasais. As lesões malignas da cavidade nasal e dos seios paranasais são raras, sendo responsáveis por 3% das neoplasias em cabeça e pescoço e 0,2% a 0,8% das doenças neoplásicas em geral(2,4,9–13). Os fatores de risco são pouco conhecidos, entretanto há associação com a exposição ao pó da madeira, níquel e solventes químicos(1,4,10). A coexistência de papiloma invertido, radioterapia prévia e imunossupressão aumentam o risco de desenvolvimento do carcinoma epidermóide(1). Segundo a literatura consultada(4,10,14), tumores em fase inicial causam sintomas discretos que simulam rinossinusite crônica. Com o evoluir da doença, os sintomas tornam-se relacionados ao sítio de origem da lesão e à extensão tumoral adjacente. Neste estudo, a sinusite pode ser explicada pelo fato de a maioria das lesões se situar no andar médio e superior da cavidade nasal, obstruindo os complexos ostiomeatais. A gravidade da doença pode ser mascarada pela associação com processo inflamatório crônico, com os seguintes sintomas: obstrução nasal, anosmia, dor, epistaxe, rinorréia, entre outros(3,14–16), porém, o estágio da lesão na época do diagnóstico é preponderante na definição da sua evolução. A coexistência de metástases linfonodais indica a gravidade da doença e está presente em 34% das necropsias(1). Todavia, este não foi o achado preponderante neste estudo, possivelmente porque foram analisadas somente lesões das fossas nasais, ao contrário de outros trabalhos(4,6–8). Nos resultados do presente trabalho coexistiram processo inflamatório e neoplasia em 83,3% dos casos, e os principais sintomas relatados foram obstrução nasal e epistaxe (77,8%). Alguns autores(8,11) relatam que as neoplasias originadas na fossa nasal produzem sintomas precocemente devido à obstrução e com isso são diagnosticados em estágios menos avançados quando comparados às neoplasias das cavidades paranasais. Quanto à localização, verificou-se que a fossa nasal esquerda foi o principal sítio das lesões, bem como os andares superior, médio e inferior, responsáveis, respectivamente, por 61,1% e 50% do total de casos estudados. O andar médio foi o mais freqüentemente acometido pelos tumores, entretanto, estes achados não foram estatisticamente diferentes e deverão ser investigados mais extensivamente. A linha média foi envolvida em quatro pacientes, com tumores de origem epitelial, onde o carcinoma epidermóide foi o mais comum (75% dos casos). Segundo Hermans et al.(11), tumores com origem no vestíbulo nasal (linha média) geralmente são carcinomas epidermóides, inicialmente se mostrando como pequena úlcera ou crosta mal definida. A lesão pode se estender para o lábio superior e septo nasal, e num estágio mais avançado, invadir a cavidade oral e a maxila. Nesta série, o carcinoma epidermóide foi o tipo histológico mais freqüente em todas as localizações da fossa nasal e envolveu o andar inferior em todos os casos. Nos melanomas (três casos), as lesões envolveram somente a fossa nasal esquerda, predominando nos andares superior e médio (100% dos casos). Os tumores das glândulas salivares menores apresentaram localização variável na cavidade nasal. Na literatura consultada não há referência ao comprometimento da fossa nasal por andares, talvez devido às lesões apresentarem grandes volumes no momento do diagnóstico e muitas vezes ocupar uma cavidade nasal por completo. Dulguerov et al.(2) descreveram o carcinoma epidermóide como a neoplasia mais comumente encontrada em todas as localizações das cavidades paranasais e da fossa nasal. O envolvimento do andar superior da cavidade nasal por alguns tumores é freqüente, mas não patognomônico, e dentre esses, o carcinoma neuroendócrino, o carcinoma indiferenciado e o estesioneuroblastoma fazem parte do diagnóstico diferencial, principalmente com o carcinomas epidermóide, por ser o tipo histológico mais freqüente(1,7,14). O comprometimento do septo nasal foi estudado separadamente e na maioria dos pacientes (72,2%) havia erosão, tanto da porção óssea (dez casos) quanto da cartilaginosa do septo (três casos). Duas lesões cursaram com fratura do septo ósseo (sarcoma fusocelular e o carcinoma epidermóide pouco diferenciado). Nos demais pacientes o septo nasal estava intacto ou deslocado lateralmente, observado no estesioneuroblastoma, linfoma não-Hodgkin e um melanoma, embora este último apresentasse características agressivas à TC. A literatura consultada não faz referência ao comprometimento isolado do septo nasal. No presente estudo as alterações do septo nasal, principalmente a erosão, parecem ser uma característica dos tumores agressivos, mais comumente nos de origem epitelial, estando diretamente relacionadas com o volume no grupo dos carcinomas epidermóides. Outras alterações ósseas foram encontradas, a maioria envolvendo as células etmoidais, observadas em 50% dos pacientes, erosão da parede do seio maxilar em 27,8%, seguido do osso nasal em 16,6%, além da órbita e maxila, ambos com 11,1%. Grande parte das alterações encontradas ocorreu simultaneamente. De acordo com alguns autores(1,7,17,18), a maioria das neoplasias que comprometem as cavidades sinonasais possui comportamento agressivo, e dependendo da localização e do tipo histológico, essas neoplasias tendem a provocar diferentes graus de destruição. Nesta série, houve grande variação no volume das lesões. A maioria dos tumores apresentou-se como grandes massas ao diagnóstico inicial, porém somente no grupo dos carcinomas epidermóides o grau de destruição esteve relacionado ao volume. Não há relato na literatura sobre a relação do volume das lesões com o grau de comprometimento das estruturas limitantes das cavidades nasais, bem como do septo nasal, porém, estas alterações não parecem estar relacionadas apenas com as características histológicas, visto que, dentro de um mesmo grupo, como nos carcinomas epidermóides, observou-se maior destruição com o aumento do volume, embora este comportamento não tenha sido homogêneo em todos os grupos (p. ex.: melanomas e carcinomas adenóides císticos). O padrão de realce pelo meio de contraste não foi relevante quanto à caracterização dos tumores, porém foi importante em alguns casos para a avaliação da extensão tumoral e na diferenciação com processos inflamatórios adjacentes, aspectos já descritos por outros autores(7,11,19). Dentre as neoplasias malignas, houve predomínio dos tumores epiteliais, sendo o carcinoma epidermóide responsável por seis casos, principalmente no sexo masculino (66,6%), como visto na literatura(1,4,11, 13,17,20). A maioria cursou com osteólise, mas com diferentes graus de agressividade relacionados ao volume da lesão. A exceção foi o carcinoma pouco diferenciado. Em três casos de carcinoma epidermóide notamos o acometimento da linha média, com características de agressividade local diferentes, embora do mesmo subtipo histopatológico. Ahluwalia et al.(9) descreveram que os carcinomas epidermóides comumente envolvem a porção anterior do septo nasal, podendo apresentar-se tanto como massa ou lesão infiltrativa com ulceração ou perfuração da cartilagem septal. Estas características foram encontradas nos casos aqui estudados. Os melanomas originam-se dos melanócitos que migram da crista neural para a mucosa nasal durante o período embriológico(21–23). Segundo alguns estudos(1,21), são mais freqüentes a partir dos 60 anos de idade, sem predileção por sexo. Tendem a remodelar a estrutura óssea adjacente, podendo algumas vezes causar extensas erosões. Nesta série observou-se que os melanomas apresentaram comportamento agressivo, com osteólise pronunciada, ocorrendo em pacientes na sexta e sétima décadas de vida. Todos mostraram realce pelo meio de contraste superior aos carcinomas epidermóides(1). Tumores glandulares constituem cerca de 10% das neoplasias nasossinusais e os subtipos mais comuns são o carcinoma adenóide cístico, o adenocarcinoma e o carcinoma mucoepidermóide(1,3,24,25) . O carcinoma adenóide cístico representa 35% dos casos e envolve a cavidade nasal em 32% das vezes(1). Os sintomas são causados pelo efeito de massa do tumor e pela dor resultante da invasão perineural, freqüentemente encontrada(1,24,25). Os dois casos de carcinoma adenóide cístico eram tumores com pequeno volume, porém com comportamento agressivo causando intensa osteólise adjacente, confirmando as descrições da literatura(1,6,24). O adenocarcinoma apresentou volume maior e característica agressiva, indistinguível dos demais tumores(1). O sarcoma fusocelular foi o tumor com maior volume encontrado no estudo e com características destrutivas à TC(3). No caso do rabdomiossarcoma alveolar, apesar do pequeno volume, a lesão se comportou com extrema agressividade. Os sarcomas são neoplasias extremamente incomuns na cavidade sinonasal(26). A exceção é o rabdomiossarcoma, que representa o tumor dos tecidos moles mais comum, não só na população abaixo dos 15 anos de idade, como também nos adolescentes e adultos jovens(27), porém é infreqüente nos adultos(28). Os achados radiológicos incluem tanto remodelagem óssea como destruição(1). O carcinoma indiferenciado foi encontrado no paciente mais jovem da série e cursou com grande destruição das estruturas adjacentes. De acordo com alguns trabalhos(29,30), são tumores incomuns, localizados na porção superior da fossa nasal, geralmente com grandes volumes ao diagnóstico e características extremamente agressivas, como visto nesse caso. Como descrito na literatura(31), o carcinoma neuroendócrino apresentou-se como lesão de pequeno volume confinada a uma fossa nasal, causando erosão da parede medial do seio maxilar e envolvimento das células etmoidais. O diagnóstico diferencial dessas lesões inclui o carcinoma indiferenciado e o estesioneuroblastoma, por acometerem a porção superior da cavidade nasal(31–33). Neste estudo, os melanomas, os sarcomas, as neoplasias glandulares, o carcinoma indiferenciado e o carcinoma neuroendócrino apresentaram características radiológicas e comportamento agressivo indiferenciáveis dos tumores epidermóides, como descrito por outros autores(1,4,7). Os linfomas representam 5% dos tumores originados na cabeça e pescoço(34,35), são relativamente raros na cavidade sinonasal e predomina o tipo não-Hodgkin(3,35–40). O sexo masculino é mais acometido e o principal sintoma é a obstrução nasal(18,41). Possui tendência em remodelar as estruturas ósseas, podendo ocasionalmente causar erosão(1,42). Neste estudo o tumor apresentou característica expansiva e padrão infiltrativo, espessando o tecido celular subcutâneo da cavidade nasal. Os estesioneuroblastomas também são neoplasias raras com origem na mucosa olfatória(43,44), responsáveis por 3% a 6% dos tumores nasais(45,46). Na TC, geralmente apresentam-se como massas homogêneas que inicialmente remodelam o osso adjacente, podendo apresentar extensão às estruturas vizinhas e intracraniana(1,47,48). Podem estar presentes cistos marginais e calcificações de partes moles(1,44). No grupo estudado o linfoma e o estesioneuroblastoma cursaram com expansão e remodelamento ósseo, sem evidência de envolvimento do septo nasal e das estruturas vizinhas. Calcificações foram identificadas apenas no estesioneuroblastoma. Nesta série observou-se que a apresentação mais freqüente das lesões foi como massa de partes moles associada a osteólise das estruturas adjacentes. Apesar de a erosão óssea estar, na maioria das vezes, relacionada aos tumores malignos, principalmente nos carcinomas epidermóides, não houve características à TC que pudesse diferenciá-los de outros subtipos histológicos. O fato de não haver destruição não exclui a possibilidade de neoplasia maligna, uma vez que alguns tumores tendem a remodelar o osso(1,7,17).
CONCLUSÕES Os tumores malignos das cavidades nasais acometem mais freqüentemente os andares superior e médio, sendo o andar médio mais freqüentemente envolvido. Os sinais e sintomas clínicos de sinusite estão relacionados com a localização da lesão, que apresenta seu maior componente no andar médio, o qual também é o sitio principal de drenagem dos seios paranasais. Os tumores malignos mais freqüentes nas cavidades nasais são o carcinoma epidermóide, o melanoma e o carcinoma adenóide cístico. A erosão do septo nasal é o tipo mais comum de comprometimento do septo, relacionada principalmente com as lesões epiteliais. O volume dos tumores epiteliais está diretamente relacionado com o comprometimento das estruturas vizinhas. A maioria dos tumores da cavidade nasal apresenta realce pós-contraste venoso, semelhante à musculatura mastigatória.
REFERÊNCIAS 1.Som PM, Brandwein M. Sinonasal cavities: tumors and tumor-like conditions. In: Som PM, Curtin HD, eds. Head and neck imaging. St. Louis: Mosby-Year Book, 2003:261–373. [ ] 2.Dulguerov P, Jacobsen MS, Allal AS, Lehmann W, Calcaterra T. Nasal and paranasal sinus carcinoma: are we making progress? A series of 220 patients and a systematic review. Cancer 2001;92:3012–29. [ ] 3.Baptista AC, Marchiori E, Boasquevisque E, Cabral CEL. Comprometimento órbito-craniano por tumores malignos sinonasais: estudo por tomografia computadorizada. Radiol Bras 2002;35:89–94. [ ] 4.Weber AL, Stanton AC. Malignant tumors of the paranasal sinuses: radiologic, clinical, and histopathologic evaluation of 200 cases. Head Neck Surg 1984;6:761–76. [ ] 5.Bindlish V, Freeman JL, Witterick IJ, Asa SL. Correlation of biochemical parameters with single parathyroid adenoma weight and volume. Head Neck 2002;24:1000–3. [ ] 6.Dubois PJ, Schultz JC, Perrin RL, Dastur KJ. Tomography in expansile lesions of the nasal and paranasal sinuses. Radiology 1977;125:149–58. [ ] 7.Kondo M, Horiuchi M, Shiga H, et al. Computed tomography of malignant tumors of the nasal cavity and paranasal sinuses. Cancer 1982;50:226–31. [ ] 8.Parsons JT, Mendenhall WM, Mancuso AA, Cassisi NJ, Million RR. Malignant tumors of the nasal cavity and ethmoid and sphenoid sinuses. Int J Radiat Oncol Biol Phys 1988;14:11–22. [ ] 9.Ahluwalia H, Gupta SC, Gupta SC. Spindle-cell carcinoma of the nasal septum. Pathology in focus. J Laryngol Otol 1996;110:284–7. [ ] 10.Bush SE, Bagshaw MA. Carcinoma of the paranasal sinuses. Cancer 1982;50:154–8. [ ] 11.Hermans R, De Vuysere S, Marchal G. Squamous cell carcinoma of the sinonasal cavities. Semin Ultrasound CT MR 1999;20:150–61. [ ] 12.Katz TS, Mendenhall WM, Morris CG, Amdur RJ, Hinerman RW, Villaret DB. Malignant tumors of the nasal cavity and paranasal sinuses. Head Neck 2002;24:821–9. [ ] 13.Pothula VB, Jones HS. Verrucous squamous carcinoma of the nasal septum. J Laryngol Otol 1998; 112:172–3. [ ] 14.Bhattacharyya N. Cancer of the nasal cavity: survival and factors influencing prognosis. Arch Otolaryngol Head Neck Surg 2002;128:1079–83. [ ] 15.DiLeo MD, Miller RH, Rice JC, Butcher RB. Nasal septal squamous cell carcinoma: a chart review and meta-analysis. Laryngoscope 1996;106:1218–22. [ ] 16.Iro H, Waldfahrer F. Evaluation of the newly updated TNM classification of head and neck carcinoma with data from 3247 patients. Cancer 1998; 83:2201–7. [ ] 17.Rao VM, El-Noueam KI. Sinonasal imaging. Anatomy and pathology. Radiol Clin North Am 1998; 36:921–39. [ ] 18.Yuen A, Jacobs C. Lymphomas of the head and neck. Semin Oncol 1999;26:338–45. [ ] 19.Parsons C, Hodson N. Computed tomography of paranasal sinus tumors. Radiology 1979;132:641–5. [ ] 20.Grau C, Jakobsen MH, Harbo G, et al. Sino-nasal cancer in Denmark 1982-1991 – a nationwide survey. Acta Oncol 2001;40:19–23. [ ] 21.Brandwein MS, Rothstein A, Lawson W, Bodian C, Urken ML. Sinonasal melanoma. A clinicopathologic study of 25 cases and literature meta-analysis. Arch Otolaryngol Head Neck Surg 1997;123: 290–6. [ ] 22.Franquemont DW, Mills SE. Sinonasal malignant melanoma. A clinicopathologic and immunohistochemical study of 14 cases. Am J Clin Pathol 1991;96:689–97. [ ] 23.Lund VJ, Howard DJ, Harding L, Wei WI. Management options and survival in malignant melanoma of the sinonasal mucosa. Laryngoscope 1999;109: 208–11. [ ] 24.Sigal R, Monnet O, de Baere T, et al. Adenoid cystic carcinoma of the head and neck: evaluation with MR imaging and clinical-pathologic correlation in 27 patients. Radiology 1992;184:95–101. [ ] 25.Wiseman SM, Popat SR, Rigual NR, et al. Adenoid cystic carcinoma of the paranasal sinuses or nasal cavity: a 40-year review of 35 cases. Ear Nose Throat J 2002;81:510–7. [ ] 26.Sercarz JA, Mark RJ, Tran L, Storper I, Calcaterra TC. Sarcomas of the nasal cavity and paranasal sinuses. Ann Otol Rhinol Laryngol 1994;103:699–704. [ ] 27.Lee JH, Lee MS, Lee BH, et al. Rhabdomyosarcoma of the head and neck in adults: MR and CT findings. AJNR 1996;17:1923–8. [ ] 28.Nayar RC, Prudhomme F, Parise O Jr, Gandia D, Luboinski B, Schwaab G. Rhabdomyosarcoma of the head and neck in adults: a study of 26 patients. Laryngoscope 1993;103:1362–6. [ ] 29.Gorelick J, Ross D, Marentette L, Blaivas M. Sinonasal undifferentiated carcinoma: cases series and review of the literature. Neurosurgery 2000;47: 750–4. [ ] 30.Phillips CD, Futterer SF, Lipper MH, Levine PA. Sinonasal undifferentiated carcinoma: CT and MR imaging of an uncommon neoplasm of the nasal cavity. Radiology 1997;202:477–80. [ ] 31.Smith SR, Som P, Fahmy A, Lawson W, Sacks S, Brandwein M. A clinicopathological study of sinonasal neuroendocrine carcinoma and sinonasal undifferentiated carcinoma. Laryngoscope 2000; 110:1617–22. [ ] 32.Fitzek MM, Thornton AF, Varvares M, et al. Neuroendocrine tumors of the sinonasal tract. Results of a prospective study incorporating chemotherapy surgery and combined proton-photon radiotherapy. Cancer 2002;94:2623–34. [ ] 33.Musy PY, Reibel JF, Levine PA. Sinonasal undifferentiated carcinoma: the search for a better outcome. Laryngoscope 2002;112:1450–5. [ ] 34.Fajardo-Dolci G, Magana RC, Bautista EL, Huerta D. Sinonasal lymphoma. Otol Laryngol Head Neck Surg 1999;121:323–6. [ ] 35.Hanna E, Wanamaker J, Adelstein D, Tubbs R, Lavertu P. Extranodal lymphomas of the head and neck: a 20-year experience. Arch Otolaryngol Head Neck Surg 1997;123:1318–23. [ ] 36.Gufler H, Laubenberger J, Gerling J, Nesbitt E, Kommerell G, Langer M. MRI of lymphomas of the orbits and the paranasal sinuses. J Comput Assist Tomogr 1997;21:887–91. [ ] 37.Hu W, Chen M, Sun Y, et al. Multivariate prognostic analysis of stage I(E) primary non-Hodgkin's lymphomas of the nasal cavity. Am J Clin Oncol 2001;24:286–9. [ ] 38.Quraishi MS, Bessel EM, Clark D, Jones NS, Bradley PJ. Non-Hodgkin's lymphoma of the sinonasal tract. Laryngoscope 2000;110:1489–92. [ ] 39.Sheahan P, Donnelly M, O'Reilly S, Murphy M. T/NK cell non-Hodgkin's lymphoma of the sinonasal tract. J Laryngol Otol 2001;115:1032–5. [ ] 40.Vidal RW, Devaney K, Rinaldo A, Ferlito A, Carbone A. Sinonasal malignant lymphomas: a distinct clinicopathological category. Ann Otol Rhinol Laryngol 1999;108:411–9. [ ] 41.Li YX, Coucke PA, Li JY, et al. Primary non-Hodgkin's lymphoma of the nasal cavity: prognostic significance of paranasal extension and the role of radiotherapy and chemotherapy. Cancer 1998; 83:449–56. [ ] 42.Nakamura K, Uehara S, Omagari J, et al. Primary non-Hodgkin lymphoma of the sinonasal cavities: correlation of CT evaluation with clinical outcome. Radiology 1997;204:431–5. [ ] 43.Lloyd G, Lund VJ, Howard D, Savy L. Optimum imaging for sinonasal malignancy. J Laringol Otol 2000;114:557–62. [ ] 44.Cabral CEL, Pereira AA. Estesioneuroblastoma: aspectos clínicos e radiológicos. Rev Imagem 1995;17:127–37. [ ] 45.Argiris A, Dutra J, Tseke P, Haines K. Esthesioneuroblastoma: the Northwestern University experience. Laryngoscope 2003;113:155–60. [ ] 46.Boone MLM, Harle TS, Higholt HW, Fletcher GH. Malignant disease of the paranasal sinuses and nasal cavity. Importance of precise localization of extent of disease. Am J Roentgenol Radium Ther Nucl Med 1968;102:627–36. [ ] 47.Davis RE, Weissler MC. Esthesioneuroblastoma and neck metastasis. Head Neck 1992;14:477–82. [ ] 48.Lund VJ, Howard D, Wei W, Spittle M. Olfactory neuroblastoma: past, present, and future? Laryngoscope 2003;113:502–7. [ ]
Recebido para publicação em 24/6/2004. Aceito, após revisão, em 3/12/2004.
* Trabalho realizado no Instituto Nacional de Câncer (INCa) e no Hospital Universitário Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554