Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 38 nº 1 - Jan. / Fev. of 2005
Vol. 38 nº 1 - Jan. / Fev. of 2005
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Antonio Sergio Zafred Marcelino, Ilka Regina Souza de Oliveira, Maria Cristina Chammas, Ricardo Augusto de Paula Pinto, Rina Maria Pereira Porta, Walter Yoshiharu Ishikawa, Giovanni Guido Cerri |
|
|
Descritores: Hipertensão portal, Anastomose portossistêmica intra-hepática transjugular, Ultra-som Doppler |
|
|
Resumo: IIIMédica Assistente, Doutora em Radiologia, Diretora do Serviço de Ultra-Sonografia do InRad/HC-FMUSP
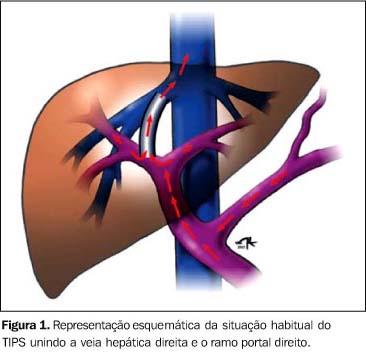
INTRODUÇÃO A anastomose portossistêmica intra-hepática transjugular (TIPS) é um procedimento terapêutico minimamente invasivo que produz uma anastomose ("shunt") entre o sistema porta e a circulação venosa sistêmica (veias hepáticas). É realizado através da introdução de uma prótese metálica auto-expansível no interior do parênquima hepático, por via transjugular. O objetivo é desviar o fluxo sanguíneo de um território patológico, o sistema porta hipertenso, para um território de baixa pressão, a circulação venosa sistêmica, reduzindo assim as conseqüências das complicações da hipertensão portal, principalmente a hemorragia digestiva alta proveniente das varizes gastroesofágicas e a ascite refratária. Dessa forma, o TIPS propicia a melhora das condições clínicas dos pacientes hepatopatas crônicos, candidatos ao transplante de fígado, diante a ineficácia das outras formas de tratamento dos sintomas da hipertensão portal(1,2). Desde a primeira descrição do procedimento em cães em 1969, a técnica de realização do TIPS vem sendo aprimorada, e somente com o desenvolvimento tecnológico progressivo de cateteres e próteses durante duas décadas foi possível a realização do primeiro procedimento em humanos em 1989(3-5). A esclerose endoscópica ou a ligadura elástica das varizes de esôfago são os procedimentos terapêuticos de escolha para o sangramento agudo, associados ou não a drogas vasoativas. Aproximadamente 90% a 95% destes sangramentos agudos podem ser controlados com estas terapêuticas. Para os restantes, o procedimento cirúrgico ou o TIPS podem ser indicados. Embora o procedimento cirúrgico seja considerado o único que realmente controla os sintomas de sangramento de varizes esofágicas decorrentes da hipertensão portal em longo prazo, o índice de mortalidade nestes pacientes graves é inaceitavelmente elevado. O TIPS consegue obter o controle do sangramento das varizes de esôfago em cerca de 90% dos pacientes e, ao contrário do tratamento cirúrgico, com índice de mortalidade baixo(6,7). Nos pacientes portadores de ascite refratária ao tratamento clínico, o controle dos sintomas ocorre em 75% a 90% dos pacientes(8). Atualmente, o TIPS é considerado procedimento paliativo, inovador, realizado regularmente graças à criação de próteses mais duráveis e ao domínio da técnica, que permitiram a sua aplicabilidade terapêutica em condições muito precisas. Outras indicações para a realização do TIPS são o hidrotórax cirrótico, a síndrome de Budd-Chiari, a síndrome hepato-renal, e como "ponte" para o transplante de fígado, pois propicia a melhora das condições clínicas e nutricionais dos pacientes mediante uma eficaz descompressão prévia do sistema porta, sem que a cavidade peritoneal seja aberta em cirurgias, que dificultam a abordagem e a realização do futuro transplante(9-12). As contra-indicações absolutas para a realização do TIPS são a insuficiência cardíaca direita e a insuficiência hepática grave. As contra-indicações relativas para o procedimento são a encefalopatia hepática, a trombose de veia porta, as infecções hepáticas ou sistêmicas, as neoplasias hepáticas hipervascularizadas e a doença hepática policística(13). As complicações mais comuns inerentes ao procedimento são a encefalopatia hepática, a estenose e a oclusão do "stent". A encefalopatia é freqüente e observada após a colocação da prótese, resolve-se com o tratamento clínico, medicamentoso ou com o passar do tempo, sem que haja necessidade de redução do calibre da anastomose em novo procedimento. A estenose, cuja incidência estimada varia de 17% a 50%, pode ter diferentes causas(2). Nos primeiros dias, a estenose geralmente é causada por complicações técnicas como estreitamento, migração da prótese e trombose por lesão endotelial. Em aproximadamente três semanas a superfície da prótese já está recoberta por uma fina camada de tecido pseudo-intimal. Paulatinamente, de forma lenta e progressiva, a superfície fenestrada da prótese é recoberta por um tecido composto basicamente por células inflamatórias, tecido de granulação (miofibroblastos e colágeno) e bile ao final de três meses. Em alguns pacientes a pseudo-íntima se torna muito exuberante e hiperplásica, provocando acentuada redução do calibre da prótese e obstrução ao fluxo sanguíneo através da anastomose portossistêmica intra-hepática. A bile é o elemento desencadeante responsável pela indução da reação inflamatória e da estenose na porção intra-hepática da prótese. Na extremidade distal junto à veia hepática de drenagem o mecanismo de formação da estenose não está relacionado à bile, e geralmente a hiperplasia intimal desenvolve-se em decorrência de fenômenos hemodinâmicos relacionados ao fluxo turbulento e de alta velocidade nesta topografia(10,11,14). O local mais freqüente de estenose é na junção entre a veia hepática de drenagem e a prótese, ocorrendo em 76% dos casos, seguido da estenose no interior da prótese em 24% dos casos e o restante no terço proximal da prótese junto à veia porta(15). A importância do diagnóstico da estenose está no fato de que 30% a 40% dos pacientes com algum grau de estenose podem estar assintomáticos(9). O diagnóstico precoce da estenose facilita o tratamento, permitindo a terapêutica por angioplastia, trombólise ou colocação de nova prótese, e evita a recorrência dos sintomas(16). A revisão e o seguimento da permeabilidade do TIPS propiciam um significativo aumento da permeabilidade. Em pacientes que não realizam o seguimento, a permeabilidade primária do TIPS varia de 23% a 66% em um ano. Naqueles pacientes que realizam o seguimento e revisão da anastomose, a permeabilidade primária assistida é de 85% a 90% no mesmo período de tempo(2,9). O ultra-som Doppler colorido e espectral vem sendo utilizado para a avaliação do TIPS devido às suas características essenciais. É um método não invasivo, disponível, de baixo custo, que não utiliza radiação ionizante, contraste iodado, e pode ser realizado em pacientes graves à beira do leito(2,9,15,17). Desde o primeiro estudo utilizando a ultra-sonografia com Doppler no diagnóstico de estenose do TIPS (em 1993), vários parâmetros foram introduzidos para esta avaliação(16). A seguir serão descritos os papéis da ultra-sonografia Doppler na avaliação prévia à realização do TIPS, os aspectos pertinentes ao modo-B e os parâmetros dopplervelocimétricos sugestivos de estenose descritos na literatura, objeto principal deste artigo de revisão (Figura 1).
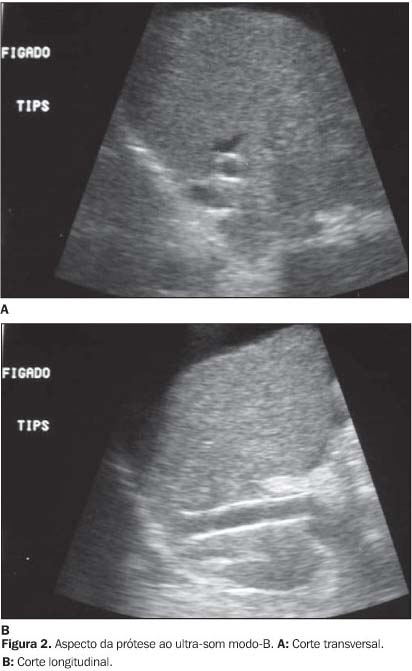
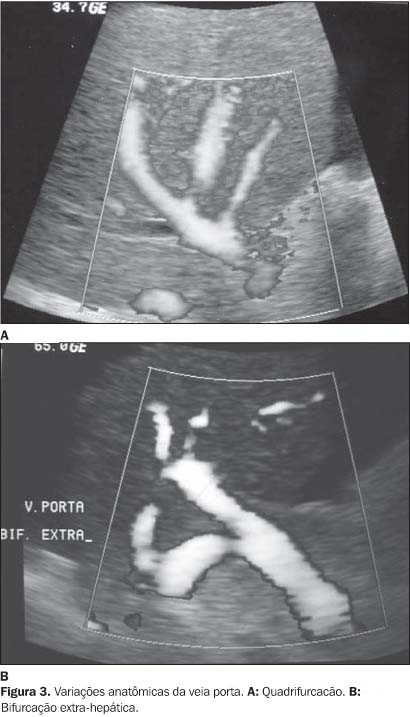
AVALIAÇÃO PRÉVIA AO PROCEDIMENTO E ASPECTOS AO ULTRA-SOM MODO-B A análise prévia do sistema porta é fundamental para a realização do TIPS. É importante observar a presença de variações anatômicas na veia porta, como a bifurcação extra-hepática, o número de ramificações (trifurcação ou quadrifurcação) e a anatomia das veias hepáticas. A presença de trombose deve ser observada, com o intuito de orientar o radiologista intervencionista na realização do procedimento. A prótese pode ser identificada como uma estrutura tubular de paredes hiperecogênicas e interior hipoecogênico em relação ao parênquima hepático. É importante observar a topografia da prótese, a presença de possíveis hematomas ou coleções ao redor dela, estreitamentos focais da prótese, a presença de colaterais e a ascite. A presença da ascite e de colaterais pode sugerir disfunção do TIPS. No entanto, alterações como trombos, áreas de estenose focal ou difusa e pseudo-hiperplasia intimal não são caracterizadas corretamente pelo modo-B. Portanto, torna-se necessária a complementação com o Doppler espectral e colorido, que permite a caracterização adequada de alterações hemodinâmicas secundárias ao estreitamento(18-20) (Figuras 2 e 3).
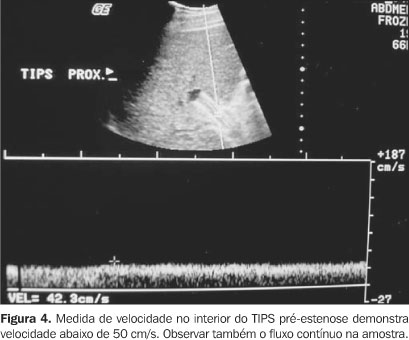
Parâmetros dopplervelocimétricos A velocidade mínima na prótese é o parâmetro mais usado no diagnóstico de estenose e o primeiro a ser descrito em 1993. O valor de velocidade mínima deve ser usado no território pré-estenótico(16). Vários centros utilizam a velocidade mínima na prótese de 50 a 60 cm/s como limite inferior de normalidade(16,20,21). No entanto, a sensibilidade e a especificidade obtidas por este parâmetro (velocidade) isolado são variáveis, com sensibilidade de 78% a 100% e especificidade de 32% a 93%(16,21,22). Utilizando o valor de velocidade mínima de 60 cm/s como diagnóstico de estenose, a sensibilidade varia de 25% a 57% e a especificidade varia de 93% a 98%(22-24). Uma outra publicação demonstra que a utilização da velocidade mínima de 90 cm/s é mais apropriada para o limite inferior da normalidade, pois aumenta significativamente a sensibilidade no diagnóstico de estenose. Dessa maneira, faz o diagnóstico de estenoses menos graves e reduz teoricamente a incidência de complicações conseqüentes à disfunção do TIPS(25) (Figura 4).
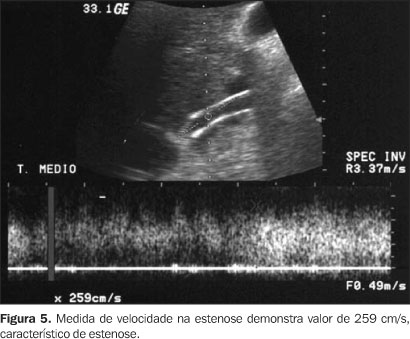
A velocidade máxima na prótese é outro parâmetro utilizado, e nos casos de estenose focal os valores elevados de velocidade podem sugerir o local de maior obstrução. Os valores referidos na literatura variam de 185 a 250 cm/s e a diferença pode ser explicada pelos diversos métodos de obtenção de velocidade (inspiração profunda, apnéia sem inspiração, decúbito) ou por outros critérios angiográficos na definição de estenose(17-19,26,27) (Figura 5).
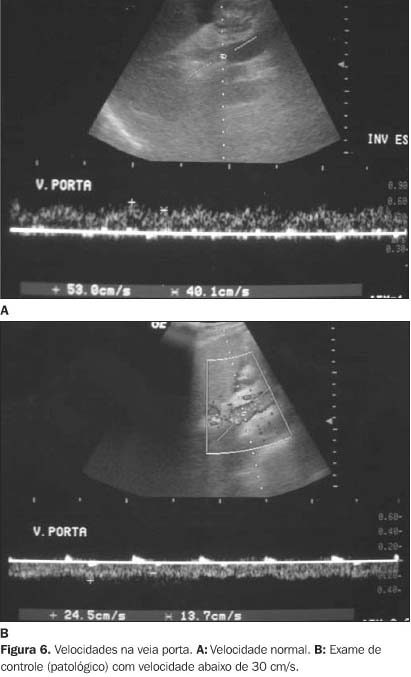
A velocidade de fluxo na veia porta aumenta após a colocação da prótese, em decorrência da descompressão provocada pelo novo trajeto de fluxo, que não sofre interferência da alta resistência causada pelo parênquima hepático doente. A diminuição de velocidade de fluxo na veia porta em relação ao exame de base (realizado 24 horas após a colocação da prótese) pode corresponder à estenose do TIPS. As velocidades de fluxo na veia porta de 37 a 47 cm/s são encontradas em "shunts" sem obstrução(18,22,26) . Quando a velocidade na veia porta for inferior a 30-40 cm/s, o diagnóstico de estenose pode ser feito com sensibilidade de 82% a 84% e especificidade de 54% a 77%(22,25) (Figura 6).
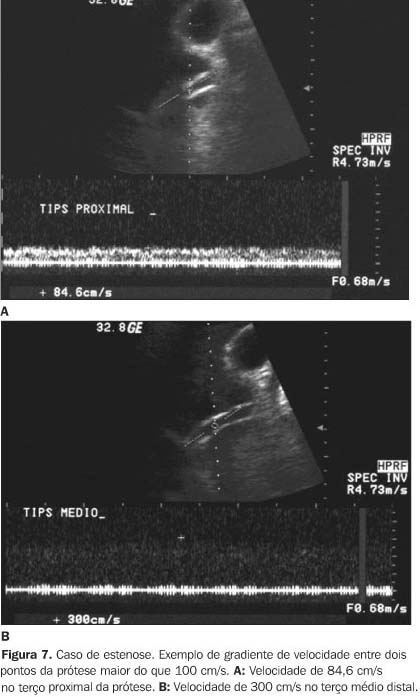
Outro parâmetro a ser considerado para o diagnóstico de estenose é a velocidade na veia porta menor ou igual a dois terços do exame de base (realizado 24 horas após a criação do "shunt"), apresentando sensibilidade de 51,1% e valor preditivo positivo de 100%, que destaca a importância de se correlacionar valores de velocidade em exames subseqüentes e não apenas os valores absolutos de velocidade do exame atual(17). Os gradientes de velocidade são observados em casos de estenose focal. Embora pouco freqüentes, as estenoses difusas não produzem diferenças significativas de velocidade e são responsáveis, na maioria dos casos, pela ausência de gradiente de velocidade de fluxo entre dois pontos. O gradiente de velocidade superior a 100 cm/s apresenta valor preditivo positivo de 82% para o diagnóstico de estenose, com 56% de sensibilidade(25) (Figura 7).
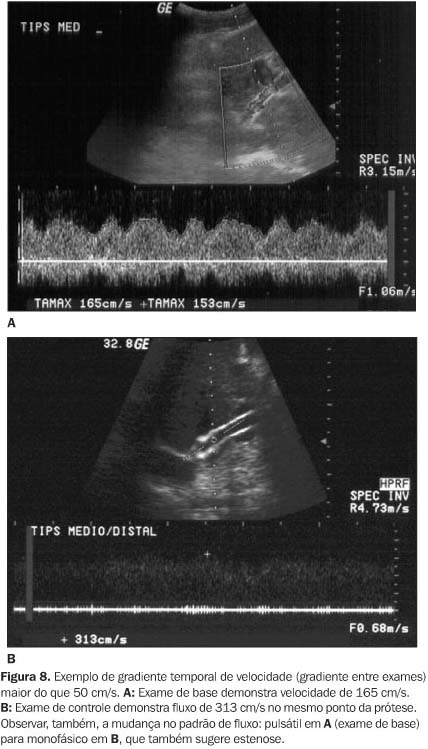
A diferença de velocidade de fluxo no mesmo ponto da prótese em exames seqüenciais é outro parâmetro utilizado, e o aumento ou redução de velocidade de fluxo maior ou igual a 50 cm/s, mensurado em um mesmo ponto da prótese em relação ao exame de base (24 horas após a criação da anastomose) ou comparado com exames prévios, sugere o diagnóstico de estenose, com sensibilidade de 93% e especificidade de 77%(28). Em outro estudo, a redução de 40 cm/s ou aumento de 60 cm/s tem sensibilidade de 75% e especificidade de 84% no diagnóstico de estenose(25) (Figura 8).
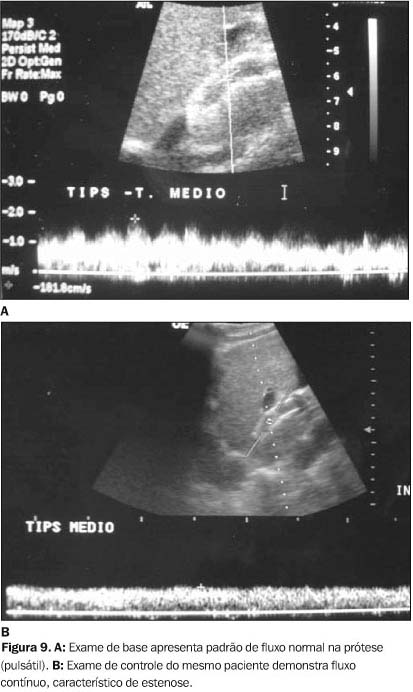
Após a realização do TIPS, a direção de fluxo nos ramos portais, que é hepatopetal, se torna hepatofugal devido à redução da resistência causada pela anastomose, que direciona o fluxo sanguíneo através do "shunt" para o território de baixa pressão (circulação sistêmica)(20,25,26). Todavia, nos casos de oclusão ou estenose ocorre aumento de resistência, e o fluxo pode voltar a ser hepatopetal. Este achado é indicativo de estenose ou oclusão, descrito em número limitado de pacientes e sinal tardio de disfunção de TIPS, com 31% de especificidade(25). Quando a estenose se desenvolve na extremidade junto à veia hepática de drenagem do "shunt", podemos observar a inversão do fluxo na veia hepática que recebe a anastomose. Isto é, o fluxo que no "shunt" funcionante vai para a veia cava inferior (VCI), se torna hepatopetal (contrário à VCI) nos casos de estenose. Apesar de ser sinal de estenose, a sua sensibilidade é desconhecida(29). A velocidade de pico sistólico (VPS) na artéria hepática aumenta em relação ao exame prévio à colocação da prótese. Os autores relatam aumento na VPS da artéria hepática de 51 cm/s (79-131 cm/s), 24 horas após a criação da anastomose(18-20,26). Nos pacientes com disfunção do TIPS, observa-se redução significativa na VPS da artéria hepática, de 27 cm/s (de 135 cm/s para 108 cm/s)(22). O traçado espectral normal do fluxo, após a colocação do TIPS, tanto na prótese como na veia porta, é pulsátil na maioria dos pacientes, repercussão esta causada pela comunicação direta do sistema porta com o átrio direito. O desenvolvimento progressivo de estenose promove uma atenuação deste aspecto pulsátil do fluxo até que este se torne monofásico em casos de estenoses distais ao ponto desta avaliação. A análise da morfologia do espectro de fluxo deve ser correlacionada com exames prévios e com o exame de base realizado 24 horas após a criação do "shunt"(16,28,29). Em recente estudo foi proposto um índice para avaliação da pulsatilidade do fluxo na prótese e na veia porta, o índice de pulsatilidade venosa (IPV). O IPV é semelhante ao índice de resistência utilizado para análise arterial (velocidade sistólica - velocidade diastólica/velocidade sistólica), e neste estudo o autor considera patológico todo "shunt" que apresenta índice de pulsatilidade menor que 0,16 no terço proximal e médio da prótese(30) (Figura 9).
Parâmetros combinados A utilização de alguns destes parâmetros combinados no diagnóstico de estenose do TIPS possui destaque. A utilização da velocidade na prótese maior ou igual a 190 cm/s ou menor que 90 cm/s, do gradiente de velocidade entre dois pontos da prótese e da velocidade na veia porta menor que 30 cm/s possui sensibilidade de 82% e especificidade de 77%. A estes três parâmetros o estudo acrescenta a impressão subjetiva do realizador do exame, que busca observar alguns parâmetros sugestivos de estenose com sensibilidade e especificidade inferiores, como a direção de fluxo nos ramos portais e veias hepáticas e o padrão espectral de fluxo(25). Em outra publicação, a sensibilidade no diagnóstico de estenose é de 94% e a especificidade é de 73%, com valor preditivo positivo de 96,3%. Os parâmetros dopplervelocimétricos utilizados são o pico de velocidade na prótese maior ou igual a 250 cm/s, a velocidade na veia porta menor ou igual a dois terços do exame de base e a velocidade na extremidade portal da prótese menor ou igual a 50 cm/s, o que também demonstra eficácia do método de avaliação com a combinação de parâmetros(17). O mapeamento com Doppler de amplitude e a utilização de meios de contraste melhoram significativamente a análise do segmento distal do "shunt" próximo à VCI em relação ao Doppler colorido convencional, com redução da porcentagem de falha técnica na visualização da veia hepática de drenagem para 6% (o Doppler colorido convencional apresenta 38% de falha técnica). Embora seja considerado o local mais freqüente de estenose, a análise deste segmento pelo Doppler pode ser dificultada pela presença de alças intestinais, interferência de batimentos cardíacos, em pacientes obesos e também pela reduzida distância entre a VCI/átrio direito e a extremidade da prótese em fígados de tamanho reduzido. O mapeamento com Doppler de amplitude e os meios de contraste mostram sensibilidade e especificidade de 100% nos casos de oclusão, e sensibilidade de 82% e especificidade de 83% no diagnóstico das estenoses hemodinamicamente significativas do TIPS(31,32).
CONCLUSÃO O presente artigo tem por objetivo demonstrar a utilidade do ultra-som Doppler no seguimento do TIPS e descrever os parâmetros de estenose descritos na literatura. Alguns estudos demonstram que o ultra-som Doppler possui alta sensibilidade e relativa especificidade no diagnóstico da disfunção do "shunt", particularmente quando vários parâmetros são analisados. Entretanto, a comparação direta destes parâmetros e respectiva eficácia são difíceis porque os protocolos de avaliação com o ultra-som variam de instituição para instituição, as medidas de velocidade são obtidas em um ou mais pontos da anastomose e diferentes parâmetros são analisados. Além desses fatores, os critérios angiográficos de estenose variam entre os estudos. Assim, é de fundamental importância o conhecimento destes parâmetros, dos aspectos hemodinâmicos envolvidos, dos locais mais comuns de estenose e das demais complicações possíveis. Ainda assim o ultra-som Doppler se constitui hoje no principal método de avaliação e seguimento da permeabilidade do TIPS, sendo importante realizar protocolos rígidos de avaliação. A angiografia deve ficar reservada para a confirmação de casos duvidosos e para a terapêutica pertinente.
REFERÊNCIAS 1. Conn HO. Transjugular intrahepatic portal-systemic shunts: the state of the art. Hepatology 1993;17: 148-58. [ ] 2. Haskal ZJ, Pentecost MJ, Soulen MC, Shlansky-Goldberg RD, Baum RA, Cope C. Transjugular intrahepatic portosystemic shunt stenosis and revision: early and midterm results. AJR 1994;163: 439-44. [ ] 3. Palmaz JC, Sibbitt RR, Reuter SR, Garcia F, Tio FO. Expandable intrahepatic portacaval shunt stents: early experience in the dog. AJR 1985;145: 821-5. [ ] 4. Richter GM, Noeldge G, Palmaz JC, et al. Transjugular intrahepatic portacaval stent shunt: preliminary clinical results. Radiology 1990;174:1027-30. [ ] 5. Zemel G, Katzen BT, Becker GJ, Benenati JF, Sallee DS. Percutaneous transjugular portosystemic shunt. JAMA 1991;266:390-3. [ ] 6. Kerlan RK Jr, LaBerge JM, Gordon RL, Ring EJ. Transjugular intrahepatic portosystemic shunts: current status. AJR 1995;164:1059-66. [ ] 7. Shiffman ML, Jeffers L, Hoofnagle JH, Tralka TS. The role of transjugular intrahepaic portosystemic shunt for treatment of portal hypertension and its complications: a conference sponsored by the National Digestive Diseases Advisory Board. Hepatology 1995;22:1591-7. [ ] 8. Brown RS Jr, Lake JR. Transjugular intrahepatic portosystemic shunt as a form of treatment for portal hypertension: indications and contraindications. Adv Intern Med 1997;42:485-504. [ ] 9. Nazarian GK, Bjarnason H, Dietz CA Jr, et al. Refractory ascites: midterm results of treatment with a transjugular intrahepatic portosystemic shunt. Radiology 1997;205:173-80. [ ] 10. LaBerge JM, Somberg KA, Lake JR, et al. Two-year outcome following transjugular intrahepatic portosystemic shunt for variceal bleeding: results in 90 patients. Gastroenterology 1995;108:1143-51. [ ] 11. Haskal ZJ. Improved patency of transjugular intrahepatic portosystemic shunts in humans: creation and revision with PTFE stent-grafts. Radiology 1999;213:759-66. [ ] 12. Haskal Z. Transjugular intrahepatic shunt stenosis and thrombosis: shunt biology and stent-grafts. In: Rossi P, Ricci P, Broglia L, eds. Portal hypertension: diagnostic imaging and imaging-guided therapy. 1st ed. Berlin: Springer-Verlag, 2000:221-32. [ ] 13. Zwiebel WJ. Vascular disorders of the liver. In: Zwiebel WJ, ed. Introduction to vascular ultrasonography. 4th ed. Philadelphia, PA: WB Saunders, 2000:443-5. [ ] 14. Otal P, Smayra T, Bureau C, et al. Preliminary results of a new expanded-polytetrafluoroethylene-covered stent-graft for transjugular intrahepatic portosystemic shunt procedures. AJR 2002;178: 141-7. [ ] 15. Rössle M, Haag K, Ochs A, et al. The transjugular intrahepatic portosystemic stent-shunt procedure for variceal bleeding. N Engl J Med 1994;330:165-71. [ ] 16. Chong WK, Malisch TA, Mazer MJ, Lind CD, Worrell JA, Richards WO. Transjugular intrahepatic portosystemic shunt: US assessment with maximum flow velocity. Radiology 1993;189:789-93. [ ] 17. Zizka J, Elias P, Krajina A, et al. Value of Doppler sonography in revealing transjugular intrahepatic portosystemic shunt malfunction: a 5-year experience in 216 patients. AJR 2000;175:141-8. [ ] 18. Foshager MC, Ferral H, Finlay DE, Castañeda-Zúñiga WR, Letourneau JG. Color Doppler sonography of transjugular intrahepatic portosystemic shunts (TIPS). AJR 1994;163:105-11. [ ] 19. Longo JM, Bilbao JI, Rousseau HP, et al. Transjugular intrahepatic portosystemic shunt: evaluation with Doppler sonography. Radiology 1993; 186:529-34. [ ] 20. Foshager MC, Ferral H, Nazarian GK, Castañeda-Zúñiga WR, Letourneau JG. Duplex sonography after transjugular intrahepatic portosystemic shunts (TIPS): normal hemodynamic findings and efficacy in predicting shunt patency and stenosis. AJR 1995;165:1-7. [ ] 21. Feldstein VA, Patel MD, LaBerge JM. Transjugular intrahepatic portosystemic shunts: accuracy of Doppler US in determination of patency and detection of stenoses. Radiology 1996;201:141-7. [ ] 22. Haskal ZJ, Carroll JW, Jacobs JE, et al. Sonography of transjugular intrahepatic portosystemic shunts: detection of elevated portosystemic gradients and loss of shunt function. J Vasc Interv Radiol 1997;8: 549-56. [ ] 23. Haskal ZJK, Davis A, McAllister A, Furth EE. PTFE-encapsulated endovascular stent-graft for transjugular intrahepatic portosystemic shunts: experimental evaluation. Radiology 1997;205:682-8. [ ] 24. Murphy TP, Beecham RP, Kim HM, Webb MS, Scola F. Long-term follow-up after TIPS: use of Doppler velocity criteria for detecting elevation of the portosystemic gradient. J Vasc Interv Radiol 1998;9:275-81. [ ] 25. Kanterman RY, Darcy MD, Middleton WD, Sterling KM, Teffey SA, Pilgram TK. Doppler sonography findings associated with transjugular intrahepatic portosystemic shunt malfunction. AJR 1997;168: 467-72. [ ] 26. Surratt RS, Middleton WD, Darcy MD, Melson GL, Brink JA. Morphologic and hemodynamic findings at sonography before and after creation of a transjugular intrahepatic portosystemic shunt. AJR 1993;160:627-30. [ ] 27. Kliewer MA, Hertzberg BS, Heneghan JP, et al. Transjugular intrahepatic portosystemic shunts (TIPS): effects of respiratory state and patient position on the measurement of Doppler velocities. AJR 2000;175:149-52. [ ] 28. Dodd GD 3rd, Zajko AB, Orons PD, Martin MS, Eichner LS, Santaguida LA. Detection of transjugular intrahepatic portosystemic shunt dysfunction: value of duplex Doppler sonography. AJR 1995; 164:1119-24. [ ] 29. Feldstein VA, LaBerge JM. Hepatic vein flow reversal at duplex sonography: a sign of transjugular intrahepatic portosystemic shunt dysfunction. AJR 1994;162:839-41. [ ] 30. Sheiman RG, Vrachliotis T, Brophy DP, Ransil BJ. Transmitted cardiac pulsations as an indicator of transjugular intrahepatic portosystemic shunt function: initial observations. Radiology 2002;224: 225-30. [ ] 31. Uggowitzer MM, Kugler C, Machan L, et al. Value of echo-enhanced Doppler sonography in evaluation of transjugular intrahepatic portosystemic shunts. AJR 1998;170:1041-6. [ ] 32. Fürst G, Malms J, Heyer T, et al. Transjugular intrahepatic portosystemic shunts: improved evaluation with echo-enhanced color Doppler sonography, power Doppler sonography, and spectral duplex sonography. AJR 1998;170:1047-54. [ ]
Recebido para publicação em 22/10/2003. Aceito, após revisão, em 22/12/2003.
* Trabalho realizado no Serviço de Ultra-sonografia do Instituto de Radiologia (InRad) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554