Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 38 nº 1 - Jan. / Fev. of 2005
Vol. 38 nº 1 - Jan. / Fev. of 2005
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Marlos Augusto Bitencourt Costa, Tarcísio Nunes Carvalho, Cyrillo Rodrigues de Araújo Júnior, Ana Olívia Cardoso Borba, Gerson Augusto Veloso, Kim-Ir-Sen Santos Teixeira |
|
|
Descritores: Paracoccidioidomicose, Sistema nervoso central, Adrenais, Osteoarticular, Digestivo, Linfonodos |
|
|
Resumo: IIIProfessor Adjunto Doutor do Serviço de Diagnóstico por Imagem do HC-FMUFG
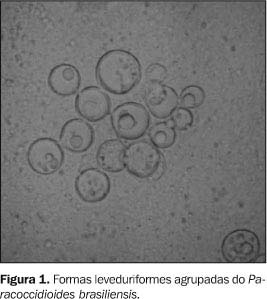
INTRODUÇÃO Paracoccidioidomicose ou doença de Lutz-Almeida-Splendore é uma infecção fúngica crônica, de caráter granulomatoso e progressão insidiosa, mais freqüente nos países da América Latina. Ela é causada por um fungo dimórfico, o Paracoccidioides brasiliensis (Figura 1), saprófita de plantas e do solo. A porta de entrada mais freqüente do fungo é o trato respiratório superior, através da inalação de conídios, sendo os pulmões e as vias aéreas superiores os primeiros locais acometidos. A partir daí pode haver disseminação do fungo para outros locais, tanto por via hematogênica como linfática(1).
Qualquer órgão do corpo pode ser acometido, porém as manifestações radiológicas mais importantes são observadas nos pulmões, linfonodos, supra-renais, ossos, tubo digestivo e sistema nervoso. Como as manifestações pulmonares têm sido mais relatadas na literatura, optamos por discutir os principais aspectos de imagem no acometimento extrapulmonar da paracoccidioidomicose.
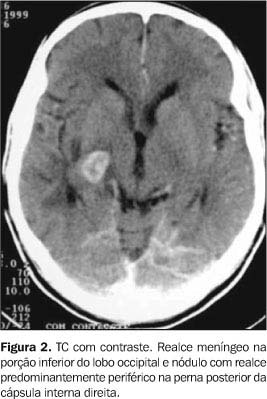
SISTEMA NERVOSO CENTRAL O acometimento do sistema nervoso central (SNC) pela paracoccidioidomicose foi sugerido primeiramente por Pereira e Jacobs em 1919(2), porém só foi estudado mais minuciosamente após a década de 70. A freqüência deste envolvimento em séries de autópsia foi variada, chegando em alguns estudos a até 27%(3) dos pacientes com doença disseminada; todavia, estas lesões neurológicas podem ser mais freqüentes do que se acredita atualmente, pelo fato de nem sempre causarem sintomas(1,4). As manifestações do SNC em geral ocorrem em doentes que apresentam ou apresentaram lesões em outros órgãos, sendo incomum ser este o único órgão acometido(1,4). Suas lesões podem ser divididas em dois tipos: as formas meníngea e a granulomatosa ou pseudotumoral(1,4-8). A forma meníngea é mais rara e caracterizada por inflamação crônica da leptomeninge, de distribuição focal e predominante na base do crânio(1,4-7), definida na tomografia computadorizada (TC) e na ressonância magnética (RM) como áreas de realce leptomeníngeo anormal após a injeção do meio de contraste (Figura 2) ou como nódulos corticais que tendem a desaparecer após o tratamento(5,7). As alterações encontradas no líquido cerebrospinal são inespecíficas, sendo excepcional a demonstração do fungo, seja pelo exame direto ou cultura(1,4).
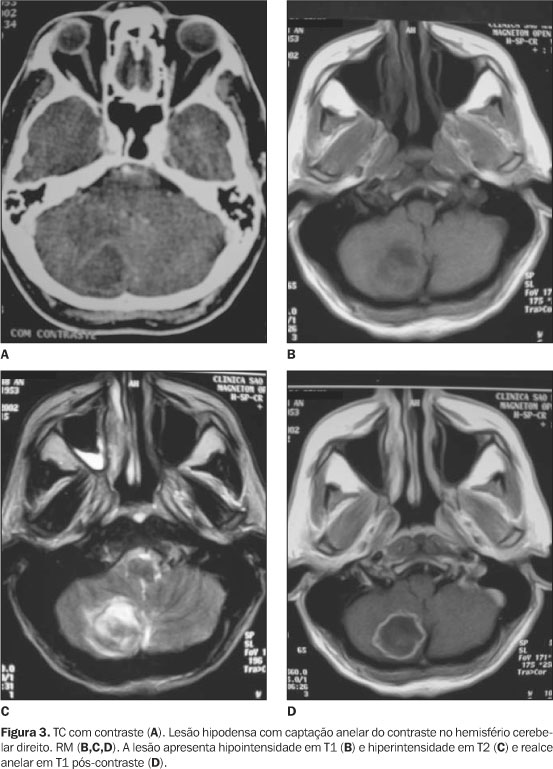
Na forma granulomatosa ou pseudotumoral as lesões tendem a ser múltiplas, apresentando distribuição aleatória, com certa predominância no compartimento supratentorial, em especial nos hemisférios cerebrais(1,2,4-7). Podem acometer ainda, em ordem decrescente, o cerebelo, os tálamos, o tronco encefálico e mais raramente a medula espinal(1,3-5,7). Os métodos de imagem são de fundamental importância na caracterização do envolvimento neurológico, especialmente na forma pseudotumoral. Na TC o aspecto mais comum é de lesão nodular isoatenuante, com interior discretamente hipodenso, de contornos arredondados ou lobulados e apresentando impregnação periférica e anelar pelo meio de contraste (Figuras 2 e 3)(1,4-6,8). A RM tem sensibilidade maior na detecção destas lesões, principalmente na fossa posterior, sendo que o aspecto principal é de iso a hiperintensidade em imagens ponderadas em T2(7). O edema perilesional, bem como o efeito expansivo, são bastante freqüentes(1,4-8).
Após o tratamento essas lesões podem exibir calcificações(1), além de realce até uns seis meses após seu término(7). O aspecto dessas lesões é inespecífico e deve-se incluir, no diagnóstico diferencial, metástases, tumores primários, abscessos e neurocisticercose.
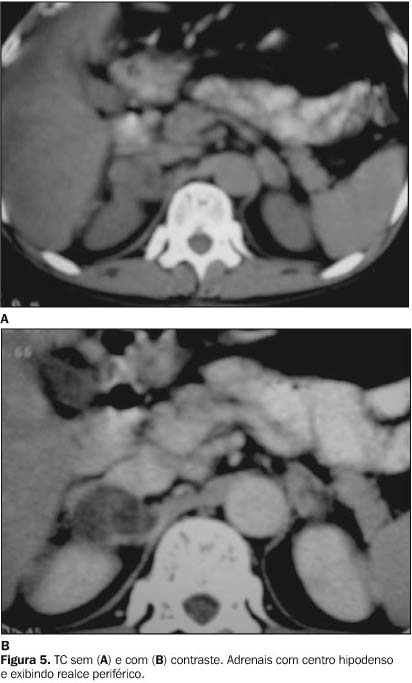
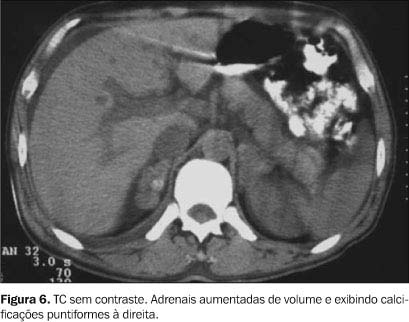
GLÂNDULAS ADRENAIS No Brasil e em outros países da América do Sul, a paracoccidioidomicose é uma das causas mais comuns de insuficiência adrenal primária (doença de Addison). O primeiro relato deste acometimento foi feito por Vianna em 1914, como achado de necropsia(9). As lesões adrenais são menos freqüentes apenas que os acometimentos pulmonares e linfonodais(1,10), sendo observadas em até 50% das autópsias de pacientes portadores da doença disseminada(10). A maioria desses pacientes é assintomática, sendo necessária a destruição de pelo menos 80% a 90% das glândulas para surgirem os sintomas de insuficiência adrenal. Alterações exclusivas da adrenal sem o comprometimento concomitante de outros órgãos podem ser observadas, porém são bastante raras(10). Tanto a ultra-sonografia (US) como a TC têm-se mostrado bastante importantes na caracterização destas adrenais acometidas(11). O seu aspecto nestes métodos de imagem é variável, dependendo do estágio da infecção, e indistinto de outras infecções granulomatosas, como a tuberculose e a histoplasmose(12). Na fase aguda há um aumento difuso da glândula, uni ou bilateral(11), freqüentemente não-homogêneo (Figura 4), devido a necrose caseosa, sendo a impregnação pelo contraste na TC, principalmente periférica (Figura 5)(12,13). Com a cronicidade as glândulas vão-se atrofiando, assumindo contornos irregulares, e tendem a se calcificar (Figura 6), de modo que a presença de calcificação adrenal sem aumento de tecidos moles é sugestiva de infecção e não de neoplasia(13). Estes métodos de imagem podem servir ainda como guias para possíveis biópsias percutâneas(11).
Pelo aspecto de imagem o diagnóstico diferencial da blastomicose de supra-renal inclui as demais infecções granulomatosas, hemorragia antiga e calcificação idiopática das adrenais.
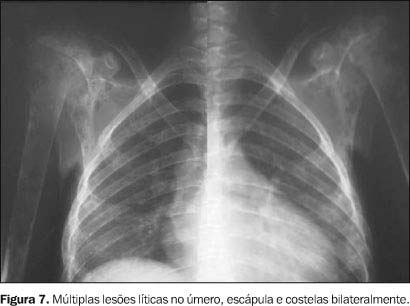
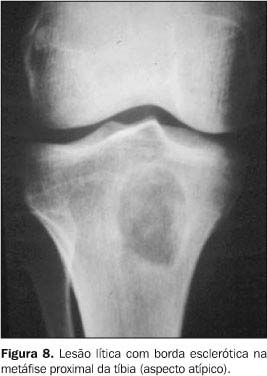
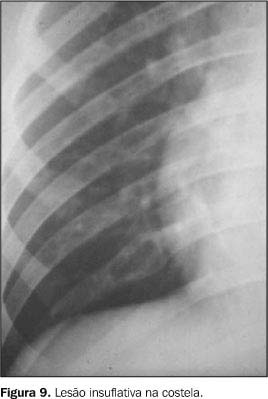
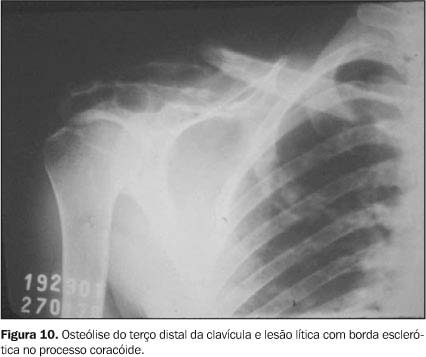
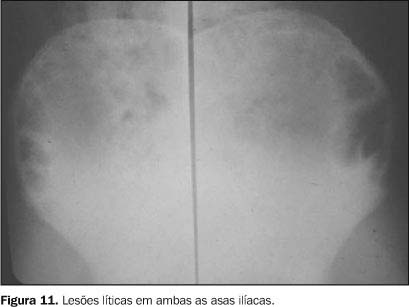
SISTEMA OSTEOARTICULAR O comprometimento osteoarticular na paracoccidioidomicose foi primeiramente relatado em 1911 por Pereira e Vianna(14). A freqüência deste acometimento em estudos sistematizados tem sido variada, chegando em algumas revisões a até 20% dos casos de doença disseminada(15). Na maioria das vezes o P. brasiliensis atinge o tecido ósseo e/ou articular por via hematogênica, sendo a extensão por contigüidade através de lesões cutâneo-mucosas menos freqüente. O antecedente de trauma, aberto ou fechado, precedendo as manifestações osteoarticulares, não deve ser interpretado como fator inoculador do fungo e sim como localizador ou desencadeante do estabelecimento do fungo durante a fase de fungemia(1,16,17). As lesões ósseas geralmente são assintomáticas, sendo descobertas em exames radiológicos rotineiros, ao contrário das lesões articulares, as quais manifestam quadro clínico exuberante, caracterizado por sinais flogísticos intensos e impotência funcional(1,16,17). Os ossos mais freqüentemente envolvidos são: clavícula, costelas, acrômio, esterno e rádio. Essas lesões apresentam uma nítida tendência à simetria (Figura 7), em geral são múltiplas e com tamanho variando de poucos milímetros a 3 cm. Elas apresentam caráter osteolítico, são bem delimitadas, porém sem esclerose marginal e não associadas a reação periosteal(1,15,16,18,19). Nos ossos longos geralmente se iniciam na medular diafisária e daí se estendem para metáfise e epífise. Alterações da cortical são mais comuns nas localizações epifisárias e a ocorrência de osteoesclerose (Figura 8) e produção osteoperióstica predominam nas lesões por contigüidade ou quando associadas a outros processos infecciosos(1,15,16,18). Nas costelas e esterno as lesões tendem a ser insuflativas (Figura 9) e na coluna vertebral podem determinar destruição da cartilagem intervertebral, com erosão da superfície dos corpos vertebrais correspondentes, simulando a espondilite tuberculosa(1,15,16,18). O aspecto mais sugestivo desta doença é o acometimento bilateral acrômio-clavicular ou de ambas as asas ilíacas (Figuras 10 e 11).
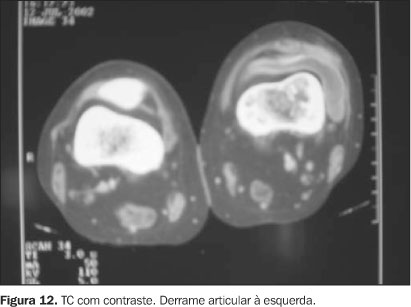
O comprometimento articular ocorre na maioria das vezes por extensão das lesões ósseas epifisárias(1,16,17), sendo observadas em cerca de um terço dos casos de lesões ósseas(1). Já existem relatos de lesões articulares isoladas, sem evidências clínicas, laboratoriais e radiológicas de acometimento em outros órgãos(17,20). O aspecto radiográfico é de destruição da cartilagem, com derrame e redução do espaço articular (Figura 12), indistinguível dos demais processos infecciosos.
Com a instituição do tratamento observa-se uma mudança lenta e gradual no aspecto das lesões, ocorrendo neoformação óssea, passando a assumir um aspecto de trabeculado grosseiro e denso(1,18). O diagnóstico diferencial das lesões ósseas deve incluir mieloma, metástase, distúrbios linfoproliferativos, histiocitose e osteomielite crônica. Já as formas articulares têm como diagnóstico diferencial os demais processos infecciosos piogênicos ou não-piogênicos.
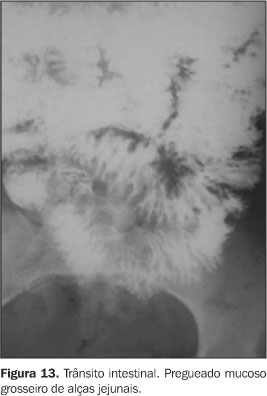
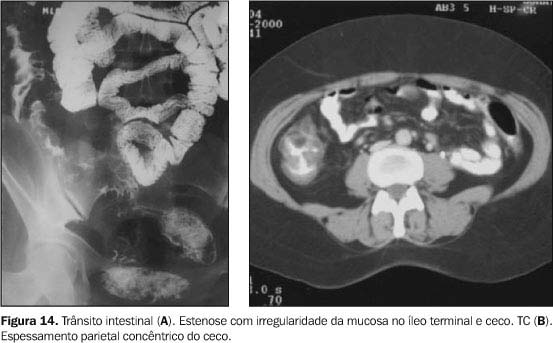
APARELHO DIGESTIVO Nas primeiras necropsias de pacientes portadores de paracoccidioidomicose, foram observadas lesões acometendo o trato digestivo, sendo o primeiro relato feito por Vianna(9) em 1914, diagnosticando lesões ulcerativas de íleo, cólon ascendente e apêndice, porém as características anatomopatológicas deste acometimento só foram bem entendidas a partir do trabalho de Motta em 1945(21). Diante de um interrogatório sintomatológico dirigido, mais da metade dos pacientes portadores de paracoccidioidomicose irão revelar sintomas digestivos, variando de leves a intensos, sendo em boa parte desses pacientes observadas alterações radiológicas(22). Todos os segmentos do trato digestivo, da boca ao ânus, poderão ser afetados pelo P. brasiliensis, porém são mais comuns nos locais mais ricos em tecido linfóide como o íleo terminal, apêndice e hemicólon direito(1,18,22,23). Este acometimento pode ser segmentar ou difuso, com tendência a caminhar do íleo terminal para o reto, contrariamente à retocolite ulcerativa(18). Lesões de esôfago, estômago e duodeno são bastante raras. Os estudos radiológicos contrastados, incluindo o trânsito intestinal e o enema opaco, são de extrema importância na caracterização e na avaliação da extensão das lesões, assim como no controle pós-tratamento. Eles podem demonstrar tanto alterações funcionais, predominando o trânsito lento, como alterações orgânicas, em que sobressai o espessamento de pregas mucosas. A paracoccidioidomicose não apresenta quadro radiológico específico. No intestino delgado pode ser evidenciado padrão disabsortivo, caracterizado por falta de aderência do contraste, floculação, hipersecreção e fragmentação da coluna de bário(1,18,22,24), porém o padrão predominante é o da perda do relevo mucoso habitual, assumindo aspecto grosseiro e fragmentado (Figura 13). Outros achados incluem rigidez parietal, áreas de estenose e menos freqüentemente fístulas e perfuração(1,18, 22,23). Já no cólon o que sobressai é a irregularidade do relevo mucoso em fases iniciais, seguida por estenoses múltiplas anelares (Figura 14), de contornos lisos ou irregulares, determinando perda de suas haustrações(1,18,23) . Podem ser observadas, ainda, falhas de enchimento regulares, tanto no intestino delgado como no grosso, secundárias a compressão extrínseca por enfartamento ganglionar mesenterial.
A US e a TC são úteis nestes pacientes, em virtude da capacidade desses métodos de avaliar melhor a extensão das lesões abdominais, sua associação em linfonodomegalias, bem como as possíveis coleções intra-abdominais ou intraviscerais. Com o tratamento pode ocorrer acentuação das lesões estenóticas, por causa do processo de cicatrização e fibrose, podendo determinar, assim, uma piora do quadro obstrutivo(1,18). O diagnóstico diferencial da paracoccidioidomicose intestinal inclui neoplasias, linfoma, tuberculose e doença de Crohn.
SISTEMA LINFÁTICO O envolvimento linfonodal é uma das manifestações clínicas mais comuns da paracoccidioidomicose, demonstrando o tropismo eletivo do P. brasiliensis pelo sistema reticuloendotelial. Na descrição inicial desta doença por Lutz, em 1908(25), o envolvimento ganglionar já havia sido mencionado. Clinicamente podem ser observadas linfonodomegalias regionais ou generalizadas, podendo estas ser acompanhadas de linfedema. As cadeias mais comumente afetadas são as do segmento cefálico (Figura 15), seguidas pelas supraclavicular, axilar e abdominal (Figura 16)(26). No segmento cefálico predominam os linfonodos submandibulares, os das cadeias cervical anterior e posterior, os pré e retroauriculares, além dos suboccipitais(1).
Os gânglios acometidos podem apresentar vários padrões, variando de um linfonodo macroscopicamente normal (forma não-supurativa) até linfonodos aumentados de volume (forma pseudotumoral), ou com centro necrótico e tendência a coalescer (forma supurativa)(1,27). Calcificações também podem ser evidenciadas(1,18). A partir da década de 80 a avaliação radiológica dessas alterações ganglionares passou a ser realizada pela US e TC, substituindo a linfografia, por se tratarem de métodos menos invasivos e por fornecerem informações mais fidedignas, permitindo tanto o estudo do linfonodo como das estruturas adjacentes. A TC ainda é preferível pela capacidade de avaliação de cadeias inacessíveis à US, como as mediastinais ou cadeias mais profundas. Os principais diagnósticos diferenciais deste acometimento ganglionar são os distúrbios linfoproliferativos, as metástases e a tuberculose.
CONCLUSÃO Após a maior utilização e o incremento dos métodos de imagem foi possível uma melhor caracterização do acometimento extrapulmonar da paracoccidioidomicose. Na maioria dos casos seus achados radiológicos são incaracterísticos ou não-patognomônicos, porém em quadros arrastados e associados a lesões em outros órgãos, como pulmão e linfonodos, principalmente em regiões onde a paracoccidioidomicose é endêmica, esta suspeita deve ser incluída no diagnóstico diferencial.
REFERÊNCIAS 1. Veronesi R, Focaccia. Veronesi: Tratado de infectologia. 9ª ed. São Paulo, SP: Atheneu, 1997: 1081-11. [ ] 2. Pereira JM, Jacobs F. Um caso de blastomicose cutânea com acessos epilépticos. An Paul Med Cirurg 1919;10:217-9. [ ] 3. Moura LP, Raffin CN, Del Negro GMG, Ferreira MS. Paracoccidioidomicose evidenciando comprometimento medular tratada com sucesso por fluconazol. Arq Neuropsiquiatr 1994;52:82-6. [ ] 4. Da Silva CEAP, Cordeiro AF, Gollner AM, Cupolilo SMN, Filgueiras MQ, Curzio MF. Paracoccidioidomicose do sistema nervoso central. Arq Neuropsiquiatr 2000;58:741-7. [ ] 5. Rodacki MA, De Toni G, Borba LA, Oliveira GG. Paracoccidioidomycosis of the central nervous system: CT findings. Neuroradiology 1995;37:637-41. [ ] 6. Noro F, Marchiori E, Silva ALA. Estudo da paracoccidioidomicose encefálica por tomografia computadorizada. Rev Imagem 1998;20:131-40. [ ] 7. Magalhães ACA, Caramelli P, Silva ED, et al. Magnetic resonance imaging in intracranial paracoccidioidomycosis. J Neuroimaging 1993;3:216-9. [ ] 8. Gasparetto EL, Liu CB, Carvalho Neto A, Rogacheski E. Central nervous system paracoccidioidomycosis: imaging findings in 17 cases. J Comput Assist Tomogr 2003;27:12-7. [ ] 9. Vianna GO. Doença de Posada-Wernicke nas lesões apendiculares. Arq Bras Med 1914;4:336. [ ] 10. Marsiglia I, Pinto J. Adrenal cortical insufficiency associated with paracoccidioidomycosis (South American blastomycosis). Report of four patients. J Clin Endocrinol Metab 1966;26:1109-15. [ ] 11. Faiçal S, Borri ML, Hauache OM, Ajzen S. Addison's disease caused by Paracoccidioides brasiliensis: diagnosis by needle aspiration biopsy of the adrenal gland. AJR 1996;166:461-2. [ ] 12. Kawashima A, Sandler CM, Fishman EK, et al. Spectrum of CT findings in nonmalignant disease of the adrenal gland. RadioGraphics 1998;18:393-412. [ ] 13. Thurston W, Wilson SR. As glândulas adrenais. In: Rumack CM, ed. Tratado de ultra-sonografia diagnóstica. 2ª ed. Rio de Janeiro, RJ: Guanabara Koogan, 1999:367-84. [ ] 14. Pereira M, Vianna GO. A propósito de um caso de blastomycose (piohemia blastomicótica). Arch Bras Med 1911;1:63-83. [ ] 15. Nanni L. Aspectos radiográficos da paracoccidioidomicose óssea. (Tese de Doutorado) Campinas, SP: Faculdade de Medicina da Universidade Estadual de Campinas, 1976. [ ] 16. Baransky MC, Silva AF, Rodrigues D. Lesões ósseas e osteoarticulares. In: Del Negro G, Lacaz CS, Fiorillo AM. Paracoccidiodomicose. São Paulo, SP: Sarvier-Edusp, 1982:211-9. [ ] 17. Silvestre MTA, Ferreira MS, Borges AS, Rocha A, Souza GM, Nishioka SA. Monoartrite do joelho como manifestação isolada de paracoccidioidomicose. Rev Soc Bras Med Trop 1997;30:393-5. [ ] 18. Magalhães A. Paracoccidioidomicose (blastomicose sul-americana). Aspectos radiológicos. Rev Hosp Clín Fac Med São Paulo 1980;35:147-55. [ ] 19. Doria AS, Taylor GA. Bony involvement in paracoccidioidomycosis. Pediatr Radiol 1997;27:67-9. [ ] 20. Castañeda OJ, Alarcón GS, Garcia MT, Lumbreras H. Paracoccidioides brasiliensis arthritis. Report of a case and review of the literature. J Rheumatol 1985;12:356-8. [ ] 21. Motta LC. Granulomatose paracoccidioidica (blastomicose brasileira). VI - intestino. An Fac Med USP 1945;21:205. [ ] 22.Fonseca LC, Mignone C. Paracoccidioidomicose do intestino delgado. Aspectos anátomo-clínicos e radiológicos de 125 casos. Rev Hosp Clín Fac Med São Paulo 1976;31:199-207. [ ] 23. Chojniak R, Vieira RAC, Lopes A, Silva JCA, Godoy CE. Intestinal paracoccidioidomycosis simulating colon cancer. Rev Soc Bras Med Trop 2000;33:309-12. [ ] 24. Laudanna AA, Bettarello A, van Bellen B. South American blastomicosis as a cause of malabsorption and protein-losing enteropathy. Arq Gastroenterol 1975;12:195. [ ] 25. Lutz A. Uma mycose pseudococcidica localisada na bocca e observada no Brazil. Contribuição ao conhecimento das hyphoblastomycoses americanas. Brasil Med 1908;22:121-4, 141-4. [ ] 26. Mendes RP, Marcondes J, Souza LR, et al. Estudo clínico do comprometimento linfático na paracoccidioidomicose. Rev Soc Bras Med Trop 1986;19: 93. [ ] 27. Padilha-Gonçalves A. Localizações ganglionares da micose de Lutz (blastomicose brasileira). J Bras Med 1962;6:444-57. [ ]
Recebido para publicação em 18/7/2003. Aceito, após revisão, em 22/12/2003.
* Trabalho realizado no Serviço de Diagnóstico por Imagem do Hospital das Clínicas da Faculdade de Medicina da Universidade Federal de Goiás (HC-FMUFG), Goiânia, GO. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554