Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 39 nº 6 - Nov. / Dez. of 2006
Vol. 39 nº 6 - Nov. / Dez. of 2006
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Denise Takehana dos Santos, Rubens Chojniak, Eduardo Nóbrega Pereira Lima, Marcelo Gusmão Paraíso Cavalcanti |
|
|
Descritores: Carcinoma espinocelular, Tomografia computadorizada, Tomografia por emissão de pósitrons, Face |
|
|
Resumo:
INTRODUÇÃO O estudo funcional do metabolismo do tumor também deve ser considerado, e para tal a Medicina Nuclear é o exame de eleição(1–3). O exame de tomografia computadorizada (TC) desempenha papel importante na determinação do volume tumoral, pois estas medidas são utilizadas freqüentemente na prática clínica como um dos padrões de resposta à terapia. Há também que se considerar um importante fator relacionado ao comportamento metabólico do tumor, que pode não ser homogêneo(1–3). Com a evolução da medicina nuclear, tornou-se possível fundir as imagens obtidas pela TC com as obtidas pela tomografia por emissão de pósitrons (positron emission tomography – PET), aplicando-se um mecanismo de aquisição de imagens simultâneas no mesmo equipamento, proporcionando, dessa forma, o mapeamento topográfico metabólico da lesão(2). Ainda como vantagem de se utilizar este exame, podemos ressaltar a possibilidade de se determinar uma área de metabolismo aumentado dentro da própria lesão, ou seja, uma área associada à maior atividade mitótica celular. A detecção dessas regiões dentro das lesões anatômicas poderia permitir o mapeamento preciso da região a ser irradiada nos tratamentos por radioterapia; especialmente em casos irressecáveis, que devam ser tratados exclusivamente com radioterapia ou em associação à quimioterapia, a determinação dessa região poderia auxiliar no direcionamento dos feixes de radioterapia na área previamente determinada, destruindo as células em atividade mitótica rapidamente, com a possível melhora da eficácia terapêutica(1–4). O objetivo deste trabalho foi desenvolver um protocolo utilizando a fusão de imagens entre a TC e a PET com 2-[F-18]-fluoro-2-deoxi-d-glucose (18F-FDG), com a finalidade de detectar áreas de maior atividade celular em carcinomas espinocelulares de cabeça e pescoço, obtendo sua correta localização anatômica, e analisar a região de maior concentração do radiofármaco de eleição, classificando-a em cêntrica ou excêntrica.
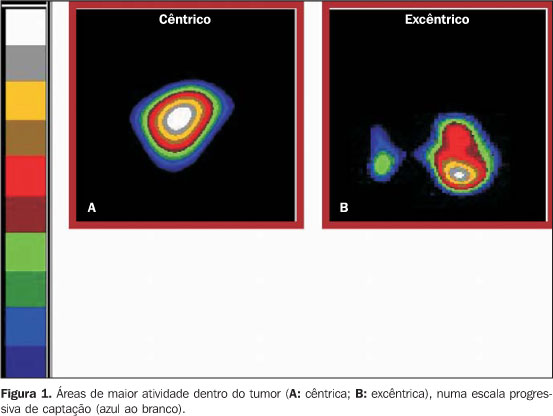
MATERIAIS E MÉTODOS O material da pesquisa foi constituído de 17 exames de imagens de pacientes do Hospital do Câncer – A.C. Camargo, São Paulo, SP (estudo retrospectivo), previamente diagnosticados pelo exame histopatológico como portadores de carcinoma espinocelular da cavidade oral, rinofaringe e orofaringe, classificados de acordo com o critério do American Joint Committee on Cancer (1997) em T2 e T3, com e sem envolvimento de linfonodo (N0 e N1) e sem metástases (M0), portanto, em estágios II e III do grupamento prognóstico (com 66% e 44% de taxa de sobrevivência de cinco anos). Pelo exame histopatológico foram constatados graus I, II e III de diferenciação nas lesões estudadas. Os pacientes foram submetidos ao exame de PET-TC segundo um protocolo que envolve os seguintes passos: Dose Foi administrada injeção de 8–10 mCi (296–370 Bq) do 18F-FDG. Inicialmente, foram realizadas aquisições de imagens da TC (80 cortes transaxiais de 10 mm de espessura) em matriz de 256 × 256 para o co-registro anatômico. Para tal foi utilizado aparelho não dedicado (Millennium VG Hawkeye; GE Medical Systems, Milwaukee, Wis) com um sistema de baixa dose de radiação (140 kV e 2,5 mA) com 384 detectores, no qual cada aquisição leva 14 segundos aproximadamente. Ao término das imagens de TC iniciou-se o processo de registro das imagens por emissão de pósitrons, obtidas 60 minutos após a administração do radiofármaco. Os dados foram disponibilizados de maneira similar às imagens seccionais e adquiridos em dez rotações por 360 graus, durante 30 minutos. A reconstrução interativa das imagens foi realizada após a transferência dos dados para a workstation Entegra 2 NT (GE Medical System), com programa específico para o processamento dos grupos individuais e fusão em um único grupo, contendo os dados fisiológicos e metabólicos originados do 18F-FDG e dos dados anatômicos originados da TC co-registrada. A atenuação das imagens foi corrigida utilizando o algoritmo de correção para TC(5), que é dependente da média de energia do tubo de raios-X (40–130 keV). Os valores dos pixels em unidades Hounsfield foram transformados em coeficiente de atenuação linear em unidades de cm–1 a 511 keV pela média de uma função bilinear definida por três pontos coordenados: –1,000 HU = 0 cm–1; 0 HU = 0,093 cm–1; e 1,326 HU = 0,172 cm–1. Análise qualitativa da amostra Os achados foram definidos como positivo quando houve concentração anômala do 18F-FDG em áreas não consideradas como sendo a biodistribuição normal do radiofármaco. Foram utilizados protocolos e ferramentas específicas do programa, tais como ajustes em janela para estabelecer valores máximos e mínimos de captação dentro da própria lesão. Por meio de um guia de localização foi possível identificar o maior diâmetro da lesão nos planos axial, coronal e sagital simultaneamente. A análise das imagens seguiu uma ordem pré-estabelecida, sendo feita primeiramente em TC co-registrada, passando à imagem do metabolismo da lesão e, finalmente, à análise da fusão das imagens, possibilitando o mapeamento topográfico metabólico da lesão estudada. Um médico nuclear e um radiologista realizaram, individualmente, a interpretação na tela do computador, identificando o sítio de maior atividade metabólica do tumor e classificando em cêntrico ou excêntrico (Figura 1). Para a conclusão final foi feita a análise dos três planos e observou-se a predominância existente, ou seja, caso o sítio de maior concentração do radiofármaco fosse encontrado excentricamente em axial e coronal (por exemplo), então foi considerado excêntrico. Em casos de discordância na interpretação houve o consenso. As informações levantadas foram consolidadas em um banco de dados informatizado e a análise qualitativa dos resultados foi realizada.
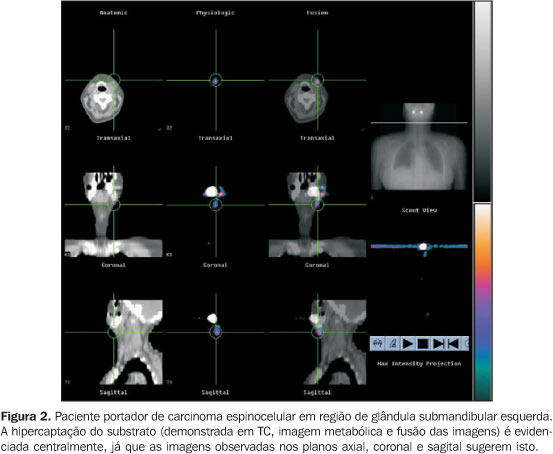
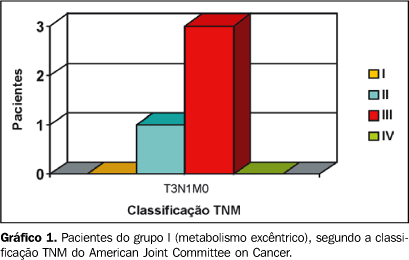
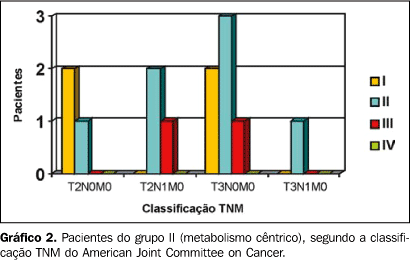
RESULTADOS De acordo com a classificação TNM, do total de pacientes, 11 foram classificados em T3, sendo 4 linfonodos positivos; 6 pacientes estavam em T2, sendo 3 linfonodos positivos. Pelo exame anatomopatológico foram constatados graus I, II e III de diferenciação das lesões estudadas. Em análise das imagens metabólicas visualizadas em planos axial, coronal e sagital em associação ou individualmente, foi possível observar a presença de concentração anômala do 18F-FDG em locais fora da biodistribuição normal do substrato em todos os pacientes. As regiões acometidas foram: fossa nasal, região da órbita, base da língua, soalho da boca e laringe. Em 77% dos casos (n = 13) o sítio de maior hipercaptação do radiofármaco demonstrou estar centralmente localizado (Figura 2). Em 23% dos casos (n = 4) o comportamento do tumor foi diferente, com a hipercaptação excêntrica (Figura 3). Para uma análise didática, esses resultados foram separados em dois quadros, com dados do estadiamento e grau de invasão de cada lesão. No grupo I, sumarizado no Gráfico 1 (hipercaptação excêntrica), todas as lesões foram estadiadas em T3N1M0, sendo classificadas em grau II (uma lesão) e grau III (três lesões) de diferenciação histopatológica. No grupo II houve maior variação, tanto em estadiamento quanto em diferenciação histopatológica, sendo encontrados estádios T2N0M0 (três lesões), T2N1M0 (três lesões), T3N0M0 (seis lesões) e T3N1M0 (uma lesão), e graus I (quatro lesões), II (sete lesões) e III (duas lesões) (Gráfico 2).
DISCUSSÃO Segundo a literatura(2,6), o FDG-PET tem grande habilidade em demonstrar metabolicamente lesões ativas pequenas e também superficiais ou de submucosas que são potencialmente "invisíveis" ao exame clínico e às imagens convencionais. Isto porque, nos estudos de cabeça e pescoço, estruturas de alto metabolismo estão confinadas num espaço relativamente pequeno, e a presença de artefatos e/ou tratamentos prévios podem gerar distorções ou ainda mascarar situações em exames como a TC ou a ressonância magnética. Em trabalho de revisão, alguns autores(7,8) relataram estudo comparativo entre PET dedicada e não dedicada em neoplasias malignas de cabeça e pescoço, com resultados bastante semelhantes em termos de sensibilidade e especificidade de ambos os sistemas; com relação a outras lesões de pulmão, em linfomas e tumores de cérebro, os dados encontrados na literatura não foram passíveis de conclusões definitivas(7). Apesar de poucos trabalhos(9–11) utilizarem exames realizados em gama câmaras de dupla coincidência (PET não dedicada), a sensibilidade encontrada variou entre 64% e 100% e a especificidade variou entre 70% e 100%, sendo que os valores mais altos foram encontrados em estudos da recorrência dos tumores, e os valores mais baixos, para a detecção de sítios primários. Com base na literatura e por questões logísticas justificamos a utilização da gama câmara dupla coincidência na presente pesquisa. Outro estudo que merece destaque(12) foi realizado comparando a fusão de imagens PET-TC e PET obtidas independentemente e analisadas com TC. A vantagem da PET-TC em relação ao custo (menor), diminuição da dose, aumento da confiabilidade na interpretação da imagem ganhou ênfase, assim, é possível dizer que por meio deste exame torna-se fácil distinguir a hipercaptação fisiológica de possíveis lesões malignas. Em nosso estudo, utilizando um aparelho não dedicado, foram obtidas imagens funcionais que posteriormente foram sobrepostas às imagens anatômicas, por meio da reconstrução volumétrica em três dimensões, o que, de acordo com a literatura, pode resultar em aumento substancial da precisão e acurácia do planejamento cirúrgico e/ou radioterápico(22). Na presente pesquisa foi realizada a análise qualitativa das lesões, correlacionando o grau de captação do 18F-FDG a uma escala progressiva de cores, facilitando, dessa forma, a análise, respondendo a duas importantes questões: a) lesão em atividade; e b) atividade metabólica correspondente a processo inflamatório ou malignização das células. Ao escolher o FDG em nosso estudo, essas questões são prontamente respondidas, já que os tecidos não-tumorais, fibróticos ou necróticos terão captação reduzida, ou ausente, enquanto as células em atividade mitótica e as células hipóxicas, resistentes à radiação e que hoje são consideradas um dos grandes desafios aos oncologistas, demonstram elevada avidez ao substrato(13). Além disso, foi possível identificar áreas de maior atividade metabólica dentro do próprio tumor, classificando-as em cêntricas ou excêntricas. Por meio dessa classificação, quatro pacientes (23%) apresentaram lesão com hipercaptação do substrato excentricamente, ou seja, não concentrada ao centro da lesão. Esses pacientes encontravam-se no mesmo estadiamento T3, com linfonodo positivo, e graus II e III (a maioria) de diferenciação. Isso sugere que as lesões poderiam estar em fase de crescimento e infiltração pelos tecidos. Nos outros 13 pacientes (77%), a região de maior atividade metabólica foi localizada ao centro da lesão. Neste grupo, a variação, tanto em estadiamento quanto em diferenciação, foi maior, com lesões em T2N0M0, T2N1M0, T3N0M0 e T3N1M0 e graus I (quatro lesões), II (sete lesões) e III (duas lesões). Isso pode indicar uma lesão madura (bem diferenciada), estando numa fase mais lenta de crescimento. Se fossem pacientes em pós-tratamento, poder-se-ia sugerir que essa concentração ao centro da lesão ocorresse graças às células hipóxicas (com capacidade de sobreviver longe do suprimento sanguíneo). Finalmente, essa hipercaptação central poderia ainda ser atribuída ao metabolismo celular devido à produção de queratina, ou seja, células diferenciadas, porém não passíveis de sofrer mitose. Esta análise nos permite concordar com trabalhos da literatura que ressaltam que os planejamentos radioterápicos poderiam ser mais eficientes se o planejamento funcional também fosse levado em consideração(13–15) . Mesmo num estudo como este, em que a amostra foi pequena, mais de 20% dos casos mostraram comportamento diferente do esperado, ou seja, em quatro pacientes o sítio de maior atividade celular não correspondeu ao centro da lesão. Na ausência dessas informações, o "alvo" da isodose de maior fração a ser aplicada seria ao centro da lesão, como acontece em geral (mesmo utilizando programas conformacionais de última geração), o que daria margem a uma resposta terapêutica lenta, ou ainda aumentaria a chance daquelas células que estão ativas em região excêntrica conseguirem uma infiltração rápida pelos tecidos circunvizinhos. Em nossa opinião, estudos futuros devem ser realizados para maiores esclarecimentos e confirmação das teorias sobre o alto metabolismo cêntrico versus alto metabolismo excêntrico. Também é de grande interesse que se busquem tecnologias de última geração, combinando o PET à TC multslice, o que poderia trazer outras contribuições. Desse modo, entendemos que a presente pesquisa seja um estudo preliminar, porém, sugere que a fusão de imagens entre o 18F-FDG-PET e a TC possa servir como guia para o mapeamento topográfico metabólico de lesões malignas, aumentando as opções de tratamento, e, sem dúvida, melhorando a sobrevida do paciente.
REFERÊNCIAS 1. Lima ENP. Aspectos práticos de medicina nuclear em oncologia. In: Kowalski LP, Anelli A, Salvajoli JV, Lopes LF. Manual de condutas diagnósticas e terapêuticas em oncologia. 2ª ed. São Paulo, Âmbito, 2002;69–75. [ ] 2. Anzai Y, Carroll WR, Quint DJ, et al. Recurrence of head and neck cancer after surgery of irradiation: prospective comparison of 2-deoxy-2-[F-18] fluoro-D-glucose PET and MR imaging diagnoses. Radiology 1996;200:135–141. [ ] 3. Penfold CN, Partridge M, Rojas R, Langdon JD. The role of angiogenesis in the spread of oral squamous cell carcinoma. Br J Oral Maxillofac Surg 1996;34:37–41. [ ] 4. Leopoldino DD, Marques EF, Chojniak R. Imagem em oncologia. In: Kowalski LP, Anelli A, Salvajoli JV, Lopes LF. Manual de condutas diagnósticas e terapêuticas em oncologia. 2ª ed. São Paulo: Âmbito, 2002;64–69. [ ] 5. Kinahan PE, Hasegaqa BH, Beyer T. X-ray based attenuation correction for positron emission tomography/computed tomography scanners. Semin Nucl Med 2003;3:166–179. [ ] 6. Assar OS, Fishbein NJ, Caputo GR, et al. Metastatic head and neck cancer: role and usefulness of FDG PET in locating occult primary tumors. Radiology 1999;210:177–181. [ ] 7. Shreve P, Steventon R, Deters E, Kison P, Gross M, Wahl R. Oncologic diagnosis with 2-[fluorine-18]fluoro-2-deoxy-d-glucose imaging: dual-head coincidence gamma camera versus positron emission tomographic scanner. Radiology 1998;207: 431–437. [ ] 8. Ak I, Blockland JAK, Pauwels EKJ, Stokkel MPM. The clinical value of 18F-FDG detection with a dual-head coincidence camera: a review. Eur J Nucl Med 2001;28:663–678. [ ] 9. Stokkel MP, Terhard CH, Hordijk GJ, van Rijk PP. The detection of local recurrent head and neck cancer with fluorine-18 fluorodeoxyglucose dual-head positron emission tomography. Eur J Nucl Med 1999;26:767–773. [ ] 10. Pai M, Park CH, Suh JH, Koh JH. Fluorine-18 fluorodeoxyglucose imaging using dualhead coincidence positron emission tomography without attenuation correction in patients with head and neck cancer. Clin Nucl Med 1999;24:495–500. [ ] 11. Zimny M, Nowak B, Di Martino E, Jaenicke S, Cremerius U, Buell U. Hybrid PET vs. conventional imaging in the diagnosis of head and neck tumors. J Nucl Med 2000;41:292P. [ ] 12. Goerres GW, Von Schultheness GK, Steinert HC. Why most PET of lung and head and neck cancer will be PET/CT. J Nucl Med 2004;45:66S–71S. [ ] 13. Nishioka T, Shiga T, Shirato H, et al. Image fusion between 18F-FDG-PET and MRI/CT for radiotherapy planning of oropharyngeal and nasopharyngeal carcinomas. Int J Radiat Oncol Biol Phys 2002;53:1051–1057. [ ] 14. Bradley JD, Perez CA, Dehdashti F, Siegel BA. Implementing biologic target volumen in radiation treatment planning for non-small cell lung cancer. J Nucl Med 2004;45:96S–101S. [ ] 15. Stuckensen T, Kovács AF, Adams S, Baum RP. Staging of the neck in patients with oral cavity squamous cell carcinomas: a prospective comparison of PET, ultrasound, CT and MRI. J Craniomaxillofac Surg 2000;28:319–324. [ ]
Recebido para publicação em 16/3/2006.
* Trabalho realizado no Departamento de Imagem do Hospital do Câncer A.C. Camargo e no Departamento de Estomatologia da Faculdade de Odontologia da Universidade de São Paulo, São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554