Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 39 nº 6 - Nov. / Dez. of 2006
Vol. 39 nº 6 - Nov. / Dez. of 2006
|
EDITORIAL
|
|
|
|
|
Autho(rs): Marcelo Souto Nacif, Amarino Carvalho de Oliveira Júnior, Denise Madeira Moreira, Mônica Regina Nagano, José Hugo Mendes Luz, Mauro Esteves de Oliveira, Arnaldo Rabischoffsky, José Feldman, Carlos Eduardo Rochitte |
|
|
VCoordenador do Serviço de Ecocardiografia do Hospital Pró-Cardíaco
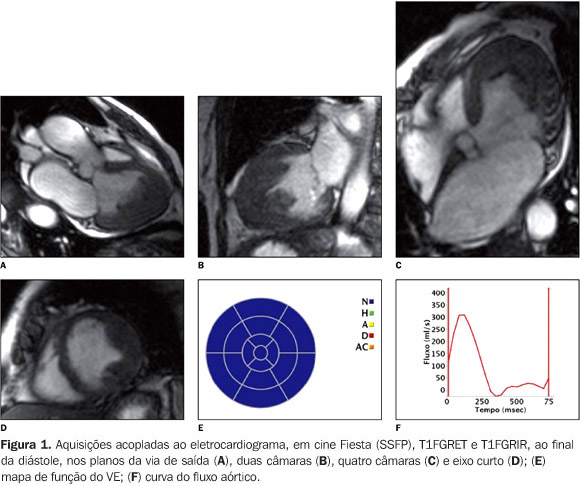
Paciente de 66 anos de idade, sexo feminino, com 59 kg de peso, 1,65 m de altura, 74 bpm, pressão arterial de 140/80 mmHg, foi encaminhada para o Serviço de Radiologia e Diagnóstico por Imagem do Hospital Pró-Cardíaco para a realização de ressonância magnética (RM) do coração. Possuía, na época, ecocardiograma (ECO) que mostrava função sistólica global do ventrículo esquerdo (VE) normal (fração de ejeção – Simpson = 63%). Descrição das imagens Figura 1 – Aquisições acopladas ao eletrocardiograma, em cine Fiesta (SSFP), T1FGRET e T1FGRIR, ao final da diástole, nos planos da via de saída (A), duas câmaras (B), quatro câmaras (C) e eixo curto (D); (E) mapa de função do VE; (F) curva do fluxo aórtico. Observar que o átrio e o ventrículo direito (VD) são de tamanhos normais, com suas funções global e segmentar preservadas. Existe preenchimento apical da cavidade ventricular esquerda com função segmentar basal e medial do VE preservada. Mínima regurgitação mitral e aumento do volume do átrio esquerdo, além de insuficiência aórtica leve.
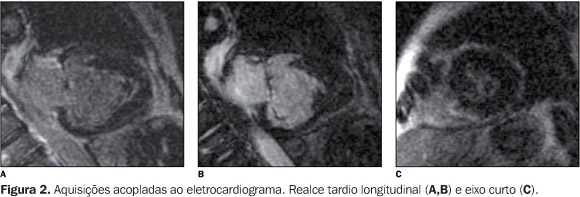
Figura 2 – Aquisições acopladas ao eletrocardiograma, realce tardio longitudinal com calcificação (trombo) central (A), longitudinal (B) e eixo curto (C). Foi identificado defeito perfusional subendocárdico da ponta e realce subendocárdico tardio da superfície de preenchimento apical do VE. Presença de imagem hipointensa central nesta região, que pode corresponder a trombo/calcificação aderido.
Diagnóstico: Endomiocardiofibrose com calcificações grosseiras e função normal do VE. Insuficiência aórtica leve.
COMENTÁRIOS A endomiocardiofibrose, descrita inicialmente por Davies, em 1948, é uma entidade complexa, de etiologia não claramente determinada, endêmica em vários países tropicais, com formas variadas de apresentação, representando, em algumas regiões, a principal causa de miocardiopatia restritiva. Podem ser considerados possíveis fatores etiológicos: dieta rica em alimentos com serotonina, desnutrição, filariose e doenças virais(1–6). A endomiocardiofibrose é caracterizada (Quadro 1) pela formação de tecido fibroso no endocárdio, mais freqüentemente localizada no ápice do ventrículo acometido, o que, angiograficamente, caracteriza a imagem típica de amputação de ponta de VD e VE. Eventualmente, a fibrose se estende para o miocárdio, sendo que a presença de calcificação endocárdica maciça, qualquer que seja a sua etiologia, é achado raro na literatura, podendo se tornar um marcador diagnóstico e prognóstico da doença(1,6–11).
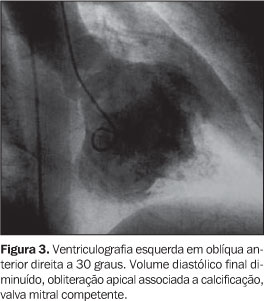
Na endomiocardiofibrose, as manifestações clínicas dependem da forma e da intensidade do acometimento cardíaco. A fibrose, dificultando o relaxamento ventricular, pode provocar insuficiência cardíaca restritiva. A presença de insuficiência valvar acentua muito essas manifestações. As manifestações clínicas diferem conforme o acometimento das câmaras cardíacas, sendo um predomínio direito, esquerdo ou de ambas(1,3,9,12–15). Todos os exames de imagem, radiografia do tórax, ECO, medicina nuclear, ressonância magnética e estudo hemodinâmico identificam as mudanças de forma ventricular e permitem o reconhecimento e a intensidade da câmara acometida(4,6,11,16,17). O ECO demonstra sinais de restrição associados a grande dilatação do átrio e obliteração das câmaras ventriculares e levantam a suspeita de endomiocardiofibrose(4,14,18). O ECO deveria ser o melhor método propedêutico para o diagnóstico de endomiocardiofibrose; no entanto, por esta se tratar de doença rara, nem sempre é lembrada e há evidências de que a ecocardiografia subestima a intensidade da fibrose e não identifica as formas leves(5,6,10–12,19). O estudo hemodinâmico com angiografia é considerado ainda o padrão-ouro para diagnóstico da endomiocardiofibrose, somente pela sua grande experiência acumulada ao longo dos anos (Figura 3). Mas devemos lembrar que a RM do coração já está se mostrando um método de grande valor diagnóstico(1,4,5,8,13).
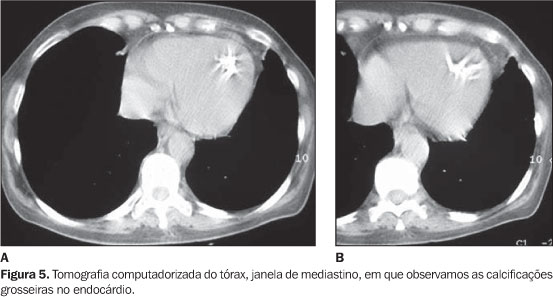
Os dados pressóricos, com as curvas de pressão ventricular apresentando aspecto em "raiz quadrada", identificam a restrição cardíaca, enquanto a angiografia demonstra a amputação da ponta e da via de entrada, a dilatação da via de saída, o aumento dos átrios e os sinais de insuficiência das valvas atrioventriculares. Os dados fornecidos pelo estudo hemodinâmico são também importantes para avaliar o grau de comprometimento cardíaco, sendo isso de importância prognóstica(6,8,13,17,18). A importância de seu diagnóstico decorre do fato de a endomiocardiofibrose sintomática ter mau prognóstico, fato documentado desde as primeiras publicações sobre a doença. Temos observado que os portadores de endomiocardiofibrose, predominantemente do VE, são mais freqüentemente assintomáticos e que a doença tem boa evolução, mesmo naqueles com importante fibrose ventricular. Nesses casos, a presença de insuficiência mitral é fator determinante de sintomas(11,15,17,18). A cirurgia modifica a história natural da doença, reduzindo os sintomas e a mortalidade. Os pacientes assintomáticos devem ser mantidos apenas com acompanhamento clínico, por apresentarem boa evolução, especialmente aqueles com comprometimento isolado do VE(10–13,16,18). Sinais de restrição ao enchimento ventricular Alteração na movimentação da parede posterior do VE – Na parede posterior do VE observa-se movimento protodiastólico rápido seguido de retificação no resto do período, quase sempre sem a expansão telediastólica normal secundária ao volume oferecido pela contração atrial. Este é um sinal de restrição diastólica também freqüentemente encontrado na pericardite constritiva. Curiosamente, ao contrário do que poderia se supor, este movimento da parede posterior do VE não é exclusivo da endomiocardiofibrose esquerda isolada ou biventricular, podendo ser visto nas formas isoladas de endomiocardiofibrose direita(5,11,15,17). Diagnóstico diferencial Na endomiocardiofibrose direita deve ser estabelecido diagnóstico diferencial com pericardite constritiva e doença de Ebstein. Alguns sinais são comuns às três doenças, como alteração na movimentação do septo interventricular, abertura pré-sistólica da veia pulmonar, fluxo diastólico anterógrado na via de saída do ventrículo direito e dilatação do átrio direito. Vale a pena enfatizar que na pericardite constritiva a valva tricúspide é estruturalmente normal, e não há razão para que a via de saída do ventrículo direito se dilate. Na doença de Ebstein não há sinais de restrição, e o folheto anterior da valva tricúspide é redundante. Além disso, na doença de Ebstein o refluxo tricúspide possui localização mais apical, ao contrário da endomiocardiofibrose, cujo refluxo é lento e sem localização bem definida(1,3,8,9,12,19). Na endomiocardiofibrose esquerda o diagnóstico diferencial deve ser feito com outras etiologias de insuficiência mitral, em especial com a febre reumática. Nesta situação, a diferenciação é relativamente fácil, já que ocorre espessamento e aderência entre os folhetos da valva mitral. Nas cardiomiopatias dilatadas com regurgitação funcional e eventual formação de trombo apical, a hipocontratilidade é difusa e o aspecto estrutural da valva é normal. Nas tromboses apicais das miocardites chagásicas crônicas ou das cardiopatias isquêmicas, a parede é acinética ou apresenta movimentação discinética, o que não acontece na endomiocardiofibrose(1,2,4,5,11,16,18) . No presente caso, o ECO (Figura 4) já havia demonstrado sinais de preenchimento da ponta do VE com preservação da contração e com função sistólica normal. Posteriormente, pudemos observar a tomografia computadorizada do tórax da paciente (Figura 5), que demonstrou as calcificações grosseiras endocárdicas.
A RM do coração, atualmente, é superior no estudo da espessura do miocárdio, da sua função e da perfusão do VE, possibilitando a avaliação do realce miocárdico, fator de grande importância para vários diagnósticos em doenças cardíacas. O importante, em nosso serviço, é que o desenvolvimento das tecnologias trouxe a possibilidade do trabalho multidisciplinar e integração entre os diversos métodos na cardiologia, fazendo com que os radiologistas participem de forma ativa das discussões clínicas e se dediquem ao estudo das doenças cardíacas, auxiliando de forma importante as decisões diagnósticas e terapêuticas na área.
REFERÊNCIAS 1. Barretto ACP, Luz PL, Oliveira SA, et al. Determinants of survival in endomyocardial fibrosis. Circulation 1989;80:I177–182. 2. Borggrefe M, Block M, Breithardt G. Identification and management of the high risk patient with dilated cardiomyopathy. Br Heart J 1994;72(6 Suppl):S42–45. 3. Chan WL, Chiang BN, Kong CW, Lee JB, Wang SP, Hsu TL. Endomyocardial fibrosis with massive endocardial calcific deposits. Clin Cardiol 1987;10:541–545. 4. Metras D. Endocardial fibrosis and its surgical treatment: Ivory Coast experience. In: Valiathan MS, Somers K, Kartha CC, editors. Endomyocardial fibrosis. Delhi: Oxford University Press, 1993; 211. 5. Richardson P, McKenna W, Bristow M, et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology. Task Force on the Definition and Classification of cardiomyopathies. Circulation 1996;93:841–842. 6. Wynne J, Braunwald E. The cardiomyopathies and myocarditis. In: Braunwald E, editor. Heart disease. A textbook of cardiovascular medicine. Philadelphia/London: WB Saunders/Elsevier, 2005. 7. Chopra P, Narula J, Talwar KK, Kumar V, Bhatia ML. Histomorphologic characteristics of endomyocardial fibrosis: an endomyocardial biopsy study. Hum Pathol 1990;21:613–616. 8. Kinare SG, Deshpande JR. Endomyocardial fibrosis outside Kerala: an autopsy study. In: Valiathan MS, Somers K, Kartha CC, editors. Endomyocardial fibrosis. Delhi: Oxford University Press, 1993; 141–149. 9. Moraes AV, Medeiros CCJ, Abensur H, et al. Ecocardiografia transesofágica intraoperatória na cirurgia cardíaca: experiência inicial. Rev Bras Eco 1992;15:5–11. 10. Oliveira SA, Pereira Barretto AC, Mady C, et al. Surgical treatment of endomyocardial fibrosis: a new approach. J Am Coll Cardiol 1990;16:1246–1251. 11. Stillman AE, White RD. Adult heart disease excluding myocardial ischemia and viability. In: Edelman RR, Hesselink JR, Zlatkin MB, Crues JV, editors. Clinical magnetic resonance imaging. Philadelphia/London: WB Saunders/Elsevier, 2006;1016–1039. 12. D'Arbela PG, Mutazindwa T, Patel AK, Somers K. Survival after first presentation with endomyocardial fibrosis. Br Heart J 1972;34:403–407. 13. Dave T, Narula JP, Chopra P. Myocardial and endocardial involvement in tuberculous constrictive pericarditis: difficulty in biopsy distinction from endomyocardial fibrosis as a cause of restrictive heart disease. Int J Cardiol 1990;28:245–251. 14. Mady C, Barretto ACP, Oliveira SA, Stolf N, Bellotti G, Pileggi F. Evolution of the endocardial fibrotic process in endomyocardial fibrosis. Am J Cardiol 1991;68:402–406. 15. Ribeiro PA, Muthusamy R, Duran CM. Right-sided endomyocardial fibrosis with recurrent pulmonary emboli leading to irreversible pulmonary hypertension. Br Heart J 1992;68:326–329. 16. Gupta PN, Valiathan MS, Balakrishnan KG, Kartha CC, Ghosh MK. Clinical course of endomyocardial fibrosis. Br Heart J 1989;62:450–454. 17. Pereira Barretto AC, Mady C, Arteaga E, et al. Quadro clínico da endomiocardiofibrose. Correlação com a intensidade da fibrose. Arq Bras Cardiol 1988;51:401–405. 18. Moraes CR. Early and late results of surgery for endomyocardial fibrosis. In: Olsen EGJ, Sekiguchi M, editors. Restrictive cardiomyopathy and arrhythmias. Tokyo: University of Tokyo Press, 1990;49. 19. Oliveira SA, Barretto ACP, Pillegi F, et al. Endomiocardiofibrose. Uma nova abordagem cirúrgica. Arq Bras Cardiol 1990;54:157.
Trabalho realizado no Hospital Pró-Cardíaco, Rio de Janeiro, RJ. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554