Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 39 nº 2 - Mar. / Abr. of 2006
Vol. 39 nº 2 - Mar. / Abr. of 2006
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Sérgio Carlos Barros Esteves, Antonio Carlos Zuliani de Oliveira, Herbeni Cardoso, Eduardo Komai Tagawa, Márcio D'Império, Roberto Castelo |
|
|
Descritores: Câncer de próstata, Braquiterapia, Radioterapia intersticial |
|
|
Resumo:
INTRODUÇÃO A braquiterapia, depois da cirurgia, foi a modalidade terapêutica de maior impacto para os tumores sólidos no início do século 20. Naquele momento, os equipamentos de teleterapia (radioterapia externa) eram de baixa energia e não conseguiam doses adequadas na profundidade. Enquanto isso, a braquiterapia proporcionava altas doses concentradas em volumes restritos, fazendo com que as estruturas normais adjacentes recebessem baixas doses de radiação. O primeiro implante de próstata nos Estados Unidos foi no Memorial Hospital, em outubro de 1915, realizado por Barringer, que utilizou agulhas de rádio colocadas através do períneo e guiadas pelo toque retal. Havia muita dificuldade técnica em relação ao isótopo radioativo. O profissional se expunha à radiação, o decaimento produzia gases tóxicos e não se conseguia uma distribuição adequada do material em toda a próstata. A partir da Segunda Guerra Mundial, ocorreu um grande avanço tecnológico com o surgimento de novos elementos radioativos e desenvolvimento de equipamentos com maiores energias e capacidade de penetração. O acelerador linear parecia capaz de resolver o problema do tratamento do carcinoma da próstata. Porém, a dose máxima tolerável para se ter os níveis aceitáveis de complicações (aproximadamente 5%) está entre 6.500 e 7.000 cGy. Com a braquiterapia pode-se alcançar o nível de dose duas vezes maior para as mesmas taxas de complicações. Atualmente, as duas técnicas (teleterapia e braquiterapia) estão mais evoluídas. De um lado, a conformacional, com planejamentos em três dimensões, permite atingir doses mais elevadas (~8.000 cGy) com baixa toxicidade(1), e de outro, a braquiterapia, com fontes em miniatura guiadas por controle remoto, determina a maior precisão da técnica, sem qualquer exposição do médico e paramédicos à radiação. O implante da próstata pode ser permanente ou temporário. No permanente, os isótopos mais utilizados no momento são o paládio-103 e o iodo-125. Neste estudo, foram usados implantes temporários com irídio-192, utilizando equipamento de braquiterapia de alta taxa de dose (BATD) associada à teleterapia (conformacional). Vários centros mundiais, como Kiel, na Alemanha, Seatle, em Washington, Royal Oak, em Michigan e Long Beach, na Califórnia, passaram a utilizar a BATD no tratamento do carcinoma da próstata a partir dos anos 80(2). No Brasil, alguns serviços já trataram centenas de pacientes com o método. O objetivo deste estudo foi avaliar a taxa de resposta bioquímica do antígeno prostático específico (PSA), a influência de diversas variáveis (idade, volume da próstata, PSA, Gleason, estadiamento, risco, hormonioterapia) no controle bioquímico e as complicações agudas e subagudas dos procedimentos de acordo com a graduação da Radiation Therapy Oncology Group (RTOG)(3).
MATERIAIS E MÉTODOS Este estudo clínico, de caráter prospectivo, incluiu pacientes portadores de carcinoma da próstata com expectativa de vida > 10 anos e Karnofsky > 70(4), estádio clínico T1 a T3, com exames de estadiamento e volume prostático < 60 cm³. Foram excluídos os pacientes submetidos a tratamento prévio (radioterapia completa e/ou cirurgia), estádio clínico T4, volume prostático > 60 cm³ e Karnofsky < 70. No período de fevereiro de 1998 a julho de 2001, 46 pacientes foram tratados com radioterapia, associando-se teleterapia com BATD. A idade variou de 51 a 79 anos (média de 66,4 anos). Trinta pacientes foram estadiados como T1c, sete como T2a, oito como T2b e um como T3a. Todos os pacientes apresentaram como tipo histológico o adenocarcinoma, com a seguinte distribuição do valor do Gleason (somatório): Gleason 2, um paciente; Gleason 3, dois pacientes; Gleason 4, seis pacientes; Gleason 5, dez pacientes; Gleason 6, 17 pacientes; Gleason 7, sete pacientes; Gleason 8, dois pacientes; o Gleason ficou desconhecido em apenas um paciente. O PSA inicial variou de 3,4 a 33,1. O volume da próstata pré-tratamento variou de 15 a 67 (volume médio = 32,3 cc). Treze pacientes foram submetidos a tratamento hormonal prévio (apenas como neo-adjuvância), sendo bloqueio central em três pacientes, periférico em nove e completo em três. Considerando-se o risco, de acordo com a Tabela 1, oito foram classificados como alto risco, 16 como risco intermediário e 12 como baixo risco(5,6).
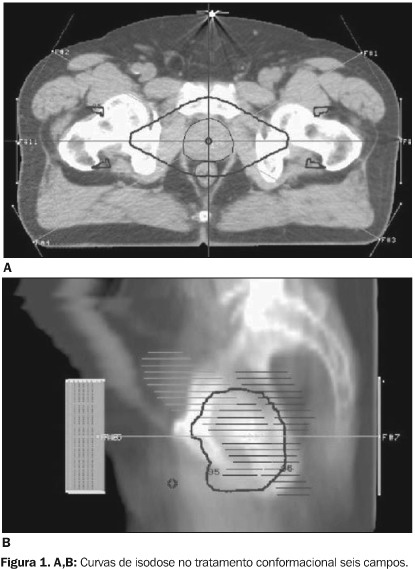
A dose de radiação externa foi de 5.040 cGy em 28 aplicações de 180 cGy, usando-se acelerador linear de 6 MV de energia de fótons e técnica de tratamento conformacional. Realizaram-se seis campos de tratamento diários com colimadores "multifolhas" ou colimadores próprios (Figura 1).
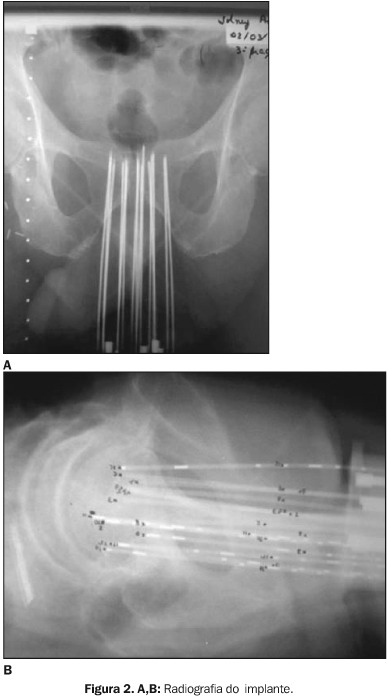
Para o implante de braquiterapia, o paciente é internado um dia antes e submetido a tricotomia e enteroclisma. O paciente recebe bloqueio anestésico (raquianestesia) e é colocado em posição de semilitotomia. Realiza-se exame prostático sob anestesia e ultra-som transretal em planos sagital e coronal para avaliar a presença de lesões e determinação do volume prostático. Segue-se a assepsia e colocação de sonda vesical Foley 14-16. O agulhamento é guiado pelo ultra-som transretal e pelo "template" perineal. A distribuição das agulhas é realizada em todo o volume prostático de forma simétrica, identificando-se agulha por agulha, bem como sua extensão no interior da próstata. Após a colocação das agulhas, o "template" é fixado com pontos de sutura no períneo do paciente. Marcadores são inseridos nas agulhas e são feitas radiografias em ântero-posterior e perfil (Figura 2).
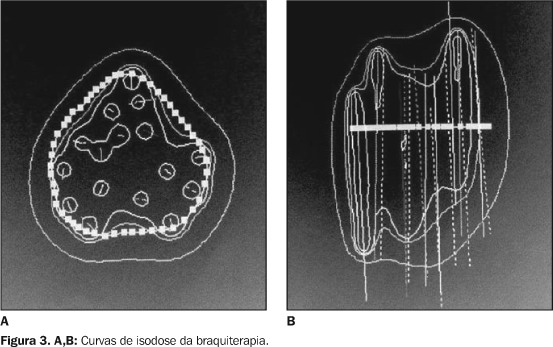
Os dados são levados para o computador, onde se calcula a melhor distribuição das fontes e a dose a ser dada no volume-alvo (Figura 3).
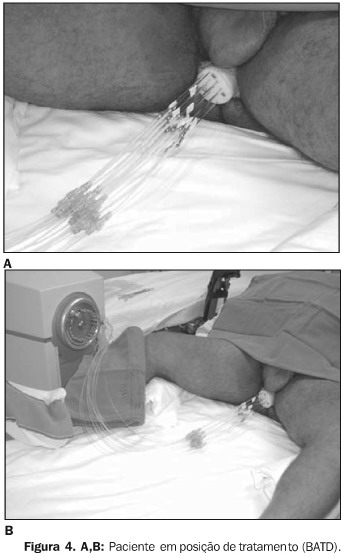
As agulhas são conectadas ao equipamento de braquiterapia e aplicadas quatro frações de 400 cGy, com intervalo mínimo de seis horas. O paciente recebe antibiótico e analgésicos (Figura 4).
Ao término do tratamento, o "template" é retirado com as agulhas, com compressão local para hemostasia. A braquiterapia foi realizada entre 10 e 15 dias após o término da teleterapia, com exceção de dois pacientes, que foram submetidos à braquiterapia antes da teleterapia. O volume do implante (volume-alvo) de braquiterapia foi menor que 50 cc em 43 pacientes (93,5%) e maior que 50 cc em três pacientes (6,5%). A análise da resposta bioquímica iniciou-se dentro de um mês após o término da radioterapia e posteriormente a cada três meses no primeiro ano, passando para quatro meses no segundo ano. Para os pacientes que evoluíram com PSA satisfatório, o controle passou a ser semestral. As variáveis analisadas em relação ao controle bioquímico foram: idade, grau histológico (Gleason), estádio clínico, valor do PSA, volume prostático, uso de hormonioterapia e risco da doença (alto, intermediário e baixo). A análise descritiva foi realizada através de tabelas de freqüência para as variáveis categóricas e medidas de posição e dispersão para as variáveis contínuas. Para comparar proporções ou verificar associação, foi utilizado o teste exato de Fisher. Para comparar medidas contínuas ou ordenáveis entre dois grupos, foi utilizado o teste de Mann-Whitney. O nível de significância adotado foi de 5%.
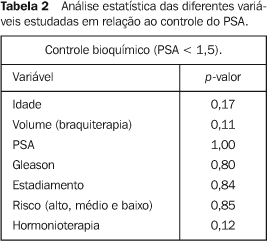
RESULTADOS O seguimento variou de 6 a 43 meses. Dos 46 pacientes tratados com esta técnica de tele e braquiterapia, 38 fizeram seguimento adequado com avaliação do PSA. Quatro pacientes perderam o seguimento e quatro faleceram, sendo um pela doença, um por complicações cardíacas e dois por causas desconhecidas. Entre os 39 pacientes analisados, 26 tiveram nadir do PSA abaixo de 1,0, três ficaram com o PSA entre 1,0 e 1,5, três entre 1,5 e 2,0, seis com PSA maior que 2,0 (entre esses, um chegou a ter PSA < 1,0). Considerando o PSA < 1,5, o controle bioquímico atual está em 76,32% dos pacientes tratados com radioterapia. Entre as variáveis analisadas, nenhuma delas se mostrou estatisticamente significativa em relação ao controle bioquímico, conforme mostra a Tabela 2.
Apenas três pacientes apresentaram toxicidade para o aparelho geniturinário, com grau I em dois pacientes (5,1%) e grau II em um paciente (2,5%).
DISCUSSÃO A BATD é tratamento consagrado na literatura para a terapêutica dos tumores ginecológicos(7) e sua eficácia vem sendo comprovada para outros tumores como os da próstata(8). Estudos recentes avaliando efeitos biológicos da radiação mostram que a alta taxa de dose pode ser superior à baixa taxa de dose, dependendo do tecido alvo(9). A facilidade do método, o baixo custo quando comparado ao implante permanente e sua versatilidade devem ser considerados como vantagens sobre as outras abordagens terapêuticas. O procedimento é muito bem tolerado pelo paciente e as complicações inerentes ao tratamento são muito pequenas. O grupo estudado teve idade média de 66,4 anos, sendo o paciente mais idoso com 69 anos. Este dado mostra que, mesmo com idades mais avançadas, a tolerância é muito boa. A maioria dos pacientes (65,2%) foi estadiada como T1c, fato importante na seleção dos pacientes, pois o subestadiameto é relativamente freqüente, haja vista os achados de anatomopatológico. Certamente, entre estes pacientes estadiados como T1c existem aqueles com doenças mais avançadas. Oitenta por cento dos pacientes apresentaram Gleason < 7. Esta situação é boa para a BATD, pois tumores de baixo grau histológico sofrem maior efeito biológico da BATD(9). Como fator isolado, o PSA esteve abaixo de 10 em 53% dos pacientes tratados. Nestes espera-se menor probabilidade de disseminação da doença. Considerando os outros fatores (estádio e Gleason), estratificamos os pacientes em baixo risco, risco intermediário e alto risco. Notamos que a maioria é de risco intermediário (44%), enquanto 33% são de risco baixo e 22% são de alto risco. Os resultados poderiam ser mais satisfatórios se tivéssemos maior número de pacientes no baixo risco(10). Todas as variáveis analisadas não mostraram nenhuma significância em relação ao controle bioquímico. Este resultado pode estar relacionado ao pequeno número de pacientes estudados, como também ao intervalo de seguimento médio muito curto para a doença em estudo.
REFERÊNCIAS 1. Bagshaw MA, Cox RS, Ramback JE. Radiation therapy for localized prostate cancer. Justification by long-term folow-up. Urol Clin North Am 1990; 17:787–802. [ ] 2. Khan K, Thompson W, Bush S, Stidley C. Transperineal percutaneous iridium-192 interstitial template implant of the prostate: results and complications in 321 patients. Int J Radiat Oncol Biol Phys 1992;22:935–939. [ ] 3. Rubin P, Wasserman TH. International Clinical Trials in Radiation Oncology. The late effects of toxicity scoring. Int J Radiat Oncol Biol Phys 1988; 14(Suppl 1):S29–38. [ ] 4. Schaafsma J, Osoba D. The Karnofsky Performance Status Scale re-examined: a cross-validation with the EORTC-C30. Qual Life Res 1994;3: 413–424. [ ] 5. Zagars GK, Pollack A, von Eschenbach AC. Prostate cancer and radiation therapy – the message conveyed by serum prostate-specific antigen. Int J Radiat Oncol Biol Phys 1995;33:23–35. [ ] 6. Zagars GK, Sherman NE, Babaian RJ. Prostate-specific antigen and external beam radiation therapy in prostate cancer. Cancer 1991;67:412–420. [ ] 7. Arai T, Nakano T, Morita S, Sakashita K, Nakamura YK, Fukuhisa K. High-dose-rate remote afterloading intracavitary radiation therapy for cancer of the uterine cervix. A 20-year experience. Cancer 1992;69:175–180. [ ] 8. Martinez A, Gonzalez J, Stromberg J, et al. Conformal prostate brachytherapy: initial experience of a phase I/II dose-escalating trial. Int J Radiat Oncol Biol Phys 1995;33:1019–1027. [ ] 9. Orton CG. High-dose-rate brachytherapy may be radiobiologically superior to low-dose rate due to slow repair of late-responding normal tissue cells. Int J Radiat Oncol Biol Phys 2001;49:183–189. [ ] 10. Kuban DA, el-Mahdi AM, Schellhammer PF. Prostate-especific antigen for pretreatment prediction and posttreatment evaluation of outcome after definitive irradiation for prostate cancer. Int J Radiat Oncol Biol Phys 1995;32:307–316. [ ]
Recebido para publicação em 30/4/2004.
* Trabalho realizado nos Serviços de Radioterapia e Urologia da Beneficência Portuguesa de São Paulo – Hospital São Joaquim, São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554