Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 39 nº 1 - Jan. / Fev. of 2006
Vol. 39 nº 1 - Jan. / Fev. of 2006
|
ATUALIZAÇÃO
|
|
|
|
|
Autho(rs): Maria Helena Louveira, Cláudio Kemp, Vanessa Sales Vilar, Simone Elias Martinelli, Cristiane Grein Basso Spadoni, Alencar Gracino, Jacob Szejnfeld |
|
|
Descritores: Câncer de mama, Mastectomia, Mamografia, Ultra-sonografia |
|
|
Resumo: IIIMédica Radiologista, Pós-graduanda do Departamento de Diagnóstico por Imagem da Unifesp/EPM
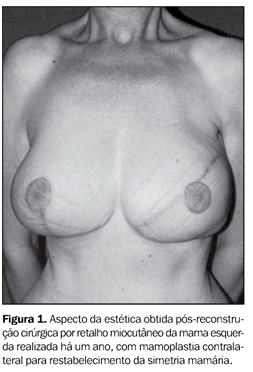
INTRODUÇÃO A reconstrução mamária pós-mastectomia tem sido apresentada como uma opção segura à paciente com câncer de mama, quando a cirurgia conservadora não é indicada. O método tem demonstrado promover melhora na auto-estima da paciente, por restaurar sua feminilidade, e como resultado final, tem-se obtido melhor aceitação do tratamento, sem alterar o prognóstico da doença(1,2). As primeiras técnicas de reconstrução mamária com retalho miocutâneo (RMC) surgiram tão logo foi descrita a mastectomia radical por Halsted em 1889. Nessa época, era utilizado o enxerto livre de pele, que objetivava apenas o fechamento das extensas feridas provocadas pela cirurgia, e só posteriormente passou a ter intuito de restauração da mama(3) (Figura 1).
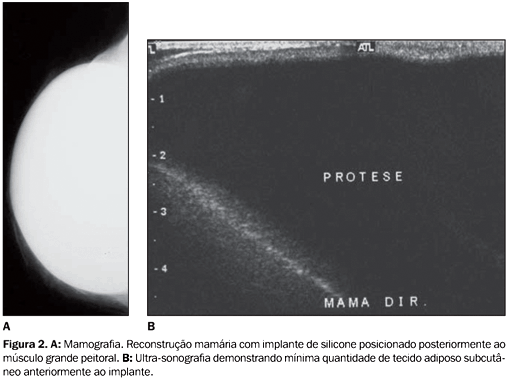
A partir de 1960, com o advento das próteses de silicone utilizadas na mamoplastia de aumento, estas também passaram a ser uma opção para a reconstrução mamária pós-mastectomia. Porém, após questionamentos relacionados à segurança do uso do silicone, que suspenderam temporariamente seu uso nos Estados Unidos, e devido aos relatos de freqüentes complicações como as rupturas, a reconstrução com tecido autólogo utilizando RMC novamente passou a ser uma alternativa(1,3). Outras desvantagens da utilização do implante de silicone incluem o aspecto estético considerado desfavorável e o freqüente surgimento de contraturas capsulares, que ocorrem em cerca de 30% dos casos após os primeiros quatro anos, com tendência a aumentar nos anos subseqüentes(4,5) (Figura 2).
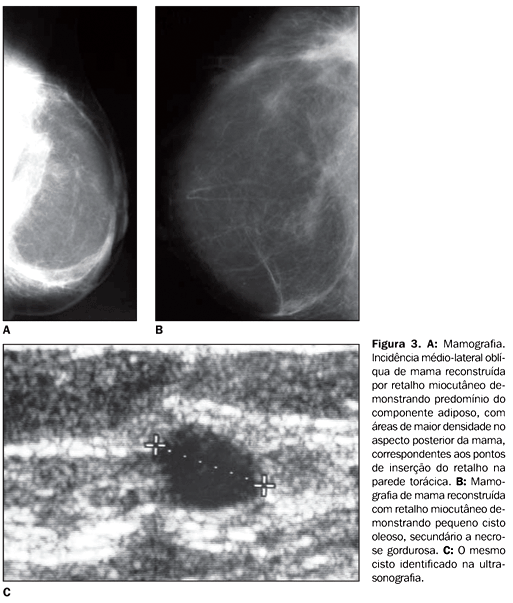
Atualmente, a técnica de reconstrução mamária com RMC mais utilizada é denominada retalho TRAM ("transverse rectus abdominus myocutaneous flap"), a qual foi descrita em 1982 por Hartramnft et al., e consiste na transferência para a parede torácica do músculo reto abdominal juntamente com a pele e o tecido celular subcutâneo, preservando o seu suprimento sanguíneo. Esta técnica permite que o músculo latíssimo dorsal, com a pele e o tecido subcutâneo da parede torácica posterior, possam ser utilizados, porém estes são empregados com menor freqüência(3,6-9). Também a reconstrução com RMC pode apresentar complicações locais ou abdominais, quando se utiliza o músculo reto abdominal. A principal complicação local é a necrose gordurosa, que pode ser extensa a ponto de promover perda de parte do tecido transferido, ao passo que entre as complicações abdominais as que ocorrem com maior freqüência incluem a fraqueza da parede abdominal, predispondo à formação de hérnias de parede, a necrose umbilical e a formação de hematomas e seromas. Complicações relacionadas à necrose gordurosa, seja local ou na parede abdominal, acometem mais freqüentemente pacientes obesas e fumantes(3,5,9) (Figura 3).
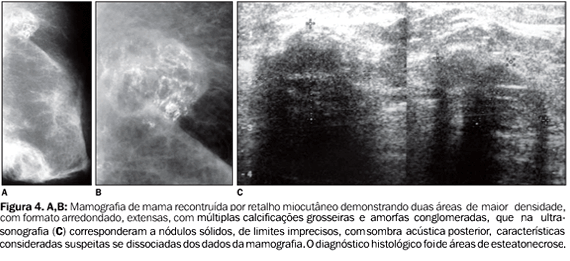
A recorrência do câncer de mama após a reconstrução ocorre em 4-11% das pacientes, principalmente nos primeiros cinco anos após a cirurgia(7,10). Ainda não é certo se a recidiva é resultante de disseminação sistêmica ou local, assim como não é claro o papel da detecção precoce de sinais de recorrência na sobrevida da paciente, uma vez que na literatura as publicações quanto ao acompanhamento e à resposta terapêutica destas pacientes ainda são escassas. Inicialmente acreditava-se que a recorrência loco-regional do câncer na reconstrução seria uma manifestação sistêmica ou metastática da doença. Porém, tem-se demonstrado a presença de pequena quantidade de tecido mamário residual após a mastectomia (em torno de 5%), o que torna possível a permanência de células tumorais na mama com potencial para promover recidiva da doença(7,11,12). Pacientes com lesão intraductal podem ter risco potencialmente maior de recorrência, conforme estudo de Helvie et al.(10). A rotina de acompanhamento das pacientes com reconstrução mamária inicialmente incluía apenas o exame clínico, não se creditando valor à mamografia (MMG) na mama reconstruída, tanto que muitos serviços de MMG não realizam rotineiramente incidências mamográficas da mama reconstruída, a menos que haja solicitação expressa do médico assistente. O exame clínico foi, portanto, por algum tempo, considerado suficiente no seguimento dessas pacientes, suportado pelo fato de que as lesões recidivantes freqüentemente se mostravam localizadas ao nível dos pontos de inserção do retalho ou na cicatriz cirúrgica, o que as tornava acessíveis à palpação(6,12). No entanto, após os primeiros relatos da detecção de sinais de recidiva tumoral em RMC pela MMG, descritos por Mund et al. em 1994, e ainda pela demonstração da capacidade da MMG e da ultra-sonografia (US) em detectar sinais de recorrência local em pacientes mastectomizadas por Rissanen et al., atualmente, o exame clínico associado à MMG são indicados no acompanhamento das pacientes mastectomizadas, principalmente naquelas com reconstrução mamária(6,13,14). Recomenda-se, portanto, a realização de MMG também da mama reconstruída, e o exame deve constar, sempre que possível, das incidências crânio-caudal e oblíqua médio-lateral, podendo ser acrescido de incidências complementares, como compressão focal ou ampliação, na dependência das alterações identificadas. Existe maior dificuldade técnica para o posicionamento dessas pacientes, uma vez que a mama reconstruída caracteristicamente é mais endurecida devido às alterações cicatriciais, e freqüentemente há perda de definição dos tecidos mais periféricos na mama, que podem ficar inacessíveis nas incidências mamográficas habituais. Além disso, pode haver a necessidade de utilização de técnica manual para adequação da kV e mAs, uma vez que a mama é menos compressível, desfavorecendo a utilização de técnica automática. A imagem mamográfica da mama reconstruída é representada por músculo, gordura, estruturas vasculares e pele, sem arranjo ordenado, não se definindo tecido fibroglandular, ductos ou ligamentos de Cooper. Sua composição predominantemente adiposa permite fácil identificação e acompanhamento de pequenas lesões, o que facilita a detecção precoce de sinais da doença na MMG(1,10) (Figura 3). Uma lesão recorrente em mama reconstruída pode manifestar-se na MMG de forma semelhante às lesões que ocorrem na mama normal, ou seja, na forma de nódulos, calcificações agrupadas, assimetria focal ou áreas de distorção da arquitetura, e os campos superiores das mamas parecem ser a mais freqüentemente acometidos(10). A necrose gordurosa é a alteração mais freqüentemente encontrada nas mamas reconstruídas, ocorrendo em cerca de 30% dos casos(14). Esta pode manifestar-se apenas por área de maior densidade na mama reconstruída ou por distorção da arquitetura, podendo estar associada a calcificações distróficas ou a cistos oleosos. Pode ocupar grande extensão da mama e assumir aspecto palpável e endurecido, nestes casos dificultando sua diferenciação clínica de uma lesão tumoral recidivante(1). Também nos métodos de imagem estas duas entidades podem apresentar características que se sobrepõem, e a MMG tem-se mostrado o método mais eficaz para sua distinção. O aspecto característico das calcificações grosseiras e amorfas, o desarranjo arquitetural sem evidências de nódulos e a associação com cistos oleosos na MMG favorecem o diagnóstico de necrose gordurosa(14,15) (Figura 4).
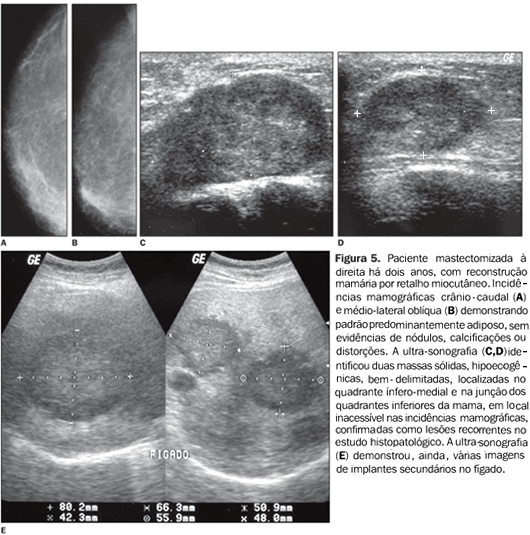
No entanto, alterações mamográficas precoces, tanto relacionadas à necrose gordurosa ou à recorrência, podem ter características indeterminadas em um primeiro estudo, e por vezes, estas só são passíveis de serem esclarecidas em acompanhamento evolutivo ou por meio de estudo histológico(1,12,14-16). Para o diagnóstico final dessas alterações iniciais e incaracterísticas na mama reconstruída, a melhor conduta deve também considerar o aspecto psicológico da paciente, que muitas vezes opta pela biópsia a fim de antecipar o diagnóstico definitivo, pondo fim à sua ansiedade. Também a US tem contribuído para o diagnóstico de lesões recidivantes em mamas reconstruídas, principalmente no acesso a lesões palpáveis ou impalpáveis que se encontrem perifericamente na mama, que muitas vezes não são incluídas no plano de visão mamográfica(11) (Figura 5).
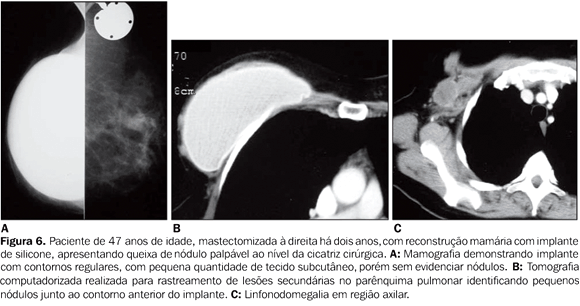
Tem valor como auxiliar da MMG na diferenciação de lesão recorrente de alterações benignas, como áreas de alteração cicatricial ou de necrose gordurosa. Exemplo disso, a US, pela capacidade de demonstrar cistos oleosos, pode facilmente caracterizar uma área de necrose gordurosa que pode não ter representação característica na MMG. As lesões recorrentes se manifestam na US como nódulos, cuja suspeição para malignidade é feita segundo os mesmos critérios utilizados quando da identificação de nódulos no parênquima mamário, e tem sido demonstrado que estes se apresentam mais freqüentemente com o aspecto mais hipoecogênico que a gordura, com contornos irregulares e formato arredondado ou irregular(11). A tomografia computadorizada (TC) e a ressonância magnética (RM) podem ser eficazes no diagnóstico de recorrência tumoral após reconstrução mamária, tanto em reconstruções com próteses quanto por RMC, principalmente pela sua capacidade em demonstrar lesões profundas na mama que se encontrem junto à superfície torácica (Figura 6)(1,11).
Em pacientes com reconstrução cirúrgica da mama e que se apresentem assintomáticas, tem-se preconizado o acompanhamento clínico e por MMG, embora seja reconhecida a eficácia da US em detectar lesões não-palpáveis. Diante de nódulo palpável, o emprego da US e da MMG tem o objetivo de tentar caracterizar lesões benignas, como áreas de necrose gordurosa que tornem desnecessária sua avaliação histológica. No entanto, deve-se estar atento para lesões incaracterísticas nos métodos de imagem, para as quais somente o acompanhamento evolutivo ou a biópsia poderão permitir o diagnóstico final.
CONCLUSÃO Embora não exista consenso quanto à influência do diagnóstico precoce de recorrência do câncer na sobrevida de pacientes mastectomizadas com mamas reconstruídas, atualmente o acompanhamento clínico e por MMG tem sido preconizado como rotina na busca de indícios de lesão recidivante inicial. Já em lesões palpáveis, a MMG e a US podem contribuir para a diferenciação entre alterações benignas, como áreas de esteatonecrose ou de tecido cicatricial e lesão tumoral, em alguns casos tornando desnecessária a avaliação histológica.
REFERÊNCIAS 1. Leibman AJ, Styblo TM, Bostwick J III. Mammography of the postreconstruction breast. Plast Reconstr Surg 1997;99:698-704. [ ] 2. Schain WS, Wellisch DK, Pasnau RO, Landsverk J. The sooner the better: a study of psychological factors in women undergoing immediate versus delayed breast reconstruction. Am J Psychiatry 1985; 142:40-46. [ ] 3. Brenelli HB, Kepkke EM. Reconstrução mamária. In: Basegio DL. Câncer de mama: abordagem multidisciplinar. Rio de Janeiro: Revinter, 1999;210-221. [ ] 4. Munhoz AM, Ferreira MC. Aplicação da microcirurgia na reconstrução mamária imediata. Rev Bras Mastol 2000;10:103-105. [ ] 5. Kroll SS, Baldwin B. A comparison of outcomes using three different methods of breast reconstruction. Plast Reconstr Surg 1992;90:455-462. [ ] 6. Mund DF, Wolfson P, Gorczyca DP, Fu YS, Love SM, Bassett LW. Mammographically detected recurrent nonpalpable carcinoma developing in a transverse rectus abdominus myocutaneous flap. A case report. Cancer 1994;74:2804-2807. [ ] 7. Helvie MA, Bailey JE, Roubinoux MA, et al. Mammographic screening of TRAM flap breast reconstructions for detection of nonpalpable recurrent cancer. Radiology 2002;224:211-216. [ ] 8. Kopans DB. Mama alterada: gravidez, lactação, biópsia, mastectomia, radiação e implantes. In: Kopans DB. Imagem da mama. 2ª ed. Rio de Janeiro: Revinter, 1998;483-484. [ ] 9. Schusterman MA, Kroll SS, Miller MJ, et al. The free transverse rectus abdominis musculocutaneous flap for breast reconstruction: one center's experience with 211 consecutive cases. Ann Plast Surg 1994;32:234-242. [ ] 10. Helvie MA, Wilson TE, Roubidoux MA, Wilkins EG, Chang AE. Mammographic appearance of recurrent breast carcinoma in six patients with TRAM flap breast reconstructions. Radiology 1998;209: 711-715. [ ] 11. Edeiken BS, Fornage BD, Bedi DG, Sneige N, Parulekar SG, Pleasure J. Recurrence in autogenous myocutaneous flap reconstruction after mastectomy for primary breast cancer: US diagnosis. Radiology 2003;227:542-548. [ ] 12. Eidelman Y, Liebling RW, Buchbinder S, Strauch B, Goldstein RD. Mammography in the evaluation of masses in breasts reconstructed with TRAM flaps. Ann Plast Surg 1998;41:229-233. [ ] 13. Rissanen TJ, Mäkäräinen HP, Mattila SI, Lindholm EL, Heikkinen MI, Kiviniemi HO. Breast cancer recurrence after mastectomy: diagnosis with mammography and US. Radiology 1993;188:463-467. [ ] 14. Shaikh N, LaTrenta G, Swistel A, Osborne FM. Detection of recurrent breast cancer after TRAM flap reconstruction. Ann Plast Surg 2001;47:602-607. [ ] 15. Bilgen IG, Ustun EE, Memis A. Fat necrosis of the breast: clinical, mammographic and sonographic features. Eur J Radiol 2001;39:92-99. [ ] 16. Soo MS, Kornguth PJ, Hertzberg BS. Fat necrosis in the breast: sonographic features. Radiology 1998;206:261-269. [ ]
Recebido para publicação em 13/8/2004. Aceito, após revisão, em 7/1/2005.
* Trabalho realizado no Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554