Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 39 nº 1 - Jan. / Fev. of 2006
Vol. 39 nº 1 - Jan. / Fev. of 2006
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Michael Jenwei Chen, Sérgio Luis Faria, Luis Souhami, Tamil Mohammed Niazi, Marie Duclos, Julio Guerra |
|
|
Descritores: Câncer de pulmão de pequenas células, Doença limitada, Radioterapia, Quimioterapia |
|
|
Resumo:
INTRODUÇÃO O tratamento atual do câncer de pulmão de pequenas células com doença limitada (CPPC-DL) inclui a combinação de quimioterapia (QT) e radioterapia (RT) de maneira concomitante, com início precoce da RT torácica(1,2). Desde o final da década de 1960, o papel da QT se tornou crucial no tratamento do CPPC-DL, mostrando benefício sobre a RT torácica exclusiva(3). A percepção de altos índices de recidiva intratorácica após o uso de QT exclusiva, entretanto, trouxe novamente à tona a necessidade de incluir a RT como modalidade de tratamento loco-regional(4), combinando-se ambas as terapêuticas. A despeito do papel bem estabelecido do tratamento combinado, não há consenso acerca de qual a melhor técnica ou modo de prescrição do tratamento irradiante(5), ou de qual o melhor esquema de drogas(6) para esta neoplasia maligna, que ainda possui altos índices de mortalidade(7,8). O objetivo de estudos prospectivos e randomizados é fornecer orientações que possam ser usadas na prática médica diária para melhorar a sobrevida dos casos tratados. Talvez pela seleção dos pacientes e rigidez nas orientações, os melhores resultados vêm de grupos cooperativos que realizam estes estudos. Dados recentes mostram sobrevida mediana de 27,2 meses e sobrevida global (SG) em dois e cinco anos de 54,4% e 27,2%, respectivamente, e que nunca foram antes alcançadas(2). Há, na literatura, poucas publicações com resultados de tratamento combinado de RT e QT para CPPC-DL advindos de uma única instituição. Este artigo reporta uma análise retrospectiva de pacientes portadores de CPPC-DL tratados em um hospital geral, sem uma orientação específica. Tem os objetivos usuais deste tipo de revisão: controle de qualidade da instituição e comparação dos resultados com os publicados na literatura médica.
MATERIAIS E MÉTODOS Foram revistos todos os prontuários dos casos histologicamente confirmados como de CPPC-DL, tratados na McGill University Health Centre, em Montreal (Quebec, Canadá), entre janeiro de 1992 e dezembro de 2002. Todos os pacientes foram tratados com combinação de RT e QT, de forma concomitante ou seqüencial, de acordo com a decisão dos oncologistas e sem uma orientação específica da instituição. Os pacientes foram classificados como tendo doença limitada da forma proposta pelo Veterans Administration Lung Cancer Study Group(9) após exames de imagem incluindo radiografia simples e tomografia computadorizada (TC) de tórax, TC de crânio e cintilografia óssea. Pacientes portadores de lesões pulmonares de grande volume, com acometimento linfonodal supraclavicular contralateral, ou mesmo com derrame pleural e citologia negativa, muitas vezes inelegíveis para estudos clínicos, foram considerados como tendo doença limitada. A QT foi feita com as drogas mais utilizadas na época em que os pacientes foram tratados, incluindo cisplatina (CDDP), carboplatina, VP-16, doxorrubicina e vincristina. Durante o período de dez anos desta análise ocorreram mudanças técnicas na RT. Pacientes em períodos mais antigos foram tratados com aparelhos de cobaltoterapia (Co-60), mudando-se posteriormente para aceleradores lineares de megavoltagem com fótons de 6 a 18 MV de energia. A partir do final de 1995, os pacientes progressivamente deixaram de ser tratados com RT convencional (bidimensional) e passaram a ser tratados com planejamento e RT tridimensional (RT-3D). Na RT-3D, o volume de tratamento (PTV -"planning treatment volume") englobou a doença torácica visível através de exames de imagem e sempre as cadeias de drenagem linfáticas mediastinais. A região supraclavicular foi irradiada somente quando entendida como necessária pelo radioterapeuta. A dose prescrita na maior parte dos casos foi de 45 Gy a 50 Gy, em frações de 1,8 a 2 Gy por dia. Tipicamente, um "plano I" de RT incluiu todo o mediastino e tumor primário em campos opostos até doses de 40 a 44 Gy, seguido de um "plano II" englobando o tumor visível e retirando-se a medula espinhal dos campos de irradiação, até a dose final prescrita. Os casos que receberam irradiação profilática cerebral (PCI)(10) foram tratados com Co-60 ou fótons de 6 MV, com doses de 25 a 30 Gy em frações diárias de 2,5 Gy, em campos cerebrais látero-laterais, poucas semanas após o final da RT torácica. Os pacientes foram seguidos após o término do tratamento, rotineiramente com pelo menos três visitas anuais, sempre com exame físico geral e exames de imagem do tórax. Outros exames (por exemplo: cintilografia óssea, TC de crânio) foram solicitados se necessário, de acordo com os sintomas do paciente. Ao diagnóstico de recidiva, o reestadiamento e o tratamento foram individualizados e a critério médico. Na análise estatística foi utilizado o método atuarial de Kaplan-Meier para cálculo das probabilidades de SG(11). A comparação entre a distribuição de sobrevida dos grupos foi feita pelo teste de log-rank e qui-quadrado(12), considerando valores de significância de 95% ou p < 0,05. Neste estudo, todas as mortes ocorridas foram computadas como causadas pelo câncer.
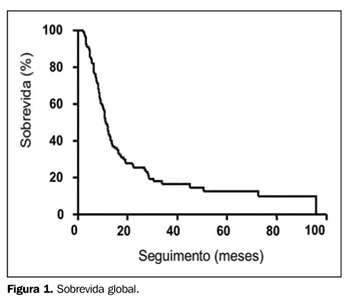
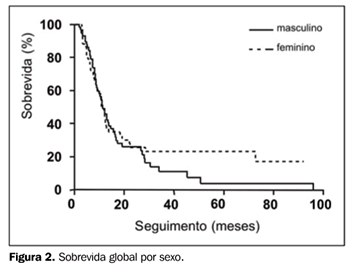
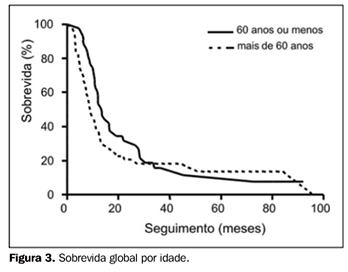
RESULTADOS Foram encontrados e revistos os prontuários de 101 pacientes portadores de CPPC-DL que completaram todo o tratamento proposto em nossa instituição. A idade mediana foi de 63 anos (variando de 37 a 84 anos, desvio-padrão [dp] = 10,1), com 56,4% dos pacientes do sexo masculino e 43,6% do sexo feminino. No momento da análise, em março de 2005, do total de 101 pacientes, 5 haviam sido perdidos de seguimento, 11 permaneciam vivos (com ou sem recidiva) e os restantes 85 pacientes haviam morrido. O seguimento mediano foi de 50,6 meses (variando de 17 a 92 meses) para os pacientes em risco. Do total de 101 casos, 88 puderam ser apropriadamente avaliados quanto ao esquema de QT usado. Em 93,2% dos casos, as drogas usadas foram CDDP, carboplatina e VP-16. Os esquemas mais comumente utilizados foram CDDP + VP-16 (64,8% dos casos), seguido de carboplatina + VP-16 (18,2% dos casos). Vincristina + doxorrubicina + ciclofosfamida (VAC), CDDP + VP-16 + VAC alternados e carboplatina + VP-16 + VAC alternados foram outros esquemas também utilizados (8,8% dos casos), além de outros esquemas combinando CDDP, carboplatina, VP-16 ou VAC com outra droga. O número mediano de ciclos de QT foi de seis (variando de três a seis ciclos, dp = 1,0). Em relação à RT, em 39% dos casos o tratamento iniciou-se após o término da QT, em 44,3% entre os terceiro e sexto ciclos, e em 16,7% dos casos junto com o primeiro ou segundo ciclo. A dose mediana de irradiação administrada foi de 45 Gy em 25 frações. Os campos torácicos, geralmente dois a quatro campos, tiveram tamanho mediano de 13 X 16 cm, nos menores e maiores comprimentos, respectivamente (variando de 8,5 a 23 cm). Receberam PCI 46,5% dos pacientes, com dose mediana de 25 Gy em dez frações. A maioria dos casos que receberam PCI foi de pacientes tratados nos últimos cinco anos do período em análise, coincidente com o de uso rotineiro de RT-3D e de aceleradores lineares de fótons de maior energia (10 e 18 MV). Em relação ao tipo de equipamento utilizado, 14,8% dos pacientes foram tratados com Co-60 ou aceleradores lineares de 6 MV, e os restantes 85,5%, em aceleradores lineares de 10 a 18 MV. A sobrevida mediana de todo o grupo foi de 11 meses. A SG em dois e cinco anos foi de 25,5% e 10%, respectivamente (Figura 1). Comparando-se a população de pacientes do sexo feminino e masculino, a SG em dois anos foi, respectivamente, de 25,6% e 26%, e em cinco anos foi de 17,3% e 3,7% (p = ns) (Figura 2). Comparando-se a população de pacientes com 60 anos ou menos versus a com mais de 60 anos de idade, a SG em dois anos foi de 32% e 20,6%, e em cinco anos foi de 11,7% e 13,7%, respectivamente (p = ns) (Figura 3).
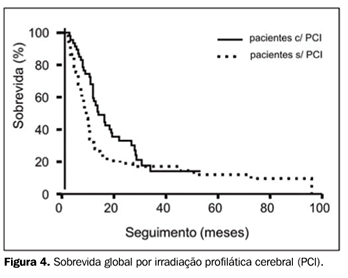
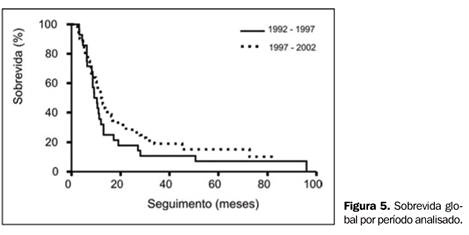
Comparando-se as diferenças de resultado de tratamento entre os períodos de menor ou maior predomínio do uso de RT-3D, as curvas de SG (períodos de 1992 a 1996 e de 1997 a 2002) mostram sobrevida mediana de 9,3 e 12 meses, respectivamente (p = ns) (Figura 4). Quanto ao benefício da adição de PCI ao tratamento combinado, observamos que, para os pacientes tratados com PCI, a sobrevida mediana foi de 13,7 meses, sendo de 9 meses para os pacientes não tratados com PCI (p = ns) (Figura 5).
Do total de prontuários revistos, em apenas 61 (60,4%) o sítio de recidiva inicial pôde ser determinado. Em 49,2% destes casos (30 pacientes) ocorreu recidiva no sistema nervoso central como primeiro local de acometimento (ocorrendo, finalmente, em 38 dos pacientes deste grupo). Em 13,1% dos casos (oito pacientes) ocorreu recidiva intratorácica (pulmonar ou mediastinal), em 6,6% (quatro pacientes) ocorreu recidiva linfonodal (cervical, axilar ou supraclavicular), e recidivas ósseas ocorreram em 24,6% dos casos (15 pacientes, com quatro casos de compressão medular). Outros locais de falha observados foram fígado, cavidade abdominal e pele.
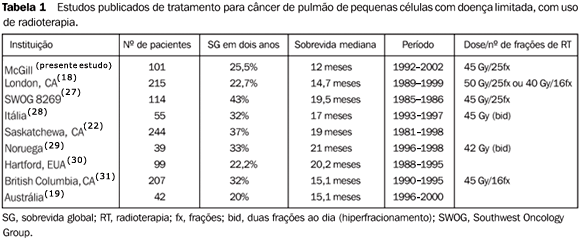
DISCUSSÃO O CPPC-DL é doença pouco freqüente e tem mau prognóstico. Há, por isso, constantes mudanças na forma de tratamento, com o objetivo de melhorar a SG dos pacientes com esta enfermidade. Os resultados publicados variam muito quanto aos resultados de sobrevida obtidos, assim como quanto às formas de tratamento(13,14). Não há consenso sobre a dose, fracionamento, campos e "timing" da RT. Num artigo acerca da utilização da RT no tratamento do câncer de pulmão em instituições médicas dos EUA, Movsas et al.(15) relatam que 14,5% dos pacientes tratados eram portadores de CPPC-DL. Esses pacientes tinham idade mediana de 67 anos, sendo 61% deles do sexo masculino e 38% do sexo feminino. Naquela publicação, 92,3% dos pacientes portadores de CPPC-DL foram tratados com RT e QT concomitantes, comparados a apenas 4,7% dos pacientes tratados com RT exclusiva. A dose mediana aplicada foi de 50,4 Gy, com 81% dos pacientes recebendo de 1,8 a 2 Gy por fração, sendo pouco freqüente o uso de RT hiperfracionada. A análise não avaliou o "timing" da RT torácica, não indicando junto a qual ciclo de QT a RT foi iniciada. No nosso estudo, o fracionamento de RT torácica usado foi semelhante, mas com dose um pouco mais baixa (45 Gy). Quanto ao "timing" da RT em relação à QT, apenas mais recentemente estudos sugerem melhores resultados com início precoce da RT em relação à QT(5,16,17). Ainda hoje alguns pacientes não recebem tratamento de QT e RT concomitantes, por receio de toxicidade importante por parte dos oncologistas responsáveis. Videtic et al.(18) publicaram os resultados do tratamento de 215 pacientes portadores de CPPC-DL, também de forma retrospectiva e tratados em uma única instituição. Os pacientes receberam RT e QT concomitantes, RT iniciada no segundo ou terceiro ciclo de QT, com doses de RT que variaram de 40 Gy em 15 frações e 50 Gy em 25 frações. Relatam SG em dois e cinco anos de 22,7% e 7,2%, respectivamente. Nesse estudo, uma comparação entre os fracionamentos de RT utilizados (hipofracionamento ou fracionamento convencional) não mostrou diferenças em termos de SG, controle local torácico e toxicidade. Em uma casuística menor, igualmente retrospectiva e uni-institucional, Ellis et al.(19) relatam o resultado de 42 pacientes portadores de CPPC-DL. Todos os casos receberam QT, mas apenas 32 foram tratados também com RT, iniciada antes do quarto ciclo de QT, e apenas 7 casos receberam PCI. Nesse pequeno grupo, a sobrevida mediana foi de 15,1 meses e a SG em dois anos foi de 20%. Esses resultados são semelhantes aos obtidos pela nossa revisão, mas inferiores aos publicados por recentes grupos cooperativos, que reportam SG em dois anos entre 47% e 54% e sobrevida mediana entre 21 e 23 meses(2,16,20,21). Há várias possíveis explicações para essas diferenças. Em estudos prospectivos os pacientes são rigidamente selecionados, havendo exclusão de casos com envolvimento de fossa supraclavicular ou derrame pleural com citologia negativa ou mesmo com "performance status" não ideal. É possível também que alguns pacientes com CPPC-DL não sejam estadiados com a rigidez que se tem em estudos prospectivos, e que tenham, de fato, doença disseminada não diagnosticada no início do tratamento. Uma diferença importante entre os pacientes tratados nesta revisão e as recentes publicações dos grupos cooperativos está relacionada à dose, ao fracionamento e ao "timing" da RT. Os melhores resultados estão ligados a tratamentos radioterápicos com fracionamentos alterados e mais curtos (para evitarem-se problemas com a repopulação das células tumorais), introduzidos o mais cedo possível junto com a QT, e também com a associação de irradiação profilática do sistema nervoso central(2,16,20). É claro da nossa revisão que a dose e o fracionamento de RT utilizados foram menos agressivos, nem todos os pacientes receberam RT junto com a QT, e apenas cerca da metade dos casos (46,5%) recebeu PCI. Em nosso estudo não foi observada diferença nos resultados de tratamento entre sexos e entre as faixas etárias com mais ou menos 60 anos. Embora pacientes idosos pareçam ter resultados de tratamento piores, é possível que isso ocorra apenas em função das comorbidades que esses pacientes usualmente apresentam e que acabam resultando em maior toxicidade e morbi-mortalidade, com menor adequação aos tratamentos propostos(22-24).
CONCLUSÃO A experiência da McGill University no tratamento do CPPC-DL no decorrer de dez anos reflete as constantes mudanças na forma de tratar esta apresentação incomum de câncer. Nossa SG em dois anos, de 25,5%, encontra similaridade com outras publicações uni-institucionais, mas está aquém dos resultados recentes dos grupos cooperativos, na ordem de 47% a 54% (Tabela 1).
Poderíamos especular que nossos resultados estão ligados a uma rigidez de estadiamento menor do que a usada em estudos prospectivos, dose relativamente baixa de RT nem sempre concorrente com a QT e o uso de PCI em apenas cerca de metade dos casos. Os resultados devem ser melhores na próxima geração de pacientes, com o uso de QT com CDDP e VP-16 concomitante com RT precoce e de curta duração e o uso rotineiro de PCI(25,26).
REFERÊNCIAS 1. Warde P, Payne D. Does thoracic irradiation improve survival and local control in limited-stage small-cell carcinoma of the lung? A meta-analysis. J Clin Oncol 1992;10:890-895. [ ] 2. Takada M, Fukuoka M, Kawahara M, et al. Phase III study of concurrent versus sequential thoracic radiotherapy in combination with cisplatin and etoposide for limited-stage small-cell lung cancer: results of the Japan Clinical Oncology Group Study 9104. J Clin Oncol 2002;20:3054-3060. [ ] 3. [No authors listed]. Radiotherapy alone or with chemotherapy in the treatment of small-cell carcinoma of the lung. Medical Research Council Lung Cancer Working Party. Br J Cancer 1979;40:1-10. [ ] 4. Bunn PA Jr, Lichter AS, Makuch RW, et al. Chemotherapy alone or chemotherapy with chest radiation therapy in limited stage small cell lung cancer. A prospective, randomized trial. Ann Intern Med 1987;106:655-662. [ ] 5. Erridge SC, Murray N. Thoracic radiotherapy for limited-stage small cell lung cancer: issues of timing, volumes, dose, and fractionation. Semin Oncol 2003;30:26-37. [ ] 6. Murray N. Small-cell lung cancer at the millennium: radiotherapy innovations improve survival while new chemotherapy treatments remain unproven. Clin Lung Cancer 2000;1:181-190; discussion 191-193. [ ] 7. American Cancer Society. Cancer Facts and Figures 2004. Atlanta, Ga: American Cancer Society, 2004. Also available online. Last accessed November 15, 2004. [ ] 8. Fry WA, Menck HR, Winchester DP. The National Cancer Data Base report on lung cancer. Cancer 1996;77:1947-1955. [ ] 9. Micke P, Faldum A, Metz T, et al. Staging small cell lung cancer: Veterans Administration Lung Study Group versus International Association for the Study of Lung Cancer - what limits limited disease? Lung Cancer 2002;37:271-276. [ ] 10. Auperin A, Arriagada R, Pignon JP, et al. Prophylactic cranial irradiation for patients with small-cell lung cancer in complete remission. Prophylactic Cranial Irradiation Overview Collaborative Group. N Engl J Med 1999;341:476-484. [ ] 11. Kaplan EL, Meier P. Non-parametric estimation from incomplete observations. Am Stat Assoc 1958;53:457-500. [ ] 12. Mantel N, Haenszel W. Statistic aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst 1959;22:719-748. [ ] 13. Johnson BE, Grayson J, Makuch RW, et al. Ten-year survival of patients with small-cell lung cancer treated with combination chemotherapy with or without irradiation. J Clin Oncol 1990;8:396-401. [ ] 14. Lassen U, Osterlind K, Hansen M, Dombernowsky P, Bergman B, Hansen HH. Long-term survival in small-cell lung cancer: post-treatment characteristics in patients surviving 5 to 18+ years - an analysis of 1,714 consecutive patients. J Clin Oncol 1995;13:1215-1220. [ ] 15. Movsas B, Moughan J, Komaki R, et al. Radiotherapy patterns of care study in lung carcinoma. J Clin Oncol 2003;21:4553-4559. [ ] 16. Murray N, Coy P, Pater JL, et al. Importance of timing for thoracic irradiation in the combined modality treatment of limited-stage small-cell lung cancer. The National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 1993;11:336-344. [ ] 17. Fried DB, Morris DE, Poole C, et al. Systematic review evaluating the timing of thoracic radiation therapy in combined modality therapy for limited-stage small-cell lung cancer. J Clin Oncol 2004; 22:4837-4845. [ ] 18. Videtic GM, Truong PT, Dar AR, Yu EW, Stitt LW. Shifting from hypofractionated to "conventionally" fractionated thoracic radiotherapy: a single institution's 10-year experience in the management of limited-stage small-cell lung cancer using concurrent chemoradiation. Int J Radiat Oncol Biol Phys 2003;57:709-716. [ ] 19. Ellis PM, Delaney G, Della-Fiorentina S, Moylan E. Assessing outcomes of cancer care: lessons to be learned from a retrospective review of the management of small cell lung cancer at the Cancer Therapy Centre, Liverpool Hospital, January 1996-July 2000. Australas Radiol 2004;48:364-370. [ ] 20. Turrisi AT 3rd, Kim K, Blum R, et al. Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide. N Engl J Med 1999; 340:265-271. [ ] 21. Johnson BE, Bridges JD, Sobczeck M, et al. Patients with limited-stage small-cell lung cancer treated with concurrent twice-daily chest radiotherapy and etoposide/cisplatin followed by cyclophosphamide, doxorubicin, and vincristine. J Clin Oncol 1996;14:806-813. [ ] 22. Tai P, Tonita J, Yu E, Skarsgard D. Twenty-year follow-up study of long-term survival of limited-stage small-cell lung cancer and overview of prognostic and treatment factors. Int J Radiat Oncol Biol Phys 2003;56:626-633. [ ] 23. Ludbrook JJ, Truong PT, MacNeil MV, et al. Do age and comorbidity impact treatment allocation and outcomes in limited stage small-cell lung cancer? A community-based population analysis. Int J Radiat Oncol Biol Phys 2003;55:1321-1330. [ ] 24. Bremnes RM, Sundstrom S, Aasebo U, Kaasa S, Hatlevoll R, Aamdal S; Norwegian Lung Cancer Study Group. The value of prognostic factors in small cell lung cancer: results from a randomised multicenter study with minimum 5 year follow-up. Lung Cancer 2003;39:303-313. [ ] 25. Stupp R, Monnerat C, Turrisi AT 3rd, Perry MC, Leyvraz S. Small cell lung cancer: state of the art and future perspectives. Lung Cancer 2004;45: 105-117. [ ] 26. Laurie SA, Logan D, Markman BR, Mackay JA, Evans WK; Lung Cancer Disease Site Group of Cancer Care Ontario's Program in Evidence-based Care. Practice guideline for the role of combination chemotherapy in the initial management of limited-stage small-cell lung cancer. Lung Cancer 2004; 43:223-240. [ ] 27. Thomas CR Jr, Giroux DJ, Janaki LM, et al. Ten-year follow-up of Southwest Oncology Group 8269: a phase II trial of concomitant cisplatin-etoposide and daily thoracic radiotherapy in limited small-cell lung cancer. Lung Cancer 2001;33:213-219. [ ] 28. Maranzano E, Crino L, Piro F, et al. Long-term results of induction chemotherapy followed by concurrent chemotherapy and thoracic irradiation in limited small cell lung cancer. Lung Cancer 2002; 37:79-85. [ ] 29. Bremnes RM, Sundstrom S, Vilsvik J, Aasebo U; Norwegian Lung Cancer Study Group. Multicenter phase II trial of paclitaxel, cisplatin, and etoposide with concurrent radiation for limited-stage small-cell lung cancer. J Clin Oncol 2001;19:3532-3538. [ ] 30. Wang XW, Staff I, Siegel RD. Survival and patterns of relapse following treatment of small-cell lung cancer at a community cancer center. Conn Med 2001;65:259-263. [ ] 31. Laskin JJ, Erridge SC, Coldman AJ, et al. Population-based outcomes for small cell lung cancer: impact of standard management policies in British Columbia. Lung Cancer 2004;43:7-16. [ ]
Recebido para publicação em 25/4/2005. Aceito, após revisão, em 25/5/2005.
* Trabalho realizado no Departamento de Rádio-Oncologia do Montreal General Hospital, McGill University Health Centre, McGill University, Montreal, Quebec, Canadá. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554