Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 40 nº 6 - Nov. / Dez. of 2007
Vol. 40 nº 6 - Nov. / Dez. of 2007
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Daniella Maria Carneiro do Rêgo, Francisco Bandeira, Carlos Abath, Gustavo Andrade, Hildo Azevedo |
|
|
Descritores: Síndrome de Cushing, CRH, Desmopressina, Amostragem do seio petroso |
|
|
Resumo: VProfessor Titular de Neurocirurgia da Universidade Federal de Pernambuco (UFPE), Chefe da Divisão de Neurocirurgia do Hospital da Restauração/SUS-UPE, Recife, PE, Brasil
INTRODUÇÃO A síndrome de Cushing endógena resulta da exposição crônica excessiva aos glicocorticóides produzidos pelo córtex adrenal. Pode ser causada pelo excesso de produção de ACTH (80% a 85%), usualmente por um adenoma corticotrófico produtor de ACTH (doença de Cushing) e menos freqüentemente por um tumor extrapituitário (síndrome do ACTH ectópico), ou muito raramente por um tumor secretante de CRH (síndrome do CRH ectópico). A síndrome de Cushing também pode ser ACTH-independente (15% a 20%) quando resulta da secreção excessiva de cortisol por tumores adrenocorticais unilaterais, benignos ou malignos, ou pela hiperplasia adrenal bilateral(1,2). Devido a variabilidade dos parâmetros bioquímicos e manifestações clínicas não-específicas, o diagnóstico é, freqüentemente, um desafio para os clínicos(1,2). Estudos mostram que a combinação CRH + desmopressina é mais eficaz que o CRH isolado em elevar os níveis de ACTH em amostras venosas periféricas de pacientes com síndrome de Cushing(1). Porém, há poucos relatos avaliando esta comparação em pacientes submetidos ao cateterismo bilateral simultâneo dos seios petrosos inferiores(3). Um estudo recente avaliou a desmopressina pura durante o cateterismo dos seios petrosos(4), entretanto, relatos em relação ao uso combinado CRH + desmopressina durante este procedimento permanecem escassos(3). Relatamos nossa experiência na aplicação da estimulação combinada de CRH + desmopressina durante o cateterismo bilateral simultâneo dos seios petrosos inferiores em pacientes com síndrome de Cushing ACTH-dependente e comparamos estes resultados àqueles obtidos de pacientes que utilizaram apenas o CRH. Dessa forma, podemos determinar a magnitude da elevação do ACTH plasmático após o estímulo com CRH puro ou uso combinado de CRH + desmopressina durante o procedimento. O teste de amostras de sangue dos seios petrosos inferiores é o que tem maiores sensibilidade e especificidade diagnósticas na diferenciação da síndrome de Cushing ACTH-dependente. Entretanto, necessita de acesso às facilidades do especialista e de um radiologista treinado, podendo raramente resultar em complicações como acidente vascular cerebral. Após o radiologista cateterizar ambos os seios petrosos, amostras de sangue para ACTH são obtidas no estado basal e após três e cinco minutos da administração endovenosa de CRH humano (100 mg ou 1 mg/kg), simultaneamente, em ambos os seios petrosos e na veia periférica. Angiografia por subtração digital deve ser usada para verificar a posição apropriada do cateter e a anatomia do seio petroso. O gradiente do ACTH entre os seios petrosos inferiores e a veia periférica maior que 2 no estado basal e maior que 3 após CRH é consistente com doença de Cushing. Um gradiente acima de 1,4 entre os seios sugere lateralização. O cateterismo dos seios petrosos inferiores em centros experientes tem altas sensibilidade e especificidade (95% a 99%) para doença de Cushing. Contudo, fatores técnicos, bem como anomalias de drenagem venosas, podem resultar em falso-negativos em pacientes com fonte hipofisária de produção de ACTH(5).
MATERIAIS E MÉTODOS Pacientes O cateterismo bilateral simultâneo dos seios petrosos inferiores foi realizado em 21 pacientes ? 14 mulheres e 7 homens ? com síndrome de Cushing ACTH-dependente, no período de janeiro de 1998 a dezembro de 2003. Todos se apresentavam clínica e bioquimicamente hipercortisolêmicos no momento do procedimento. Após a cateterização de ambos os seios petrosos, amostras de sangue para ACTH foram obtidas no estado basal e após três e cinco minutos da administração de CRH humano (100 µg) (6 pacientes) ou CRH humano + desmopressina (100 µg + 10 µg) (15 pacientes), simultaneamente, nos seios petrosos e veia periférica. O procedimento foi realizado por um único radiologista intervencionista experiente. O diagnóstico de síndrome de Cushing foi baseado em achados clínicos e na demonstração de níveis de cortisol persistente e inapropriadamente elevados. As investigações bioquímicas incluíram dosagens de cortisol sérico e salivar à meia-noite, e testes de supressão com baixas doses de dexametasona por 48 horas. O método usado para dosagem do cortisol foi o radioimunoensaio por imunorradiometria, e o cortisol utilizado foi o da Diagnostic Products Corporation. O diagnóstico de síndrome de Cushing ACTH-dependente foi baseado na presença de nível do hormônio ACTH sérico acima de 20 pg/ml em pacientes com hipercortisolismo clínico e bioquímico. O método usado para esta dosagem foi o radioimunoensaio por imunorradiometria, e o ACTH utilizado foi o do Diagnostic System Laboratory. Evidenciamos 18 pacientes com doença de Cushing e 3 pacientes com síndrome de secreção ectópica de ACTH. Entre os 18 pacientes com doença de Cushing, 4 utilizaram CRH humano (100 µg) e 14 utilizaram CRH + desmopressina (100 µg + 10 µg) durante o cateterismo bilateral simultâneo dos seios petrosos inferiores. Entre os três pacientes que apresentavam síndrome do ACTH ectópico, dois utilizaram CRH e um utilizou CRH + desmopressina nas mesmas doses. Todos os pacientes realizaram ressonância magnética de crânio. Cateterismo bilateral simultâneo dos seios petrosos inferiores O procedimento é realizado em sala de angiografia digital, sob acompanhamento anestésico. É realizada sedação com midazolam e fentanil e anestesia tópica na região inguinal, bilateralmente. As veias femorais direita e esquerda são puncionadas na altura da prega inguinal, introduzindo-se uma bainha e um cateter 5F de cada lado (cada um com 1,7 mm de diâmetro). Os cateteres, tipo vertebral esquerdo, são introduzidos com fios-guias delicados (Roadrunner 0,352), através da cava inferior, superior e, por cada jugular interna (direita e esquerda), atingindo os seios petrosos bilateralmente. Uma vez confirmado o posicionamento de ambos os cateteres por meio de injeção e filmagem, são colhidas as amostras basais, simultaneamente, de ambos os seios petrosos e da veia periférica; cerca de 3,0 ml de sangue são coletados e devidamente identificados. Pelo acesso venoso periférico é administrado CRH humano (100 µg) ou CRH + desmopressina (100 µg + 10 µg); a partir do momento que é iniciada a cronometragem, são obtidas amostras simultâneas de cada cateter e da veia periférica com três e cinco minutos, sendo cada amostra identificada quanto ao tempo e lado. O espaço morto do cateter é sempre desprezado antes da coleta. Após o término, os cateteres são retirados, assim como os introdutores, com compressão manual de dez minutos para hemostasia da região inguinal. O paciente permanece em repouso por um período de quatro horas. Este protocolo foi aprovado pelo Comitê de Ética da Instituição. Análise estatística Para a análise dos dados foram obtidas distribuições absolutas, percentuais e medidas estatísticas (média, desvio-padrão ? medidas de estatística descritiva) e utilizados os testes t-Student com variâncias iguais ou desiguais (de acordo com os resultados da verificação ou não de hipóteses de igualdade das variâncias) e o teste exato de Fisher. A verificação da hipótese de igualdade de variâncias foi realizada pelo teste F. O nível de significância utilizado na aplicação dos testes estatísticos foi de 5%. O programa utilizado para obtenção dos cálculos estatísticos foi o Statistical Analyses System (SAS) versão 8.0.
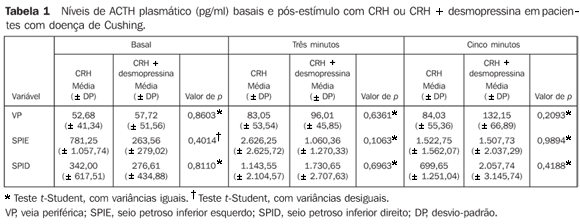
RESULTADOS A idade dos pacientes variou de 15 a 53 anos, com média de 34,94 anos e desvio-padrão de 11,60. Dos 21 pacientes estudados, 18 apresentavam doença de Cushing e 3 pacientes tinham síndrome do ACTH ectópico. Dos 18 pacientes com doença de Cushing, 5 (27,8%) eram do gênero masculino e 13 (72,2%) eram do gênero feminino. Dentre os pacientes com síndrome do ACTH ectópico, nenhum apresentou gradiente entre os seios petrosos e a veia periférica. Os tumores responsáveis por esta secreção foram carcinóide brônquico, um pequeno tumor pulmonar nuroendócrino com imuno-histoquímica positiva para ACTH, e em um paciente não foi possível encontrar a fonte produtora de ACTH. Este paciente, após ser acompanhado por um período de 18 meses, apresentou agravamento do quadro clínico, necessitando de adrenalectomia bilateral. A Tabela 1 destaca que o valor médio do ACTH no tempo basal foi mais elevado no grupo que recebeu CRH do que no que recebeu CRH + desmopressina. Aos três minutos, os valores médios do ACTH foram mais elevados no grupo do CRH, e aos cinco minutos, os valores médios do ACTH foram mais elevados no grupo do CRH + desmopressina. Não houve diferenças significantes entre os grupos (p > 0,05).
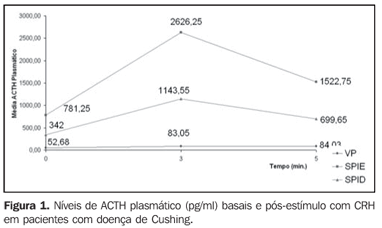
A Figura 1 ilustra o aumento do ACTH nos pacientes com doença de Cushing que receberam CRH na veia periférica, seio petroso inferior esquerdo e seio petroso inferior direito. A Figura 2 ilustra o aumento do ACTH nos mesmos sítios dos pacientes que receberam CRH + desmopressina.
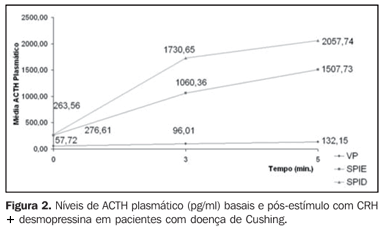
Na Tabela 2 acham-se as variações percentuais do aumento do ACTH plasmático entre os tempos três e cinco minutos em relação à avaliação basal, segundo o local onde a medida foi realizada e o grupo. Aos três minutos, as médias das variações percentuais do ACTH na veia periférica e no seio petroso inferior direito foram mais elevadas no grupo que recebeu CRH + desmopressina. No seio petroso inferior esquerdo foi mais elevado no grupo do CRH. Aos cinco minutos, a média da variação percentual do ACTH no grupo do CRH foi menos elevada em relação aos três minutos, enquanto no grupo do CRH + desmopressina foi mais elevada.
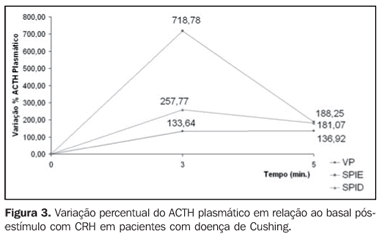
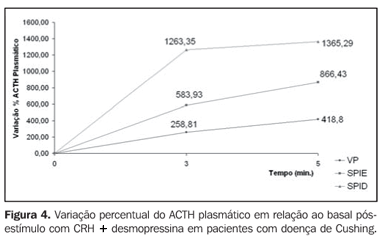
Verificam-se diferenças significantes aos cinco minutos no grupo que recebeu CRH + desmopressina (p < 0,05). A Figura 3 ilustra o aumento percentual do ACTH nos pacientes com doença de Cushing que receberam CRH na veia periférica, seio petroso inferior esquerdo e seio petroso inferior direito. A Figura 4 ilustra o aumento percentual do ACTH nos mesmos sítios dos pacientes que receberam CRH + desmopressina.
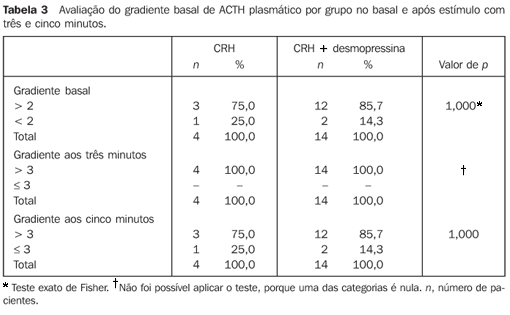
Na Tabela 3 os resultados são apresentados considerando-se ambos os seios petrosos inferiores (direito e esquerdo) no estado basal e após estimulação com três e cinco minutos. Verifica-se: ? No estado basal, o percentual de casos com gradiente maior que 2 foi 75% no grupo do CRH e 85,7% no grupo do CRH + desmopressina. Não se comprova associação significante entre o grupo e a faixa de gradiente. ? Aos três minutos, na avaliação conjunta dos seios petrosos inferiores, observa-se que todos os pacientes que receberam CRH ou CRH + desmopressina apresentaram gradiente acima de 3. Não é possível aplicar o teste de significância, pois uma das categorias é nula. ? Aos cinco minutos, na avaliação conjunta dos seios petrosos inferiores, o percentual de casos com gradiente maior que 3 foi mais elevado no grupo que recebeu CRH + desmopressina do que no grupo do CRH (85,7% versus 75%), sem diferenças significantes entre os grupos (p > 0,05).
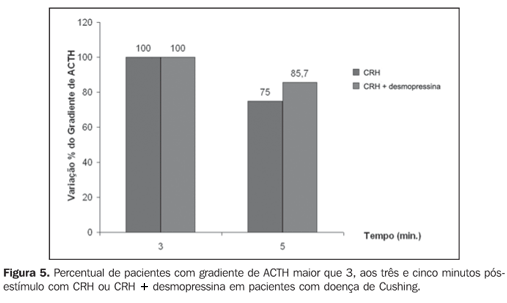
A Figura 5 apresenta o percentual de pacientes com gradiente de ACTH maior que 3, aos três e cinco minutos após estímulo com CRH ou CRH + desmopressina em pacientes com doença de Cushing.
Em relação à lateralização do exame, observa-se que 100% dos pacientes que receberam CRH e 92,85% dos que receberam CRH + desmopressina lateralizaram. A ressonância magnética de crânio identificou o adenoma hipofisário em 9 dos 18 pacientes com doença de Cushing e foi negativa nos três pacientes com síndrome do ACTH ectópico. Todos os pacientes com doença de Cushing apresentavam microadenoma hipofisário. Não houve complicações na realização do cateterismo bilateral simultâneo dos seios petrosos inferiores.
DISCUSSÃO A síndrome de Cushing ACTH-dependente surge do aumento da produção do ACTH pela hipófise (doença de Cushing) ou por uma fonte ectópica (síndrome do ACTH ectópico)(6?8). A diferenciação entre a doença de Cushing e a síndrome do ACTH ectópico usando técnicas bioquímicas e radiológicas convencionais é um dos maiores desafios na clínica neuroendocrinológica. Tem sido sugerido que amostras venosas dos seios petrosos inferiores, com ou sem estímulo pelo CRH, é o mais acurado caminho para estabelecer o diagnóstico da doença de Cushing(9). Embora seja um procedimento invasivo, as taxas de sucesso e complicações dependem da habilidade e experiência do operador; é a forma mais direta de demonstrar a hipersecreção hipofisária de ACTH e então identificar os pacientes que irão ser beneficiados com a cirurgia hipofisária(10). O diagnóstico acurado pelo cateterismo dos seios petrosos é em torno de 90% a 100%(11?13). Estudos recentes mostram sensibilidade após estímulo com CRH de 90%, com especificidade de 67%, valor preditivo positivo de 99% e valor preditivo negativo de 20%, evidenciando que pacientes com gradiente seio petroso/veia periférica sugestivo de uma fonte não-hipofisária de produção excessiva de ACTH podem ainda ter doença de Cushing(5). A maioria dos pacientes com síndrome de Cushing tem microadenomas hipofisários(14) e a ressonância magnética tem sensibilidade diagnóstica de 60% a 80% em detectá-los(12,15,16). No nosso estudo, a ressonância magnética foi positiva em 50% dos pacientes com doença de Cushing. Além disso, 10% a 20% das pessoas endocrinologicamente normais têm lesões hipofisárias sem significância clínica nos exames de imagem(8). Em adição, um significante número de tumores ectópicos produtores de ACTH pode não ser detectado nas imagens convencionais(6). Então, um considerável número de pacientes que falham em um ou ambos os grupos necessitará de mais investigações para o estabelecimento do diagnóstico correto. O estímulo com CRH tem sido usado com sucesso no aumento da sensibilidade diagnóstica do cateterismo dos seios petrosos(9,17). Em nossa série de casos, 100% dos pacientes que utilizaram CRH tiveram gradiente entre seio petroso/veia periférica maior que 3. Os pacientes com doença de Cushing têm uma resposta exagerada a análogos da vasopressina, provavelmente por causa da expressão anormal de receptores V2 ou V3 nos adenomas corticotróficos(18). Esta propriedade pode ser utilizada para ampliar a sensibilidade diagnóstica da estimulação com CRH em diferenciar os pacientes com doença de Cushing e aqueles com secreção ectópica de ACTH(19). Os pacientes que utilizam CRH + desmopressina têm resposta ao ACTH significantemente mais alta que aqueles que utilizam o CRH isolado(3). Nesta nossa série, 100% dos pacientes que utilizaram CRH + desmopressina tiveram gradiente seio petroso/veia periférica maior que 3. Quando analisamos a variação percentual do ACTH, observamos um aumento progressivo aos três e cinco minutos no grupo que recebeu CRH + desmopressina. Nos que receberam CRH observamos aumento aos três minutos, com posterior declínio aos cinco minutos. Houve maior estímulo na produção de ACTH nos pacientes que utilizaram CRH + desmopressina, principalmente aos cinco minutos. Portanto, o uso combinado do CRH + desmopressina dá um estímulo maior e mais tardio que o CRH isolado. Estudos evidenciam um aumento da lateralização, principalmente aos cinco minutos, nos pacientes que receberam CRH durante o cateterismo dos seios petrosos(12). Em relação à lateralização, não observamos superioridade do uso combinado do CRH + desmopressina na localização do adenoma hipofisário durante o cateterismo bilateral simultâneo dos seios petrosos inferiores.
CONCLUSÕES O cateterismo bilateral simultâneo dos seios petrosos inferiores utilizando estímulos com CRH ou CRH + desmopressina foi capaz de diagnosticar todos os pacientes com doença de Cushing. A estimulação combinada de CRH + desmopressina provocou uma produção maior de ACTH em adenomas hipofisários corticotróficos em comparação ao CRH isolado, o que pode melhorar a sensibilidade diagnóstica deste procedimento.
REFERÊNCIAS 1. Arnaldi G, Angeli A, Atkinson AB, et al. Diagnosis and complications of Cushing's syndrome: a consensus statement. J Clin Endocrinol Metab 2003;88:5593?5602. [ ] 2. Findling JW, Raff H. Cushing's syndrome: important issues in diagnosis and management. J Clin Endocrinol Metab 2006;91:3746?3753. [ ] 3. Tsagarakis S, Kaskarelis IS, Kokkoris P, Malagari C, Thalassinos N. The application of a combined stimulation with CRH and desmopressin during bilateral inferior petrosal sinus sampling in patients with Cushing's syndrome. Clin Endocrinol (Oxf) 2000;52:355?361. [ ] 4. Machado MC, Sa SV, Domenice S, et al. The role of desmopressin in bilateral and simultaneous inferior petrosal sinus sampling for differential diagnosis of ACTH-dependent Cushing's syndrome. Clin Endocrinol (Oxf) 2007;66:136?142. [ ] 5. Swearingen B, Katznelson L, Miller K, et al. Diagnostic errors after inferior petrosal sinus sampling. J Clin Endocrinol Metab 2004;89:3752?3763. [ ] 6. Howlett TA, Drury PL, Perry L, Doniach I, Rees LH, Besser GM. Diagnosis and management of ACTH-dependent Cushing's syndrome: comparison of the features in ectopic and pituitary ACTH production. Clin Endocrinol (Oxf) 1986;24:699?713. [ ] 7. Trainer PJ, Besser GM. Cushing's syndrome. The Bart's endocrine protocols. London: Churchill Livingstone, 1995;84?92. [ ] 8. Kaye TB, Crapo L. The Cushing syndrome: an update on diagnostic tests. Ann Intern Med 1990; 112:434?444. [ ] 9. Findling JW, Kehoe ME, Shaker JL, Raff H. Routine inferior petrosal sinus sampling in the differential diagnosis of adrenocorticotropin (ACTH)-dependent Cushing's syndrome: early recognition of the occult ectopic ACTH syndrome. J Clin Endocrinol Metab 1991;73:408?413. [ ] 10. Orth DN. Cushing's syndrome. N Engl J Med 1995;332:791?803. [ ] 11. Mamelak AN, Dowd CF, Tyrrell JB, McDonald JF, Wilson CB. Venous angiography is needed to interpret inferior petrosal sinus and cavernous sinus sampling data for lateralizing adrenocorticotropin-secreting adenomas. J Clin Endocrinol Metab 1996;81:475?481. [ ] 12. Kaltsas GA, Giannulis MG, Newell-Price JD, et al. A critical analysis of the value of simultaneous inferior petrosal sinus sampling in Cushing's disease and the occult ectopic adrenocorticotropin syndrome. J Clin Endocrinol Metab 1999;84: 487?492. [ ] 13. Landolt AM, Schubiger O, Maurer R, Girard J. The value of inferior petrosal sinus sampling in diagnosis and treatment of Cushing's disease. Clin Endocrinol (Oxf) 1994;40:485?492. [ ] 14. Mampalam TJ, Tyrrell JB, Wilson CB. Transsphenoidal microsurgery for Cushing disease. A report of 216 cases. Ann Intern Med 1988;109: 487?493. [ ] 15. Graham KE, Samuels MH, Nesbit GM, et al. Cavernous sinus sampling is highly accurate in distinguishing Cushing's disease from the ectopic adrenocorticotropin syndrome and in predicting intrapituitary tumor location. J Clin Endocrinol Metab 1999;84:1602?1610. [ ] 16. de Herder WW, Uitterlinden P, Pieterman H, et al. Pituitary tumour localization in patients with Cushing's disease by magnetic resonance imaging. Is there a place for petrosal sinus sampling? Clin Endocrinol (Oxf) 1994;40:87?92. [ ] 17. Tabarin A, Greselle JF, San-Galli F, et al. Usefulness of the corticotropin-releasing hormone test during bilateral inferior petrosal sinus sampling for the diagnosis of Cushing's disease. J Clin Endocrinol Metab 1991;73:53?59. [ ] 18. Dahia PLM, Ahmed-Shuaib A, Jacobs RA, et al. Vasopressin receptor expression and mutation analysis in corticotropin-secreting tumors. J Clin Endocrinol Metab 1996;81:1768?1771. [ ] 19. Newell-Price J, Perry L, Medbak S, et al. A combined test using desmopressin and corticotropin-releasing hormone in the differential diagnosis of Cushing's syndrome. J Clin Endocrinol Metab 1997;82:176?181. [ ]
Recebido para publicação em 12/2/2007. Aceito, após revisão, em 8/5/2007.
* Trabalho realizado no Hospital Agamenon Magalhães/Sistema Único de Saúde-UPE, Unidade de Radiologia Intervencionista do Recife ? Angiorad, Hospital da Restauração, Recife, PE, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554