Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 40 nº 3 - Maio / Jun. of 2007
Vol. 40 nº 3 - Maio / Jun. of 2007
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Fabíola Procaci Kestelman, Gustavo Antônio de Souza, Luiz Claudio Thuler, Gabriela Martins, Vivianne Aguilera Rolim de Freitas, Ellyete de Oliveira Canella |
|
|
Descritores: Mamografia, BI-RADS®, Câncer de mama |
|
|
Resumo:
INTRODUÇÃO O câncer de mama é a principal causa de morte por neoplasia entre mulheres no Brasil e corresponde ao segundo mais incidente, de acordo com as estatísticas do Instituto Nacional de Câncer(1). A redução da taxa de mortalidade depende da detecção precoce, do planejamento terapêutico adequado e do uso da mamografia anual como método de rastreamento(2). A mamografia possui alta sensibilidade para detectar câncer de mama clinicamente oculto. Uma revisão de ensaios clínicos avaliando o desempenho do método mostrou que a sensibilidade variou entre 71% e 98% para o exame anual(3). Porém, muitas lesões consideradas suspeitas, para as quais é indicado estudo histopatológico, correspondem a alterações benignas. Nos Estados Unidos, o valor preditivo positivo (VPP) das biópsias realizadas por achados mamográficos, ou seja, o total de lesões malignas diagnosticadas sobre o total de biópsias realizadas, varia entre 15% e 40%(4–6). O custo e a morbidade das intervenções para o diagnóstico dessas lesões são levados em conta para a confirmação do uso da mamografia como método de rastreamento(7). Uma das dificuldades da análise do exame é que grande parte das lesões diagnosticadas não apresenta características patognomônicas. Knutzen e Gisvold(8) estudaram a probabilidade de malignidade em várias categorias de lesões não-palpáveis detectadas na mamografia e observaram que se os critérios morfológicos dessas lesões fossem considerados, a taxa de lesões malignas entre mulheres submetidas a biópsia poderia chegar a 40%. Visando reduzir as discordâncias na interpretação da mamografia e padronizar o laudo, o American College of Radiology publicou, em 1993, o Breast Imaging Reporting and Data System (BI-RADS)(9). Novas edições foram publicadas em 1995, 1998 e 2003(10–12). De acordo com a quarta edição do BI-RADS®(12), os exames são classificados com base no grau de suspeição das lesões em: categoria 1 – sem achados positivos; categoria 2 – achados benignos; categoria 3 – achados provavelmente benignos; categoria 4 – achados suspeitos; categoria 5 – achados altamente suspeitos. Lesões que necessitam avaliação adicional, por exemplo, com ultra-sonografia, são classificadas na categoria 0, e aquelas que têm diagnóstico histopatológico maligno previamente confirmado, na categoria 6. Na última edição do BI-RADS® foram incluídas sugestões para avaliação das lesões mamárias também para ultra-sonografia e ressonância magnética. Apesar de sua grande utilidade, já verificada com o BI-RADS® para mamografia, o uso dessa nomenclatura é recente, o que ainda gera algumas críticas e considerações quanto à sua utilização(13,14). Alguns estudos avaliam a capacidade para prever malignidade da mamografia categorias 3, 4 e 5, em que seriam classificadas as lesões com algum grau de suspeição. Uma maneira de verificar o desempenho de cada categoria do BI-RADS® é avaliar o resultado das lesões que foram submetidas à biópsia e calcular o VPP, tendo como padrão ouro o resultado histopatológico. Esta revisão da literatura tem como objetivo avaliar o VPP das categorias 3, 4 e 5 do BI-RADS®. Além disso, é realizada uma análise dos critérios morfológicos utilizados para determinar a estratificação das lesões nessas categorias.
MATERIAIS E MÉTODOS A revisão da literatura foi realizada mediante pesquisa eletrônica na base de dados Medline, utilizando os termos "predictive value" e "BI-RADS ou BIRADS" para a procura. As publicações incluídas nesta revisão cumpriram os seguintes critérios: artigos originais avaliando o VPP das categorias 3, 4 e 5; verificação do VPP baseado no resultado histopatológico da lesão; trabalhos publicados a partir de 1998; artigos em língua portuguesa, inglesa ou francesa. Foram excluídos artigos que avaliaram uma ou duas categorias ou que não disponibilizaram o resumo em meio eletrônico. Os artigos originais selecionados foram avaliados na íntegra, de modo a confirmar que eles preenchiam esses critérios. Dos 33 artigos encontrados após a busca, nove cumpriram os critérios previamente determinados. Utilizando-se as referências bibliográficas desses artigos, foram localizados outros dois artigos adequados aos critérios de inclusão e exclusão, totalizando 11 artigos. Os dados extraídos dos artigos foram armazenados em planilha Excel® (Microsoft). Foram avaliados os seguintes itens: período do estudo; número de lesões estudadas; idade das pacientes; tipo de lesão (palpáveis e/ou não-palpáveis); método de biópsia; controle clínico, radiológico ou cirúrgico das lesões submetidas a biópsia percutânea; VPP das categorias 3, 4 e 5; análise dos critérios morfológicos. Os VPP das categorias foram extraídos dos artigos ou calculados através dos dados disponíveis, considerando-se o número de lesões em uma das categorias com diagnóstico maligno dividido pelo total de lesões classificadas nesta categoria e por fim multiplicado por 100. Neste caso, foi considerado maligno o resultado histológico de carcinoma ductal in situ ou qualquer tumor invasor primário da mama, conforme orienta o BI-RADS®(12). Em um único estudo foram avaliadas lesões submetidas a algum método de biópsia e lesões controladas radiologicamente. Neste caso, o VPP foi calculado considerando somente as lesões submetidas inicialmente a biópsia(15), tendo o critério histopatológico como padrão ouro.
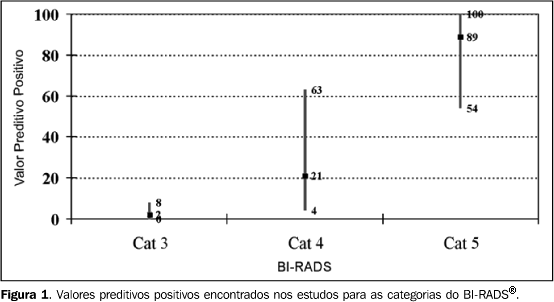
RESULTADOS Os 11 artigos foram incluídos por apresentarem dados para determinar os VPP das categorias 3, 4 e 5. As características desses estudos estão resumidas na Tabela 1. Em três artigos os dados foram obtidos exclusivamente de pacientes submetidas a biópsia cirúrgica(16–18). Em cinco estudos foram avaliadas pacientes submetidas a biópsias percutâneas(19–23) e em dois foram verificados, conjuntamente, os resultados de pacientes submetidas a biópsia percutânea e pacientes submetidas a biópsia cirúrgica(15,24). Liberman et al. estudaram, separadamente, pacientes submetidas a biópsia percutânea e cirúrgica(25). Com relação aos estudos baseados em biópsias percutâneas, quatro fazem referência ao seguimento das pacientes, tanto pelo controle radiológico das lesões com diagnóstico histológico benigno quanto pela verificação de resultados histológicos das lesões submetidas posteriormente a biópsia cirúrgica, como nos casos de diagnóstico histológico inicial de hiperplasia ductal atípica(20–22,25). Nos demais artigos, estes dados estão incompletos. Bérubé et al.(19) relataram a realização de nova biópsia nos casos de discordância entre o laudo histológico e o aspecto radiológico da lesão. Dois estudos correlacionaram os resultados histológicos de hiperplasia atípica com os resultados de biópsias cirúrgicas(23,24). Zonderland et al.(15) descrevem o controle clínico das lesões através de dados da própria instituição e de um registro nacional de resultados de exames histopatológicos. Os estudos não são homogêneos com relação à seleção das pacientes, considerando o exame físico das mamas. Oito estudos fazem referência ao exame físico, sendo que quatro avaliaram somente lesões não-palpáveis(16,17,22,25) e os demais avaliaram tanto lesões palpáveis quanto não-palpáveis(15,18,21,24) . Três artigos não descrevem claramente o tipo de lesão estudada(19, 20,23), no entanto, são estudos que avaliaram pacientes submetidas a biópsia percutânea orientada por estereotaxia ou por ultra-sonografia, o que pode indicar que estas lesões são clinicamente ocultas. No estudo de Liberman et al.(25), em que foram avaliadas pacientes submetidas a biópsia percutânea, estes dados não estão bem definidos, porém as lesões também foram submetidas a biópsia orientada por ultra-sonografia ou estereotaxia. VPP das categorias 3, 4 e 5 Nos 11 estudos o VPP variou entre 0% e 8% para a categoria 3 (mediana de 2%), entre 4% e 63% para a categoria 4 (mediana de 21%) e entre 54% e 100% na categoria 5 (mediana de 89%) (Figura 1). Nos quatro artigos em que o método de obtenção do resultado histopatológico foi exclusivamente biópsia cirúrgica, o VPP encontrado para as categorias 3, 4 e 5 variou entre 0% e 5%, 26% e 34%, e 81% e 97%, respectivamente(16–18,25). Nos seis estudos que avaliaram lesões submetidas somente à biópsia percutânea, o VPP das categorias 3, 4 e 5 variou, respectivamente, entre 0% e 4%, 4% e 20%, e 54% e 92%(19–23,25).
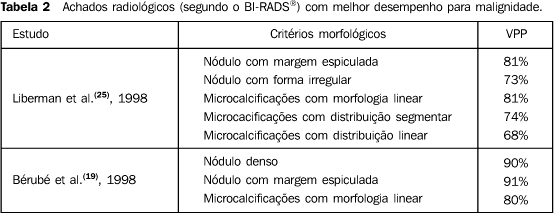
Os quatro estudos que avaliaram somente lesões não-palpáveis(16,17,22,25) apresentaram variação do VPP, na categoria 3, de 0% a 2%, na categoria 4, de 20% a 34%, e na categoria 5, de 77% a 97%. Os quatro artigos que obtiveram resultados a partir de lesões palpáveis e não-palpáveis(15,18,21,24) encontraram variação do VPP, na categoria 3, de 3% a 8%, na categoria 4, de 10% a 63%, e na categoria 5, de 84% a 100%. Critérios morfológicos com maior VPP Três artigos mencionaram as características morfológicas das lesões com maior associação com malignidade. Liberman et al.(25) e Bérubé et al.(19) avaliaram as características morfológicas das lesões conforme proposto na segunda edição do BI-RADS®(12), incluindo, para o estudo dos nódulos, a avaliação da margem e da forma, e para as calcificações, a morfologia e a distribuição (Tabela 2). Mendez et al.(23) dividiram as lesões em microcalcificações, densidade assimétrica, nódulo circunscrito, espiculado ou com microcalcificações, e densidade assimétrica com microcalcificações. Nos três estudos, o nódulo espiculado foi a lesão com maior VPP(19,23,25). Liberman et al.(25) verificaram que, com relação aos nódulos, os critérios com maior VPP foram margem espiculada e forma irregular, e com relação às microcalcificações, foram morfologia linear e distribuição segmentar e linear. Bérubé et al.(19) identificaram que os critérios morfológicos com maior VPP foram os nódulos densos, nódulos com margens espiculadas e microcalcificações lineares.
DISCUSSÃO Os estudos analisados com o objetivo de verificar o VPP das categorias 3, 4 e 5 do BI-RADS® mostraram diferença significativa na detecção do câncer entre estas categorias. Entretanto, a metodologia empregada nestes estudos foi bastante heterogênea, o que limita a comparação dos seus resultados. Alguns trabalhos apresentaram informações limitadas quanto à seleção das pacientes. Em alguns não há referência se as lesões estudadas eram palpáveis ou não. Em outros foram avaliadas, simultaneamente, lesões palpáveis e não-palpáveis. Nos artigos em que não há referência ao tipo de lesão estudada, o estudo histopatológico foi obtido através de biópsia percutânea orientada por estereotaxia ou ultra-sonografia, o que sugere que as lesões eram clinicamente ocultas. A variação da prevalência de carcinomas nesses estudos e, conseqüentemente, do VPP das categorias pode estar relacionada com essas diferenças na seleção de pacientes para biópsia cirúrgica ou percutânea. Outro fator que pode influenciar a prevalência de carcinomas é o acompanhamento radiológico das lesões com diagnóstico histopatológico benigno. Em estudos com acompanhamento das pacientes após biópsia percutânea com agulha grossa (core biópsia), de 14 gauge, a freqüência de carcinomas não-diagnosticados variou entre 0,3% e 8,2%, sendo que, com o acompanhamento radiológico, 70% desses carcinomas foram identificados precocemente após a biópsia (immediate false negatives) e 30% o foram mais tardiamente (delayed false negatives)(26,27). Ainda com relação ao número de carcinomas diagnosticados em biópsias percutâneas, outra variável que deve ser considerada é o controle de lesões subestimadas. Por exemplo, uma lesão diagnosticada como hiperplasia ductal atípica, após uma biópsia percutânea, pode corresponder a carcinoma ductal in situ, ou um carcinoma ductal in situ corresponder a carcinoma ductal invasor. Das lesões diagnosticadas como hiperplasia ductal atípica, quando submetidas a core biópsia com agulha de 14 gauge, 20% a 56% correspondem a carcinomas na biópsia cirúrgica, enquanto 0% a 38% das lesões submetidas a biópsia a vácuo (mamotomia), com agulha de 14 gauge ou 11 gauge, são subestimadas como hiperplasia ductal atípica. Estes dados mostram que quando o volume do tecido obtido na biópsia é maior, a taxa de subestimação é menor, porém não é inexistente(28). Considerando esses dados, os estudos analisados também mostram características heterogêneas. Dos oitos artigos(15,19–25) nos quais o resultado histopatológico foi obtido de lesões submetidas a biópsia percutânea, seis(15,20,22–25) referem ter realizado controle radiológico das lesões benignas e biópsia cirúrgica de determinadas lesões benignas, por exemplo, hiperplasia ductal atípica. Uma vez que estas são duas variáveis que interferem no número de diagnósticos malignos, estudos que apresentem heterogeneidade nestes aspectos podem mostrar diferenças nos seus resultados. Outro fator importante para a análise dos VPP das categorias está relacionado ao uso do BI-RADS®, que pode apresentar limitações por deficiências da classificação ou do treinamento dos radiologistas que vão utilizá-lo(29,30). Berg et al.(31) avaliaram a variabilidade inter e intra-observador do uso da terminologia do BI-RADS®. Cinco radiologistas com experiência em mamografia avaliaram 103 mamografias de rotina. A taxa de concordância entre os radiologistas (método estatístico kappa) apresentou variação entre 0,16 e 0,77 para os diversos achados mamográficos, mostrando moderada variabilidade, e de 0,37 para as categorias do BI-RADS®, que significa concordância discreta. Orel et al.(16), em análise de achados de mamografias realizadas em instituições diferentes, observaram que algumas pacientes que eram encaminhadas para realização de biópsia apresentavam lesões benignas, classificadas na categoria 2, e portanto não teriam indicação de biópsia. Essa discrepância foi associada com a variação interobservador, tanto para descrever as lesões quanto para recomendar a biópsia, e também foi relacionada com variações na experiência dos radiologistas que avaliaram as mamografias. Bérubé et al.(19) associaram o baixo VPP que obtiveram para a categoria 4 com o fato de a nomenclatura do BI-RADS® ser descritiva e pouco específica. Ao contrário de Bérubé et al.(19), Zonderland et al.(15) encontraram VPP maiores para todas as categorias em comparação com resultados encontrados em estudos americanos. Este achado foi atribuído ao fato de que nos estudos americanos há uma tendência em se obter um maior número de diagnósticos positivos nas biópsias para reduzir o número de resultados falso-negativos nas mamografias. Este fato interfere na seleção das pacientes com sugestão de investigação histopatológica. O mesmo achado foi encontrado em um estudo comparando mamografias de rotina realizadas nos Estados Unidos e no Reino Unido(32). Com relação aos VPP das categorias, o BI-RADS® sugere valores abaixo de 2% para a categoria 3 e acima de 95% para a categoria 5, sendo que cinco estudos encontraram valores acima do sugerido para a categoria 3(15,18,21,23,24) e em nove artigos os valores obtidos foram mais baixos que o esperado para a categoria 5(17–25). Concluindo, esta revisão mostra que em todos os estudos houve grande variabilidade do VPP das categorias 3, 4 e 5 do BI-RADS®. A comparação dos resultados obtidos nos 11 estudos é limitada pela heterogeneidade quanto à seleção das pacientes, método de biópsia e no caso de estudos que obtiveram dados de biópsias percutâneas quanto ao controle radiológico das lesões benignas e controle de lesões subestimadas. Entretanto, há uma gradação na predição de malignidade que permite discriminar, com relativa segurança, pacientes com maior risco de apresentar câncer de mama. Além disso, os estudos mostram que a presença de nódulo espiculado revela elevada associação com doença maligna.
AGRADECIMENTOS Às médicas do setor de imaginologia mamária da Clínica Luiz Felippe Mattoso, Dra. Erika Esteves Araújo Torres, Dra. Márcia Costa Jazbik, Dra. Karla Dias de Paiva e Dra. Marcela Leite Balaro, pela contribuição ao trabalho. À Profa. Dra. Sophie Derchain, médica pesquisadora do Centro de Atenção Integral à Saúde da Mulher – Universidade Estadual de Campinas (Caism-Unicamp), pela supervisão do artigo.
REFERÊNCIAS 1. INCA. Instituto Nacional do Câncer, Ministério da Saúde. Estimativa da incidência e da mortalidade por câncer no Brasil. Acessado em: 22/9/2004. Disponível em: http://www.inca.gov.br/estimativas/2003/index.asp?link=conteudo_ view.asp&ID=4 [ ] 2. Newman LA, Sabel M. Advances in breast cancer detection and management. Med Clin North Am 2003;87:997–1028. [ ] 3. Thuler LC. Considerações sobre a prevenção do câncer de mama feminino. Rev Bras Cancerol 2003;49:227–238. [ ] 4. Ciatto S, Cataliotti L, Distante V. Nonpalpable lesions detected with mammography: review of 512 consecutive cases. Radiology 1987;165:99–102. [ ] 5. Cyrlak D. Induced costs of low-cost screening mammography. Radiology 1988;168:661–663. [ ] 6. Hall FM, Storella JM, Siverstone DZ, Wyshak G. Nonpalpable breast lesions: recommendation for biopsy based on suspicion of carcinoma at mammography. Radiology 1988;167:353–358. [ ] 7. Heywang-Köbrunner SH, Dershaw DD, Schreer I. Diagnostic breast imaging: mammography, sonography, magnetic resonance imaging, and interventional procedures. 2nd ed. New York, NY: Georg Thieme Verlag, 2001;393. [ ] 8. Knutzen AM, Gisvold JJ. Likelihood of malignant disease for various categories of mammographically detected, nonpalpable breast lesions. Mayo Clin Proc 1993;68:454–460. [ ] 9. American College of Radiology. Breast Imaging Reporting and Data System (BI-RADS). Reston, VA: American College of Radiology, 1993. [ ] 10. American College of Radiology. Breast Imaging Reporting and Data System (BI-RADS). 2nd ed. Reston, VA: American College of Radiology, 1995. [ ] 11. American College of Radiology. Breast Imaging Reporting and Data System (BI-RADS®). 3rd ed. Reston, VA: American College of Radiology, 1998. [ ] 12. American College of Radiology. Breast Imaging Reporting and Data System (BI-RADS® ). 4th ed. Reston, VA: American College of Radiology, 2003. [ ] 13. Chala LF, Barros N. ACR BI-RADS™ na ultra-sonografia. Radiol Bras 2004;37(2):III–IV. [ ] 14. Camargo Júnior HSA. BI-RADS®-ultra-som: vantagens e desvantagens dessa nova ferramenta de trabalho. Radiol Bras 2005;38:301–303. [ ] 15. Zonderland HM, Pope TL Jr, Nieborg AJ. The positive predictive value of the Breast Imaging Reporting and Data System (BI-RADS) as a method of quality assessment in breast imaging in a hospital population. Eur Radiol 2004;14: 1743–1750. [ ] 16. Orel SG, Kay N, Reynolds C, Sullivan DC. BI-RADS categorization as a predictor of malignancy. Radiology 1999;211:845–850. [ ] 17. Ball CG, Butchart M, MacFarlane JK. Effect on biopsy technique of the breast imaging reporting and data system (BI-RADS) for nonpalpable mammographic abnormalities. Can J Surg 2002; 45:259–263. [ ] 18. Tan YY, Wee SB, Tan MP, Chong BK. Positive predictive value of BI-RADS categorization in an Asian population. Asian J Surg 2004;27:186–191. [ ] 19. Bérubé M, Curpen B, Ugolini P, Lalonde L, Ouimet-Oliva D. Level of suspicion of a mammographic lesion: use of features defined by BI-RADS lexicon and correlation with large-core breast biopsy. Can Assoc Radiol J 1998;49:223-–228. [ ] 20. Tate PS, Rogers EL, McGee EM, et al. Stereotactic breast biopsy: a six-year surgical experience. J Ky Med Assoc 2001;99:98–103. [ ] 21. Margolin FR, Leung JW, Jacobs RP, Denny SR. Percutaneous imaging-guided core breast biopsy: 5 years' experience in a community hospital. AJR Am J Roentgenol 2001;177:559–564. [ ] 22. Travade A, Isnard A, Bagard C, et al. Macrobiopsies stéréotaxiques par système à aspiration 11-G: à propos de 249 patientes. J Radiol 2002;83(9 Pt 1):1063–1071. [ ] 23. Mendez A, Cabanillas F, Echenique M, Malekshamran K, Perez I, Ramos E. Mammographic features and correlation with biopsy findings using 11-gauge stereotactic vacuum-assisted breast biopsy (SVABB). Ann Oncol 2004;15:450–454. [ ] 24. Lacquement MA, Mitchell D, Hollingsworth AB. Positive predictive value of the Breast Imaging Reporting and Data System. J Am Coll Surg 1999;189:34–40. [ ] 25. Liberman L, Abramson AF, Squires FB, Glassman JR, Morris EA, Dershaw DD. The breast imaging reporting and data system: positive predictive value of mammographic features and final assessment categories. AJR Am J Roentgenol 1998; 171:35–40. [ ] 26. Jackman RJ, Nowels KW, Rodriguez-Soto J, Marzoni FA Jr, Finkelstein SI, Shepard MJ. Stereotactic, automated, large-core needle biopsy of nonpalpable breast lesions: false-negative and histologic underestimation rates after long-term follow-up. Radiology 1999;210:799–805. [ ] 27. Lee CH, Philpotts LE, Horvath LJ, Tocino I. Follow-up of breast lesions diagnosed as benign with stereotactic core-needle biopsy: frequency of mammographic change and false-negative rate. Radiology 1999;212:189–194. [ ] 28. Liberman L. Percutaneous image-guided core breast biopsy. Radiol Clin North Am 2002;40: 483–500. [ ] 29. Liberman L, Menell JH. Breast Imaging Reporting and Data System (BI-RADS). Radiol Clin North Am 2002;40:409–430. [ ] 30. Godinho ER, Koch HA. Breast Imaging Reporting and Data System (BI-RADS™): como tem sido utilizado? Radiol Bras 2004;37:413–417. [ ] 31. Berg WA, Campassi C, Langenberg P, Sexton MJ. Breast Imaging Reporting and Data System: inter- and intraobserver variability in feature analysis and final assessment. AJR Am J Roentgenol 2000;174:1769–1777. [ ] 32. Smith-Bindman R, Chu PW, Miglioretti DL, et al. Comparison of screening mammography in the United States and the United Kingdom. JAMA 2003;290:2129–2137. [ ]
Recebido para publicação em 11/7/2005.
* Trabalho realizado no Serviço de Radiologia do Hospital do Câncer III – Instituto Nacional de Câncer-Ministério da Saúde (INCA-MS), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554