Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 40 nº 3 - Maio / Jun. of 2007
Vol. 40 nº 3 - Maio / Jun. of 2007
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Leonardo Lopes de Macedo, Lucas Rios Torres, Rafael Artigas Faucz, Olger de Souza Tornin, Fábio Mota Gonzalez, Igor Motta de Aquino, Carlos Alberto Marcovechio Fonseca, Alexandre Pescioto, Ricardo Pires de Souza |
|
|
Descritores: Tumor do estroma gastrintestinal, Neoplasias gastrintestinais, Doenças gastrintestinais, Sarcoma |
|
|
Resumo: VMédico Radiologista, Mestrando em Ciências da Saúde pela Pós-graduação do Hospital Heliópolis, São Paulo, SP, Brasil
INTRODUÇÃO Tumores do estroma gastrintestinal (GIST) são as neoplasias mesenquimais mais comuns do trato gastrintestinal e são caracterizados pela expressão do KIT (CD117), um receptor do fator de crescimento da tirosinoquinase(1–3). Apesar de ocorrerem em qualquer parte do trato digestivo, eles correspondem a apenas 1% dos tumores desses órgãos(2). Acometem indivíduos acima dos 50 anos de idade, sendo raramente encontrados antes dos 40 anos(4). Os sintomas são inespecíficos e a tomografia computadorizada (TC) é o método de escolha para o diagnóstico da lesão(5). Os GIST eram designados como tumores de músculo liso, junto com leiomiomas, leiomiossarcomas e leiomioblastomas(2). Com o surgimento da avaliação por imuno-histoquímica e a descoberta de marcadores como o KIT, esses tumores passaram a ser classificados separadamente em uma nova classe de tumores, o que é extremamente importante, pois apresentam prognóstico e tratamento diferentes(6). Os GIST variam muito na forma de apresentação, desde lesões pequenas e assintomáticas descobertas acidentalmente, até massas de tamanho suficiente para gerar sintomas, inclusive com múltiplas metástases(2). Estas últimas, geralmente, acometem o fígado e o peritônio, mas raramente os linfonodos(1,5,7). Nos casos de tumores localizados, a ressecção cirúrgica é o tratamento de escolha(5). Em pacientes com doença inoperável ou metastática está indicado o início imediato da droga imatinib (STI571), um inibidor da tirosinoquinase(5,7,8). Por ser uma doença recentemente descrita, procuramos demonstrar a importância dos exames de imagem em localizar esses tumores, podendo, algumas vezes, auxiliar no diagnóstico diferencial anatomopatológico.
MATERIAIS E MÉTODOS O modelo de estudo utilizado foi não-experimental (observacional) e retrospectivo. Foram obtidas informações a respeito de 16 pacientes portadores de GIST operados em nossa instituição, entre dezembro de 2000 e março de 2006. Somente as lesões com padrões histopatológicos e imuno-histoquímicos (KIT positivos) compatíveis com GIST foram incluídas. Excluíram-se do estudo todos os pacientes KIT negativos. As variáveis analisadas foram sexo e idade dos pacientes, sinais e sintomas na consulta inicial, localização primária e tamanho do tumor, achados radiológicos, características anatomopatológicas da lesão, presença de metástase no momento do diagnóstico e incidência de metástases ou recorrência do tumor no acompanhamento desses pacientes. Os exames de imagem de 12 dos 16 pacientes (12 TC e duas seriografias esôfago-estômago-duodeno – EED) foram avaliados por dois radiologistas de nossa instituição com título de especialista pelo Colégio Brasileiro de Radiologia e Diagnóstico por Imagem. Dos outros quatro pacientes sem o filme de TC, conseguimos recuperar apenas os laudos desses exames. Os sinais radiológicos avaliados foram localização e tamanho da lesão, realce pelo meio de contraste, margens, contornos, hipodensidade central, calcificações e presença de metástases.
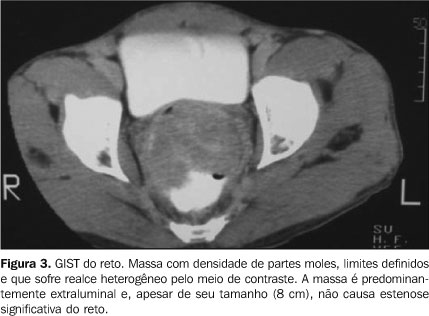
RESULTADOS A população em estudo constou de nove homens e sete mulheres. A média de idade entre os homens foi de 49 anos (variação de 25 a 66 anos) e entre as mulheres foi de 69 anos (variação de 63 a 75 anos). A média do grupo foi de 58 anos. As principais queixas dos pacientes na consulta inicial foram perda de peso (n = 8), dor abdominal (n = 7), náuseas (n = 5), vômitos (n = 3), hemorragia digestiva alta (n = 1), hematoquezia (n = 1) e melena (n = 1). Dois pacientes foram admitidos no hospital com quadro de abdome agudo obstrutivo e um paciente foi admitido com quadro de suboclusão intestinal. Os locais de origem dos tumores primários foram o estômago (n = 5), o reto (n = 4), o intestino delgado (n = 3), o mesentério (n = 3) e o sigmóide (n = 1). O tamanho do tumor variou de 2 cm a 20 cm (média de 9 cm), com os tumores do estômago apresentando média de 3 cm e os do mesentério (Figura 1), média de 15 cm. À TC todos os tumores apresentaram realce heterogêneo pelo meio de contraste. As neoplasias gástricas apresentavam margens circunscritas e contornos discretamente lobulados, com apenas um tumor (o maior deles, com 6 cm) apresentando uma área hipodensa central. Os tumores do mesentério, assim como os tumores do intestino delgado (Figura 2), exerciam efeito de massa com compressão de estruturas adjacentes. Eles eram maiores, com margens lobuladas, e apenas um tumor não apresentou área hipodensa central. Massa mural que abaulava a mucosa, com margens discretamente lobuladas, foi a principal apresentação dos tumores do reto (Figura 3). Calcificação foi caracterizada em dois tumores do mesentério.
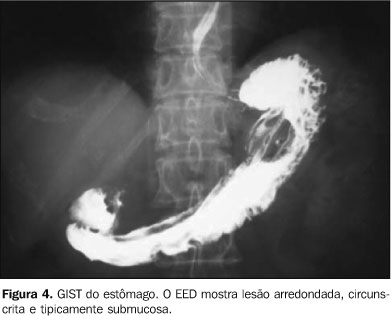
Nos dois casos avaliados pelo EED encontramos uma massa circunscrita, tipicamente submucosa e sem sinais de ulceração (Figura 4).
A avaliação histopatológica revelou que 13 pacientes apresentaram tumores com células fusiformes (Figura 5A) e os outros três, tumores com células epitelióides (um caso do intestino delgado e dois casos do reto). A avaliação imuno-histoquímica foi fundamental para a confirmação do diagnóstico e em todos os casos apresentou positividade para o C-KIT (Figura 5B). Quatro pacientes apresentaram metástases para o fígado no momento do diagnóstico e outros cinco apresentaram recorrência do tumor, sendo quatro casos para o peritônio e um para o fígado, num período médio de dois anos e oito meses. O tempo de recorrência variou de dois meses a oito anos e oito meses (média de dois anos e oito meses). As metástases hepáticas foram hipoatenuantes em relação ao parênquima normal adjacente e de limites definidos.
DISCUSSÃO GIST são as neoplasias mesenquimais mais comuns do trato gastrintestinal e podem ocorrer em qualquer sítio deste(1,3). Cerca de 40–70% acometem o estômago, respondendo por 2,5% dos tumores gástricos, 20–40% acometem o intestino delgado e o restante dos casos se distribui em outros locais como o esôfago, os cólons, o reto, o mesentério e o omento(9,10). Acometem indivíduos acima de 50 anos de idade, sendo raros antes dos 40 anos, com pequena preferência pelo sexo masculino(4,7). Em nossa casuística, a média de idade, no momento do diagnóstico, dos homens foi bem inferior à das mulheres, o que levanta a possibilidade de os GIST acometerem os homens numa idade mais precoce. Este dado não é relatado na literatura. Os sintomas clínicos são inespecíficos e dependem basicamente da localização e tamanho da lesão. Dor abdominal, distensão, sangramento gastrintestinal, anemia, emagrecimento e massa palpável são algumas de suas possíveis manifestações(4,7). Podem atingir grandes dimensões, com tamanho variando, usualmente, entre 3 cm e 10 cm(1) e, por terem crescimento predominantemente extraluminal, raramente causam sintomas obstrutivos(1,4,11). Observamos que os tumores do estômago foram bem menores, na ocasião do diagnóstico, em relação aos tumores do mesentério, o que corrobora a literatura(12,13). Histologicamente, podem ser classificados, conforme o tipo celular predominante, em três categorias: células fusiformes (70%), epitelióide (20%) e misto (10%)(6). Por meio da avaliação imuno-histoquímica pode-se dosar o KIT (CD117), um receptor do fator de crescimento da tirosinoquinase, sendo este seu marcador mais importante(6,14). A maioria também apresenta positividade para o CD34. Outros possíveis marcadores incluem vimentina, actina, proteína S-100 e desmina (raramente)(1,4,6,9). Esses marcadores são extremamente úteis na diferenciação dos GIST para os outros de origem semelhante, como os leiomiomas, os leiomioblastomas, os leiomiossarcomas e os schwannomas(3). Alguns, como o leiomiossarcoma, podem ter apresentação radiológica e histológica muito semelhante aos GIST, porém o KIT é específico dos GIST(15). Os GIST podem ser benignos ou malignos, sendo fatores de pior prognóstico a localização distal no intestino, o tamanho do tumor, o alto grau de atividade mitótica e a presença de metástases(6,10). Não existe correlação entre grau de necrose, hemorragia ou padrão de realce ao meio de contraste pelo estudo tomográfico que indique maior ou menor potencial maligno(4). Apesar de alguns trabalhos demonstrarem que menos de 50% dos tumores primários localizados não recorrem em cinco anos(10), sabemos que nos casos de recorrência no fígado ou peritônio (os dois sítios mais comuns de metástase) o prognóstico é ruim(6). Em nosso estudo, nove pacientes (56% dos casos) apresentaram metástases quando foi feito o diagnóstico ou recorrência do tumor num período médio de dois anos e oito meses, o que demonstra sua alta tendência à malignidade. Como essa é uma doença recentemente descrita, ainda não existem trabalhos que acompanharam um número considerável de pacientes por um longo período de tempo. Atualmente, esses tumores são considerados potencialmente malignos e, portanto, todos os pacientes devem ser rigorosamente tratados e acompanhados(5,6,10). Entre os métodos de imagem disponíveis, a TC ainda é o método de escolha para avaliação das massas abdominais ou de GIST confirmados por biópsia, principalmente pela sua alta disponibilidade(5). Geralmente se apresentam como massa bem circunscrita, originando-se freqüentemente do estômago ou do intestino delgado, e sofrem realce heterogêneo pelo meio de contraste(7,11). Pequenos focos de calcificações podem ser vistos e, comumente, estão relacionados a lesões malignas(12). Áreas de atenuação central podem corresponder a degeneração cística, hemorragia ou necrose do tumor(4,9,13), o que inclui essa neoplasia no diagnóstico diferencial de lesões císticas ou necróticas relacionadas ao estômago ou a estruturas adjacentes(11). Ulceração da mucosa pode ser encontrada em até 50% dos tumores gástricos(1) e dilatações aneurismáticas de alças do intestino delgado, até então relacionadas ao linfoma, podem ser encontradas em até 33% dos GIST entéricos(11). Os GIST do mesentério apresentam, na maioria das vezes, margens bem definidas, contornos lobulados, grandes dimensões (10 cm a 27 cm) e áreas de baixa atenuação central(13). Em sua forma mais agressiva, podem gerar metástases, sendo o fígado e o peritônio os locais mais acometidos. De forma mais rara, disseminações podem ocorrer para linfonodos, ossos ou pulmões. À TC, as metástases hepáticas apresentam realce pelo contraste, por sua natureza usualmente hipervascular(1,7). Vale ressaltar que, na fase portal do estudo por TC, as metástases hepáticas podem se tornar imperceptíveis, o que torna extremamente importante a realização de fase arterial(5). O aparecimento do padrão cístico após o tratamento com a quimioterapia adequada é típico, já descrito na literatura, e não deve ser erroneamente interpretado como progressão da doença ou novas lesões(1,5,16). Os GIST podem ser curados somente por meio do tratamento cirúrgico(5). Pelo fato de não terem cápsula verdadeira, o tumor deve ser ressecado em bloco com margem livre de 2–3 cm se possível. Linfadenectomia não é necessária, pois o tumor raramente gera metástases para linfonodos(2,3,5). No acompanhamento desses pacientes, a realização de TC a cada seis meses durante os primeiros cinco anos deve ser considerada pelo fato de serem tumores potencialmente malignos(5,10). Nos casos de tumores inoperáveis ou metastáticos, o tratamento de escolha é com o imatinib (STI571), um inibidor da tirosinoquinase, não havendo indicação de radioterapia ou quimioterapia. A droga deve ser iniciada no momento em que o diagnóstico de doença metastática ou avançada for realizado, devendo ser mantida até que o paciente desenvolva intolerância ou doença progressiva(3,5). Estudos recentes demonstraram que mais de 50% dos pacientes com doença avançada respondem ao tratamento medicamentoso(8,17,18). Para a avaliação da resposta ao tratamento, a TC continua sendo a modalidade de escolha, apesar de a tomografia por emissão de pósitrons (PET) ter mostrado alta sensibilidade para demonstrar a resposta precoce do tumor(19). Hipoatenuação progressiva da massa, diminuição do realce nodular e da vascularização são parâmetros que indicam boa resposta do tumor ao tratamento(8). No entanto, deve ser ressaltado que alguns tumores aumentam de tamanho durante os primeiros seis meses de tratamento, apesar da melhora clínica importante e da regressão visualizada pelo PET(5,19).
CONCLUSÃO Os GIST, apesar de relativamente raros, são as neoplasias mesenquimais mais comuns do trato gastrintestinal. Acometem adultos de meia-idade e idosos e, apesar de os pacientes apresentarem sintomas inespecíficos, esses tumores devem sempre ser lembrados no diagnóstico diferencial das massas sólidas ou sólidas/císticas da cavidade abdominal. Em nosso trabalho, o local mais comum de ocorrência dos GIST foi o estômago. Os tumores gástricos apresentaram dimensões reduzidas, quando comparados aos tumores do intestino delgado e mesentério. Hipodensidade central foi caracterizada em metade dos casos e nos tumores de maiores dimensões. Calcificação não foi achado comum. A ocorrência de metástases ou recidiva tumoral foi verificada na maioria dos casos. O principal achado à TC foi massa circunscrita, de contornos lobulados, a qual sofre realce heterogêneo pelo meio de contraste. Ao EED, identificamos massa circunscrita e tipicamente submucosa. Esses achados corroboram a literatura(1,4,7). Dois pacientes apresentaram quadro de abdome agudo obstrutivo e um paciente apresentou quadro de suboclusão intestinal na primeira consulta, achados incomuns de apresentação, mas que devem ser lembrados no diagnóstico diferencial de lesões abdominais. Padrão de células fusiformes foi o principal tipo histológico, seguido pelo de células epitelióides, também encontrado na literatura(4,6). Como demonstrado em nosso estudo, os GIST apresentam alta tendência à malignidade. Dessa forma, diagnóstico precoce, tratamento correto e acompanhamento rigoroso são fundamentais. Enfim, é essencial, entre os diagnósticos diferenciais, a suspeita pelo radiologista, a fim de diminuir a morbidade ou mesmo a mortalidade desses pacientes.
REFERÊNCIAS 1. Sandrasegaran K, Rajesh A, Rydberg J, Rushing DA, Akisik FM, Henley JD. Gastrointestinal stromal tumors: clinical, radiologic, and pathologic features. AJR Am J Roentgenol 2005;184:803–811. [ ] 2. Sugár I, Forgács B, István G, Bognár G, Sápy Z, Ondrejka P. Gastrointestinal stromal tumors (GIST). Hepatogastroenterology 2005;52:409–413. [ ] 3. Shinomura Y, Kinoshita K, Tsutsui S, Hirota S. Pathophysiology, diagnosis, and treatment of gastrointestinal stromal tumors. J Gastroenterol 2005;40:775–780. [ ] 4. Levy AD, Remotti HE, Thompson WM, Sobin LH, Miettinen M. Gastrointestinal stromal tumors: radiologic features with pathologic correlation. RadioGraphics 2003;23:283–304. [ ] 5. Blay JY, Bonvalot S, Casali P, et al. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Ann Oncol 2005;16:566–578. [ ] 6. Fletcher CDM, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol 2002;33:459–465. [ ] 7. Burkill GJC, Badran M, Al-Muderis O, et al. Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread. Radiology 2003;226:527–532. [ ] 8. Dagher R, Cohen M, Williams G, et al. Approval summary: imatinib mesylate in the treatment of metastatic and/or unresectable malignant gastrointestinal stromal tumors. Clin Cancer Res 2002;8:3034–3038. [ ] 9. Sharp RM, Ansel HF, Keel SB. Best cases of the AFIP: gastrointestinal stromal tumor. Armed Forces Institute of Pathology. RadioGraphics 2001;21:1557–1560. [ ] 10. DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 2000;231:51–58. [ ] 11. Sandrasegaran K, Rajesh A, Rushing DA, Rydberg J, Akisik FM, Henley JD. Gastrointestinal stromal tumors: CT and MRI findings. Eur Radiol 2005;15:1407–1414. [ ] 12. Kim HC, Lee JM, Kim KW, et al. Gastrointestinal stromal tumors of the stomach: CT findings and prediction of malignancy. AJR Am J Roentgenol 2004;183:893–898. [ ] 13. Kim HC, Lee JM, Kim SH, et al. Primary gastrointestinal stromal tumors in the omentum and mesentery: CT findings and pathologic correlations. AJR Am J Roentgenol 2004;182:1463–1467. [ ] 14. Medeiros F, Corless CL, Duensing A, et al. KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol 2004;28:889–894. [ ] 15. Miettinen M, Sarlomo-Rikala M, Sobin LH, Lasota J. Gastrointestinal stromal tumors and leiomyosarcomas in the colon: a clinicopathologic, immunohistochemical, and molecular genetic study of 44 cases. Am J Surg Pathol 2000;24: 1339–1352. [ ] 16. Chen MY, Bechtold RE, Savage PD. Cystic changes in hepatic metastases from gastrointestinal stromal tumors (GISTs) treated with Gleevec (imatinib mesylate). AJR Am J Roentgenol 2002; 179:1059–1062. [ ] 17. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002;347:472–480. [ ] 18. van Oosterom AT, Judson I, Verweij J, et al. Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet 2001;358:1421–1423. [ ] 19. Antoch G, Kanja J, Bauer S, et al. Comparison of PET, CT, and dual-modality PET/CT imaging for monitoring of imatinib (STI571) therapy in patients with gastrointestinal stromal tumors. J Nucl Med 2004;45:357–365. [ ]
Recebido para publicação em 27/5/2006.
* Trabalho realizado no Serviço de Radiologia e Diagnóstico por Imagem do Hospital Heliópolis, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554