Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 40 nº 2 - Mar. / Abr. of 2007
Vol. 40 nº 2 - Mar. / Abr. of 2007
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Rodrigo Souza Dias, Adelmo José Giordani, Clélia Maria Erwenne, Helena Regina Comodo Segreto, Luiz Fernando Teixeira, Roberto Araujo Segreto |
|
|
Descritores: Melanoma uveal, Placa de rutênio, Tratamento conservador, Braquiterapia |
|
|
Resumo:
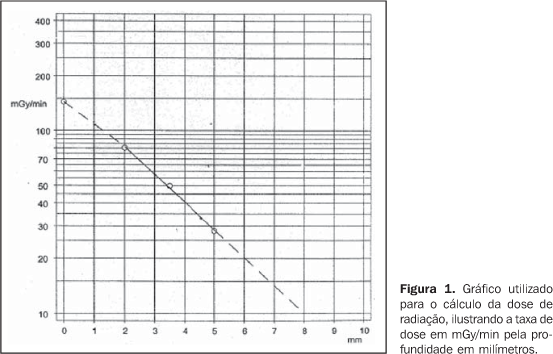
INTRODUÇÃO Apesar de raro, o melanoma uveal é o tumor maligno primário intra-ocular mais comum em adultos, com freqüência aproximada de seis pessoas por milhão por ano nos Estados Unidos(1,2), sete pessoas por milhão por ano na Europa Ocidental(3), e não existe estimativa para o Brasil. Até a década de 1980, o tratamento para pacientes com melanoma uveal era a cirurgia, constituída pela enucleação, que é ainda a principal modalidade de tratamento para lesões avançadas. Entretanto, outras terapias com o intuito de preservação da visão e do globo ocular já foram propostas desde 1930(4). Em 1930, Moore utilizou sementes de radônio implantadas diretamente no tumor ocular de um paciente(4). Em 1960, Stallard iniciava o tratamento desses tumores com placas episclerais de cobalto-60(5). Desde então, outros isótopos, como iodo-125, irídio-192, ouro-198, paládio-103 e rutênio-106, passaram a ser utilizados(6–8). Estudos prospectivos randomizados, como os do Collaborative Ocular Melanoma Study (COMS), a partir de 1986, mostraram que a taxa de mortalidade de pacientes com melanomas com altura entre 2,5 mm e 10 mm era semelhante quando comparada a braquiterapia com iodo-125 e a enucleação(6). Também em 1986, Lommatzsch publicou resultados com a radiação beta do rutênio-106 para o tratamento de melanomas uveais, com resultados comparáveis aos de outros radioisótopos(7). Assim, a braquiterapia ocular passou a ser empregada em pacientes portadores de melanomas uveais com alturas de até 10 mm, permitindo resultados semelhantes a de procedimentos mais radicais como a enucleação, ao mesmo passo que preservava a acuidade visual e o globo ocular. Dentre os radioisótopos mais freqüentemente utilizados na braquiterapia ocular, tem-se o cobalto-60, que é um emissor de radiação gama com energia de 1,25 MeV e meia-vida de 5,2 anos, e que tem como principais desvantagens a maior exposição da equipe médica e maior dose de radiação em órgãos adjacentes, e o iodo-125, que é um emissor de radiação gama com energia de 0,028 MeV e meia-vida relativamente curta de 59,6 dias. Em relação ao rutênio-106, este isótopo apresenta como principal característica a emissão de radiação beta, o que permite maior concentração de dose no tumor e menor dose em áreas vizinhas. Além disso, propicia menor exposição à equipe médica envolvida no procedimento e doses menores de radiação em órgãos de risco do paciente, otimizando assim a proteção radiológica(3,8). Em virtude de o rutênio-106 ser um emissor beta, é mais bem indicado no tratamento de melanomas pequenos, com alturas de até 6 mm. Apresenta meia-vida física longa e permite mais tempo de uso, e portanto, menor custo quando comparado aos outros materiais. Para o cálculo da dose de radiação do rutênio são usadas tabelas fornecidas pelo fabricante, não sendo necessário o uso de sistemas de planejamento computadorizados, que também encarecem seu uso(9) (Figura 1).
As principais complicações associadas à braquiterapia são a retinopatia, a catarata, o glaucoma neovascular e a maculopatia, que podem ocorrer de 9% a 27% dos casos em um período de três anos. Os principais fatores que parecem estar relacionados com essas complicações são a altura do tumor, o estádio TNM e a proximidade do tumor à fóvea e ao disco óptico(10). Mais recentemente, a termoterapia transpupilar começou a ser utilizada. Consiste no emprego do laser diodo infravermelho para indução de hipertermia, com variação de 45°C a 60°C. Esta modalidade terapêutica está indicada de forma exclusiva em melanomas pequenos, concomitante à braquiterapia, o que permite o tratamento de lesões maiores que 5 mm, ou ainda, de forma adjuvante, em casos que não apresentam boa regressão e/ou recorrência da doença(11). A termoterapia transpupilar é caracterizada por penetração profunda e exerce efeito citotóxico imediato, o que resulta em necrose do tumor até uma profundidade de 6 mm em experimentos com animais e de 4,7 mm em melanomas de coróide em humanos(12). O tratamento ideal para os melanomas oculares permanece ainda controverso, sendo a braquiterapia ocular e a radioterapia externa com feixe de prótons opções terapêuticas adequadas para a manutenção do globo ocular e da visão(13,14). O presente trabalho tem como objetivo analisar os resultados preliminares da braquiterapia com rutênio-106 em pacientes portadores de melanomas uveais.
MATERIAIS E MÉTODOS Este é um trabalho prospectivo realizado com 20 pacientes portadores de melanoma uveal unilateral, encaminhados ao Setor de Radioterapia pelo Departamento de Oftalmologia da Universidade Federal de São Paulo, para braquiterapia ocular, no período de abril de 2002 a julho de 2003. O diagnóstico foi realizado por meio de exame clínico e oftalmológico. Foram solicitados exames complementares como angiofluoresceinografia e ultra-sonografia ocular nos modos A e B. Para a determinação da altura do tumor, os dois modos foram utilizados. Para a avaliação dos tumores localizados em íris e corpo ciliar, foi realizada biomicroscopia ultra-sônica. O estadiamento dos pacientes incluiu radiografia de tórax, ultra-sonografia de abdome, hemograma e análise bioquímica para a caracterização de ausência de lesão metastática. Os pacientes foram estadiados pela classificação TNM(15) e COMS(16–18). Para inclusão dos pacientes no estudo, os seguintes critérios foram adotados: diagnóstico de melanoma unilateral de coróide, íris ou corpo ciliar; altura da lesão menor ou igual a 6 mm; diâmetro da base menor ou igual a 16 mm; pacientes com idade maior ou igual a 21 anos; termo de consentimento do paciente. Os critérios de exclusão adotados foram os seguintes: diagnóstico de outra malignidade; pacientes em uso de imunossupressores; pacientes não-capazes de retorno para seguimento; pacientes com co-morbidades graves; lesões multifocais ou difusas, com infiltração da esclera; pacientes tratados previamente; pacientes portadores de metástases; lesões não-possíveis de serem delimitadas pela ultra-sonografia ocular. Foi utilizada placa oftálmica de rutênio-106 fornecida pela Bebig GmbH (Berlim, Alemanha). Esta placa apresenta como principal característica a emissão de radiação beta, com energia máxima de 3,54 MeV e período de semidesintegração de 365 dias. Dois modelos de placa foram usados: a circular (CCB) e a circular com entalhe (COB), ambas com diâmetro de 20 mm (Figura 2). Pacientes com lesões próximas ao nervo óptico foram submetidos a braquiterapia com a placa COB, enquanto nos restantes foi utilizada a placa CCB. Pacientes com lesões de altura maior que 5 mm (cinco pacientes) foram submetidos a termoterapia transpupilar direcionada ao ápice do tumor, concomitante à colocação da placa oftálmica. A dose de radiação prescrita foi calculada no ápice da lesão, a partir da face interna da esclera.
Foram analisadas as características demográficas (idade e sexo), as características tumorais (sítio da lesão, olho acometido, estadiamento TNM e COMS, altura do tumor) e as características do tratamento (placa utilizada e dose prescrita no ápice, na base e na esclera) dos pacientes. Após o tratamento, os pacientes foram avaliados clinicamente a cada três meses nos primeiros dois anos de seguimento, com o objetivo de verificar-se o controle local, a sobrevida livre de progressão, a altura da lesão, a taxa de preservação do globo ocular, a acuidade visual e a presença de metástases e de complicações. Ultra-sonografia ocular e angiofluoresceinografia foram realizadas a cada três meses, e radiografia de tórax e ultra-sonografia de abdome a cada seis meses. Controle local foi definido como estabilização ou diminuição da altura da lesão ao exame de imagem, quando comparado ao exame prévio ao tratamento. A presença de lesões em outros sítios foi definida como metástase. Sobrevida livre de progressão foi estabelecida como a ausência de falha local ou a distância. Efeitos adversos relacionados ao tratamento foram considerados como complicações. O seguimento foi considerado a partir da data da colocação da placa. Os parâmetros referentes às características demográficas, tumorais e do tratamento, taxa de preservação do globo ocular, presença de metástases e complicações foram submetidos a análise descritiva. Para comparar as variáveis numéricas em relação ao controle local, altura da lesão antes e depois do tratamento, e acuidade visual, foram calculadas medidas resumo e construídos box-plots. O teste-t foi utilizado para avaliação das variáveis referentes ao controle local e acuidade visual, e o teste-T pareado para comparação da altura tumoral pré e pós-tratamento. Foram construídas tabelas de contingência e foi usado o teste exato de Fisher para as variáveis categóricas. Para estimar as curvas de sobrevivência de interesse em relação à sobrevida livre de progressão, foram construídas curvas de Kaplan-Meier. Em todos os testes fixou-se em 0,05 ou 5% (p < 0,05) o nível de rejeição da hipótese de nulidade, assinalando-se com um asterisco os valores significantes e pela indicação (NS) os não-significantes.
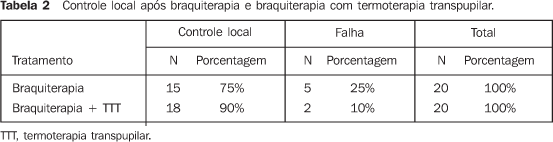
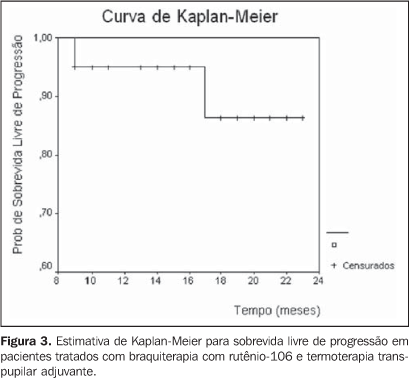
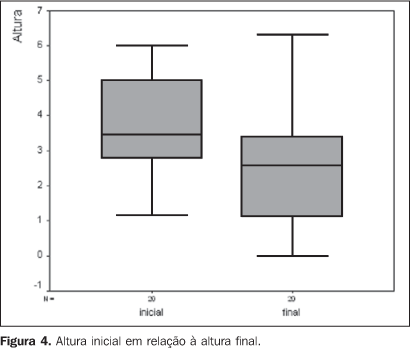
RESULTADOS A idade dos pacientes variou de 29 a 80 anos, com mediana da 56 anos. A maioria dos pacientes era do sexo feminino (70%) e de cor branca (95%) (Tabela 1). Quanto às características tumorais, o olho direito estava comprometido em 45% dos casos e o esquerdo, em 55%. Melanoma de coróide e/ou corpo ciliar foi diagnosticado em 85% dos pacientes e melanoma de íris em 15% destes. A altura da lesão variou de 1,14 mm a 6 mm, com mediana de 3,45 mm (Tabela 1). Pelo estadiamento TNM, 20% dos pacientes eram T1 e 80% eram T2. Pelo COMS, 10% eram pequenos e o restante, intermediário. Em relação ao tratamento, a dose no ápice da lesão variou de 55,8 Gy a 104,8 Gy, com mediana de 84,6 Gy. A mediana da dose na base do tumor e na esclera foi de 248,3 Gy e 319,4 Gy, respectivamente. A placa CCB foi utilizada em 75% dos casos. O tempo de seguimento variou de 9 a 23 meses, com mediana de 19 meses. Durante o seguimento clínico foi observado aumento das dimensões tumorais em cinco casos (25%). Destes, três pacientes foram submetidos a termoterapia transpupilar adjuvante e encontram-se em seguimento, sem evidências de progressão da doença. Em dois pacientes a termoterapia transpupilar não foi possível devido à localização da lesão. Em um paciente optou-se por observação e o outro encontra-se em programação de enucleação. Na Tabela 2 podemos observar o controle local com a braquiterapia e com a associação com a termoterapia transpupilar. A altura inicial da lesão (p = 0,883), a dose prescrita no ápice tumoral (p = 0,879) e a localização da lesão (p = 1,000) não constituíram fatores prognósticos significativos para o controle local. A sobrevida livre de progressão com a braquiterapia e com a termoterapia transpupilar adjuvante pode ser visualizada através das curvas de sobrevivência de Kaplan-Meier (Figura 3). Um paciente faleceu após nove meses do tratamento, por causa não-relacionada ao melanoma uveal. Quando comparada a altura inicial da lesão com a altura após o tratamento, observou-se redução significante (p = 0,001) (Figura 4). Nenhum dos pacientes foi submetido a enucleação. Em relação à acuidade visual no momento da última avaliação, 70% dos pacientes apresentavam acuidade visual maior que 20/200 e 30% apresentavam acuidade visual menor ou igual a 20/200. As doses prescritas na base da lesão e na esclera não constituíram fator prognóstico significativo para a acuidade visual.
Durante o seguimento não foram diagnosticadas metástases a distância. Complicações foram observadas em 25% dos casos. Em quatro pacientes foi observada piora da acuidade visual durante o seguimento e um paciente apresentou complicação infecciosa.
DISCUSSÃO Os resultados referentes às características demográficas se comparam favoravelmente a trabalhos prévios encontrados na literatura, que evidenciam predominância do melanoma uveal em pacientes de raça branca, com idade mediana de 60 anos. Singh e Topham, em análise epidemiológica do melanoma uveal nos Estados Unidos, referem incidência de 97,8% dos melanomas em indivíduos da raça branca. Neste mesmo estudo, a idade da população avaliada variou de 6 a 100 anos, com mediana de 59,4 anos para os homens e 61,5 para as mulheres. Em relação ao sexo, o melanoma uveal parece ter incidência discretamente maior em homens. Apesar deste fato não ter sido observado no presente estudo, isto pode ser justificado pelo pequeno número de pacientes quando comparado a trabalhos realizados para avaliação de incidência(1). Quando avaliadas as características tumorais, os melanomas estavam mais freqüentemente localizados na coróide. Observou-se ainda maior número de casos de melanomas de íris quando comparado à literatura, que mostra incidência de apenas 2% a 3% para lesões localizadas nesta topografia(19). A discreta predominância no olho esquerdo aqui observada é também relatada em alguns trabalhos na literatura. Hermann et al. constataram que em 56% dos casos os tumores estavam localizados no olho esquerdo(20). No entanto, em estudos envolvendo maior número de casos, esta diferença não foi observada(18). A totalidade das lesões foi estadiada como T1 ou T2N0M0 pelo TNM (6ª edição)(15) e como intermediário pelo COMS. Quando analisadas outras publicações que utilizaram o rutênio-106 no tratamento de melanomas, observa-se também predomínio de tumores T1 e T2. Isto se deve ao fato de o rutênio-106 ser um emissor beta e com baixa penetrabilidade, e seu uso não ser indicado em lesões mais avançadas. Pode-se ainda acrescentar que a grande maioria dos trabalhos se baseou no estadiamento recomendado pela International Union Against Câncer (UICC) em 1997(21), que classificava melanomas de coróide com altura maior do que 5 mm e/ou diâmetro maior do que 15 mm como T3. Pela 6ª edição do TNM, apenas as lesões com mais de 16 mm em seu maior diâmetro e/ou mais de 10 mm de altura seriam classificadas como T3. Assim, considerando o novo estadiamento, pode-se dizer que a incidência de tumores T1 e T2 descrita na literatura provavelmente seja maior. Isto ainda pode ser confirmado quando comparada a altura mediana das lesões do presente estudo, que foi de 3,45 mm, com a descrita na literatura, que varia de 3 mm a 5,2 mm(22,23). A placa mais utilizada foi o modelo CCB (de formato circular). A grande maioria dos estudos realizados com a placa de rutênio-106 não descreve os modelos de placa usados. No presente estudo, o modelo CCB foi empregado no tratamento de pacientes com lesões centrais, próximas ao nervo óptico, enquanto a placa COB foi utilizada nos restantes. Quando analisada a literatura quanto à localização das lesões, observa-se menor incidência de lesões centrais quando comparadas a lesões paracentrais, periféricas, ou ainda de corpo ciliar e íris. No estudo realizado pelo COMS, lesões localizadas de 0 mm a 2 mm do disco óptico correspondiam apenas a 14,9% dos casos(24). Já em outras publicações, lesões centrais foram presenciadas em 35% dos casos, resultados esses semelhantes aos da presente análise(17). O tempo de permanência da placa de rutênio variou de dois a cinco dias, com mediana de três dias, e foi diretamente proporcional à dose de radiação prescrita no ápice tumoral e inversamente proporcional à atividade da placa. A dose prescrita no ápice do tumor variou de 55 Gy a 105 Gy, com mediana de 85 Gy, e na base a dose prescrita variou de 148 Gy a 450 Gy. A dose na esclera variou de 191 Gy a 578 Gy. A dose de radiação a ser prescrita no ápice tumoral utilizando-se o rutênio-106 ainda não está bem estabelecida na literatura. Quando analisados diversos trabalhos que utilizaram a placa de rutênio no tratamento de melanomas, verifica-se, em sua grande maioria, que a dose varia de 80 Gy a 100 Gy, porém, estudos com doses de 60 Gy até 160 Gy podem ser encontrados. Rouberol et al. trataram 213 pacientes portadores de melanoma de coróide e corpo ciliar com dose de 60 Gy(25). Shields et al., em estudo da acuidade visual em 1.106 pacientes com melanoma uveal submetidos a braquiterapia com iodo-125, rutênio-106, cobalto-60 ou irídio-192, descreveram dose mediana de 90,9 Gy no ápice e 330 Gy na base tumoral(26). Seregard, em meta-análise com 1.066 pacientes tratados com rutênio, observou dose no ápice variando de 80 Gy a 100 Gy(27). Um estudo descrevendo a experiência holandesa com rutênio para melanoma uveal utilizou doses de até 160 Gy no ápice tumoral e doses na esclera de 220 Gy a 950 Gy(3). Hermann et al., analisando o efeito do escalonamento de dose em relação aos resultados da braquiterapia com placas de rutênio, usou doses de 120 Gy no ápice do tumor(20). Shields et al., em um estudo em que foi utilizada a termoterapia transpupilar de forma concomitante à braquiterapia, descrevem dose no ápice variando de 55 Gy a 124 Gy, com mediana de 90 Gy, e de 254 Gy na base(11). Em relação à dose de radiação que deve ser utilizada, a Sociedade Americana de Braquiterapia recomenda a dose de 85 Gy no ápice da lesão quando usado o iodo-125 como radioisótopo(14). Porém, essas mesmas diretrizes recomendam dose de 120 Gy a 160 Gy para maximizar o efeito curativo quando se usa o rutênio. Entretanto, a Sociedade Americana de Braquiterapia sugere que este grande gradiente de dose pode resultar em elevadas doses na esclera, o que pode provocar maior número de complicações(14). Em trabalho prospectivo randomizado realizado pelo COMS, em que foi utilizado o iodo-125 no tratamento de melanomas de coróide, em 49,9% dos casos a dose no ápice do tumor foi de 85,1 Gy a 120 Gy, e em 41,3% dos pacientes a dose na esclera variou de 293 Gy a 409,9 Gy(27). Dessa forma, excluindo-se trabalhos que avaliaram o escalonamento de dose, as doses utilizadas no presente estudo estão de acordo com os dados da literatura referentes à dose de radiação prescrita no ápice da lesão, na base tumoral e na esclera. Nossos resultados em relação ao controle local e sobrevida livre de progressão são comparáveis com trabalhos pregressos, apesar da dificuldade em se avaliar dados retrospectivos de diferentes centros, em virtude da variação do tempo de seguimento, das dimensões tumorais e das doses utilizadas. Summanen et al., avaliando 100 pacientes tratados com rutênio-106, observaram falha local em 19% dos casos com 0,1 ano a 2,7 anos de seguimento (mediana de 0,7 ano)(28). Isto leva a concluir que as falhas locais ocorrem de forma precoce, principalmente nos primeiros anos de seguimento, sendo muito importante para a interpretação de nossos resultados. Estudos realizados com tempo de seguimento semelhante evidenciam regressão completa do tumor em 57,1% dos casos e recidiva local em 31% dos pacientes(29). Foerster et al., avaliando os resultados do tratamento de 100 pacientes portadores de melanoma uveal com o rutênio, observaram recidiva local de 12%, com tempo de seguimento mediano de dois anos(30). Seregard, em revisão da experiência sueca com a termoterapia transpupilar adjuvante à braquiterapia com rutênio, verificou, num tempo de seguimento de 20 meses, que em 70,3% dos casos houve regressão parcial ou completa da lesão, valores estes muito semelhantes aos 75% de controle local obtido no presente estudo(31). Lommatzsch et al., analisando 141 pacientes submetidos a braquiterapia com rutênio com dose de 100 Gy, observaram sobrevida livre de doença de 89,6% em cinco anos(32). Seregard, em meta-análise envolvendo 1.066 pacientes tratados com rutênio com doses de 80 Gy a 100 Gy, constatou sobrevida livre de doença em cinco anos de 86%(27). Quando analisada a sobrevida livre de progressão dos pacientes submetidos a braquiterapia e termoterapia transpupilar no presente estudo, observa-se que nossos resultados são semelhantes aos descritos na literatura, com tempo maior de seguimento e número maior de casos. Estudos avaliando o efeito do escalonamento de dose sobre o controle local mostram resultados controversos. Tjho-Heslinga et al., utilizando dose no ápice de 160 Gy em 101 pacientes portadores de melanoma uveal, observaram remissão completa e parcial em 62,6% e 31,3% dos casos, respectivamente, resultados estes discretamente superiores aos descritos na literatura com as doses usuais. Nesse trabalho, foi também utilizada a termoterapia transpupilar em 25 pacientes, o que possibilitou a redução da dose de radiação e, conseqüentemente, o risco de retinopatia(3). Porém, em outro estudo em que foi utilizada dose de 120 Gy no ápice da lesão em pacientes com melanomas de coróide, não se observou benefício do escalonamento de dose quanto à sobrevida(20). Quando analisada a literatura, a altura e o maior diâmetro basal do tumor, a dose no ápice tumoral e o descolamento de retina desempenham importante papel em relação ao controle local e à sobrevida livre de doença(27). Na análise dos nossos dados, fatores como a altura da lesão, a dose de radiação e a localização do tumor não influenciaram o controle local. Isto pode ter ocorrido devido ao número de pacientes tratados e ao número de falhas observadas, uma vez que esta é uma neoplasia maligna rara. Pode-se acrescentar, ainda, que o fato de a termoterapia transpupilar ter sido utilizada de forma concomitante à braquiterapia em pacientes com lesões maiores que 5 mm pode ter contribuído para que aqueles pacientes com lesões maiores e que receberam menor dose de radiação no ápice tumoral apresentassem resultados favoráveis e semelhantes aos dos restantes. A altura da lesão pós-tratamento foi significantemente menor que a altura pré-tratamento, evidenciando que o tratamento foi efetivo ao propiciar redução da espessura tumoral, ao redor de 65% da altura inicial. Quando analisada a literatura em relação à redução da altura do tumor após a braquiterapia com rutênio, evidencia-se um decréscimo por volta de 3% ao mês, sendo que a maioria das lesões não regride completamente e estabiliza em um valor constante em torno de 61% da altura inicial após aproximadamente 24 meses(23). Em nossa série, os resultados em relação à enucleação e à acuidade visual se mostraram discretamente melhores que os descritos na literatura. Quivey et al. observaram que 58% dos 239 pacientes tratados com placas de iodo mantiveram visão maior ou igual a 20/200(33). O COMS Report nº 16 avaliou a acuidade visual três anos após a braquiterapia com o iodo e observou taxa de enucleação de 6,2% e acuidade visual menor ou igual a 20/200 em 43% dos casos. Neste mesmo estudo, após 24 meses de seguimento, no intuito de se comparar com nossa série, observou-se que 4% dos pacientes haviam sido enucleados e que 33% deles apresentavam acuidade visual menor ou igual a 20/200(24). Em outra análise da acuidade visual após a braquiterapia, Shields et al. observaram que em 51% dos casos a acuidade visual menor ou igual a 20/200(26). Apesar de os nossos resultados terem mostrado que a dose de radiação prescrita não influencia na acuidade visual, provavelmente em virtude do número de casos, os fatores que parecem estar relacionados com a acuidade visual após o tratamento são o isótopo utilizado, a presença de diabetes, a altura tumoral, a localização da lesão, o tipo de placa usada e a presença de descolamento de retina(24). O aparecimento de metástases é observado em torno de 10% a 20% dos pacientes com melanoma uveal e está relacionado, principalmente, ao tamanho do tumor(34). Em nossa série não foi observada presença de metástases. Isto pode ser explicado pelo fato da presente análise incluir apenas pacientes com lesões iniciais, de altura menor ou igual a 6 mm. Analisando em conjunto, apesar do pequeno tempo de seguimento e número de pacientes, nossos resultados mostram que a braquiterapia com rutênio possibilitou bom controle local e sobrevida livre de progressão na população estudada. Enquanto a enucleação seria o tratamento indicado nesta instituição, o uso deste radioisótopo permitiu, em todos os casos, preservação do globo ocular, e em certo grau a manutenção da acuidade visual. Este é o primeiro trabalho utilizando o rutênio em nosso país e consideramos que este radioisótopo pode ser empregado de forma exclusiva no tratamento de melanomas uveais com altura de até 5 mm, enquanto pacientes com lesões com altura maior que 6 mm devem ser candidatos a braquiterapia com outros radioisótopos. Nos casos de melanomas com altura de 5 mm a 6 mm, a braquiterapia com rutênio deve ser associada à termoterapia transpupilar quando possível.
REFERÊNCIAS 1. Singh AD, Topham A. Incidence of uveal melanoma in the United States: 1973–1997. Ophthalmology 2003;110:956–961. [ ] 2. Shields JA, Shields CL. Introduction to melanocytic tumors of the uvea. In: Shields JA, Shields CL, editors. Intraocular tumors: a text and atlas. Philadelphia: Saunders, 1992;45–60. [ ] 3. Tjho-Heslinga RE, Davellar J, Kemme HM, et al. Results of ruthenium irradiation of uveal melanomas: the Dutch experience. Radiother Oncol 1999;53:133–137. [ ] 4. Moore RF. Choroidal sarcoma treated by the intraocular insertion of radon seeds. Br J Ophthalmol 1930;14:145–146. [ ] 5. Stallard HB. Radiotherapy for malignant melanoma of the choroid. Br J Ophthalmol 1966;50: 147–155. [ ] 6. Collaborative Ocular Melanoma Study Group. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma, III: initial mortality findings. COMS Report No.18. Arch Ophthalmol 2001;119:969–982. [ ] 7. Lommatzsch PK. Results after b-irradiation (106Ru/106Rh) of choroidal melanomas: 20 years' experience. Br J Ophthalmol 1986;70:844–851. [ ] 8. Lommatzsch PK, Werschnik C, Schuster E. Long-term follow-up of Ru-106/Rh-106 brachytherapy for posterior uveal melanoma. Graefes Arch Clin Exp Ophthalmol 2000;238:129–137. [ ] 9. Bebig Isotopen-und Medizintechnick GmbH. Aplicadores oftalmológicos rutênio-106: instruções de emprego. Berlim: Bebig, 2001;04:01–08. [ ] 10. Summanen P, Immonen I, Kivela T, Tommila P, Heikkonen J, Tarkkanen A. Radiation related complications after ruthenium plaque radiotherapy of uveal melanoma. Br J Ophthalmol 1996;80:732–739. [ ] 11. Shields CL, Cater J, Shields JA, et al. Combined plaque radiotherapy and transpupillary thermotherapy for choroidal melanoma: tumor control and treatment complications in 270 consecutive patients. Arch Ophthalmol 2002;120:933–940. [ ] 12. Journée-de Korver JG, Oosterhuis JA, de Wolff-Rouendaal D, Kemme H. Histopathological findings in human choroidal melanomas after transpupillary thermotherapy. Br J Ophthalmol 1997; 81:234–239. [ ] 13. Gragoudas ES, Goitein M, Verhey L, Munzenreider J, Suit HD, Koehler A. Proton beam irradiation. An alternative to enucleation for intraocular melanomas. Ophthalmology 1980;87:571–581. [ ] 14. Nag S, Quivey JM, Earle JD, et al. The American Brachytherapy Society recommendations for brachytherapy of uveal melanomas. Int J Radiat Oncol Biol Phys 2003;56:544–555. [ ] 15. Greene FL, Page DL, Fleming ID, editors. In: AJCC Cancer Staging Manual. 6th ed. New York: Springer-Verlag, 2002;377–382. [ ] 16. The Collaborative Ocular Melanoma Study Group. Factors predictive of growth and treatment of small choroidal melanoma: COMS Report No. 5. Arch Ophthalmol 1997;115:1537–1544. [ ] 17. Diener-West M, Earle JD, Fine SL, et al. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma, II: characteristics of patients enrolled and not enrolled. COMS Report No. 17. Arch Ophthalmol 2001;119:951–965. [ ] 18. The Collaborative Ocular Melanoma Study (COMS) randomized trial of pre-enucleation radiation of large choroidal melanoma I: characteristics of patients enrolled and not enrolled. COMS Report No. 9. Am J Ophthalmol 1998;125:767–778. [ ] 19. Shields CL, Shields JA, Materim M, Gershenbaum E, Singh AD, Smith A. Iris melanoma: risk factors for metastasis in 169 consecutive patients. Ophthalmology 2001;108:172–178. [ ] 20. Hermann RM, Pradier O, Lauritzen K, Ott M, Schmidberger H, Hess CF. Does escalation of the apical dose change treatment outcome in b-radiation of posterior choroidal melanomas with 106Ru plaques? Int J Radiat Oncol Biol Phys 2002;52: 1360–1366. [ ] 21. Sobin LH, Wittkind C. International Union Against Cancer. TNM classification of malignant tumors. 5th ed. New York: Wiley-Liss, 1997. [ ] 22. Stoffelns BM, Kutzner J, Jochem T. Retrospective analysis of ruthenium-106 brachytherapy for small and medium-sized malignant melanoma of the posterior choroid. Klin Monatsbl Augenheilkd 2002;219:216–220. [ ] 23. Kaiserman I, Anteby Y, Chowers I, Blumenthal EZ, Kliers E, Pe'er J. Changes in ultrasound findings in posterior uveal melanoma after ruthenium 106 brachytherapy. Ophthalmology 2002;109: 1137–1141. [ ] 24. Melia BM, Abramson DH, Albert DM, et al. Collaborative Ocular Melanoma Study (COMS) randomized trial of I-125 brachytherapy for medium choroidal melanoma. I. Visual acuity after 3 years. COMS Report No. 16. Ophthalmology 2001;108: 348–366. [ ] 25. Rouberol F, Roy P, Kodjikian L, Gerard JP, Jean-Louis B, Grange JD. Survival, anatomic, and functional long-term results in choroidal and ciliary body melanoma after ruthenium brachytherapy (15 years' experience with beta-rays). Am J Ophthalmol 2004;137:893–900. [ ] 26. Shields CL, Shields JA, Cater J, et al. Plaque radiotherapy for uveal melanoma: long-term visual outcome in 1106 consecutive patients. Arch Ophthalmol 2000;118:1219–1228. [ ] 27. Seregard S. Long-term survival after ruthenium plaque radiotherapy for uveal melanoma. A meta-analysis of studies including 1,066 patients. Acta Ophthalmol Scand 1999;77:414–417. [ ] 28. Summanen P, Immonen I, Heikkonen J, Tommila P, Laatikainen L, Tarkkanen A. Survival of patients and metastatic and local recurrent tumor growth in malignant melanoma of the uvea after ruthenium plaque radiotherapy. Ophthalmic Surg 1993;24:82–90. [ ] 29. Busse H, Muller RP. Techniques and results of 106Ru/106Rh radiation of choroidal tumours. Trans Ophthalmol Soc UK 1983;103(Pt 1):72–77. [ ] 30. Foerster MH, Bornfeld N, Wessing A, Schulz U, Schmitt G, Meyer-Schwickerath G. Treatment of malignant melanomas of the uvea with 106-ruthenium applicators. Report on the first 100 Essen cases. Klin Monatsbl Augenheilkd 1984;185: 490–494. [ ] 31. Seregard S, Landau I. Transpupillary thermotherapy as an adjunct to ruthenium plaque radiotherapy for choroidal melanoma. Acta Ophthalmol Scand 2001;79:19–22. [ ] 32. Lommatzsch PK, Werschnik C, Schuster E. Long-term follow-up of Ru-106/Rh-106 brachytherapy for posterior uveal melanoma. Graefes Arch Clin Exp Ophthalmol 2000;238:129–137. [ ] 33. Quivey JM, Char DH, Phillips TL, Weaver VA, Castro JR, Kroll SM. High intensity 125-iodine (125I) plaque treatment of uveal melanoma. Int J Radiat Oncol Biol Phys 1993;26:613–618. [ ] 34. Kleineidam M, Guthoff R, Bentzen SM. Rates of local control, metastasis, and overall survival in patients with posterior uveal melanomas treated with ruthenium-106 plaques. Radiother Oncol 1993;28:148–156. [ ]
Recebido para publicação em 22/2/2006.
* Trabalho realizado no Setor de Radioterapia do Departamento de Medicina e no Departamento de Oftalmologia da Universidade Federal de São Paulo/Escola Paulista de Medicina (Unifesp/EPM), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554