Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 40 nº 2 - Mar. / Abr. of 2007
Vol. 40 nº 2 - Mar. / Abr. of 2007
|
QUAL O SEU DIAGNÓSTICO?
|
|
|
|
|
Autho(rs): Marcelo Souto Nacif, Amarino Carvalho de Oliveira Júnior, Denise Madeira Moreira, Mônica Regina Nagano, José Hugo Mendes Luz, Marcio dos Santos Martins, Mauro Esteves de Oliveira, Luiz Fernando Mendes, Carlos Eduardo Rochitte |
|
|
Paciente de 67 anos de idade, do sexo feminino, com 80 kg de peso, 1,53 m de altura, proveniente do Estado de Minas Gerais, foi encaminhada para o Serviço de Radiologia e Diagnóstico por Imagem do Hospital Pró-Cardíaco para a realização de ressonância magnética (RM) do coração. Descrição das imagens Figura 1. Aquisições acopladas ao ECG, em cine Fiesta (SSFP), ao final da diástole, nos planos em quatro câmaras (A), eixo curto médio-basal (B), mapa de função segmentar (C) e curva de fluxo aórtico (D). Os átrios apresentam tamanho normal, o ventrículo direito possui volume normal e função preservada, existe dilatação leve do ventrículo esquerdo (VE), com afilamento da parede ínfero-lateral medial e basal, e disfunção global do VE leve, com fração de ejeção estimada em 47,1%. Também foi possível identificar acinesia do segmento ínfero-lateral medial, hipocinesia dos segmentos ínfero-lateral basal e ântero-lateral medial, e os demais segmentos normocinéticos. Notar o aspecto típico do aneurisma apical e a insuficiência aórtica leve. Figura 2. Aquisições acopladas ao ECG. Realce tardio eixo curto médio-basal (A), dois eixos longos duas câmaras perpendiculares entre si (B) e mapa de realce tardio segmentar (C). Notar que houve realce miocárdico tardio (< 50% da área do segmento) nos segmentos ântero-lateral médio e ínfero-lateral basal, e transmural (> 75% da área do segmento) no segmento ínfero-lateral médio. Diagnóstico: Miocardiopatia chagásica.
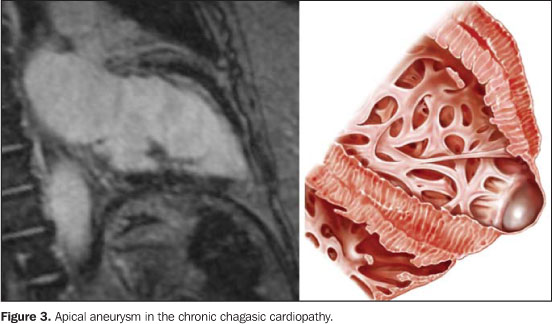
COMENTÁRIOS Descrita pela primeira vez em 1909 por Carlos Chagas(1), a tripanossomíase americana ou moléstia de Chagas — doença causada pelo Trypanosoma cruzi, protozoário pertencente à classe Mastigophora, ordem Kinetoplatida e família Trypanosomatidae — é uma antropozoonose de alta prevalência e de significativa morbidade na América Latina, sendo considerada uma das doenças infecto-parasitárias de maior impacto final no continente(2,3). De fato, os países latino-americanos contam com 16 a 18 milhões de pessoas com a doença, e com cerca de 100 milhões sob o risco de adquiri-la(4,5). Os achados patológicos são bastante sugestivos da moléstia. Macroscopicamente, a cardiopatia chagásica crônica se caracteriza por uma miocardite crônica progressiva com aumento da massa muscular miocárdica — a qual pode atingir a mais de 1.000 gramas —, levando à dilatação das quatro cavidades e conferindo ao coração um aspecto globóide(6,7). O miocárdio está habitualmente amolecido, com espessura irregular, havendo áreas nas quais a parede se adelgaça e regiões onde esta se encontra hipertrofiada. O pericárdio pode achar-se liso, brilhante, transparente, ou ainda espessado. Freqüentemente, o endocárdio valvular não está comprometido, exceto quando existe marcada dilatação do anel com disfunção e insuficiência, o que origina espessamento fibroso valvar. Microscopicamente, constata-se a presença de miocardite crônica, acompanhada de fibrose, em alguns casos com componente granulomatoso (separação das fibras com formação de estruturas pseudofoliculares, com células epitelióides e células gigantes multinucleadas e não-parasitadas), sendo raros os ninhos de amastigotas. As células cardíacas demonstram várias alterações, tais como vacuolização, acúmulo de grânulos de lipofucsina, degeneração hialina, edema intracelular e desorganização das miofibrilas(6,7). As manifestações da cardiopatia chagásica crônica dependerão do grau de comprometimento da função miocárdica. Assim, do ponto de vista clínico-patológico, a apresentação acontece nas seguintes modalidades: 1) Síndrome de insuficiência cardíaca (IC). Uma das lesões típicas relacionadas à IC — mas também às alterações tromboembólicas — é o aneurisma apical, o qual pode variar desde um afilamento fibroso até o estabelecimento de verdadeiras formações aneurismáticas por dilatação sacular, com diâmetro de poucos milímetros até cerca de cinco centímetros, cuja parede está algumas vezes constituída unicamente pela união do endocárdio e do pericárdio (Figura 3).
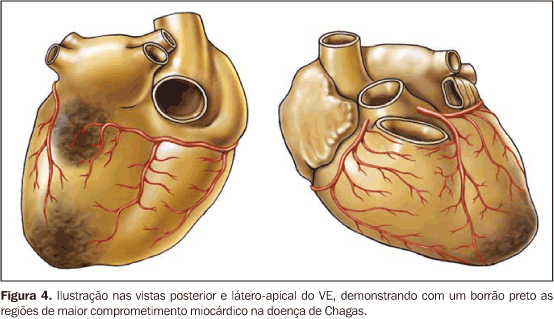
2) Síndrome arrítmica, cujo substrato patológico inclui envolvimento do nodo sinoatrial, nodo atrioventricular e feixe de Hiss, tendo como principais alterações: a) distúrbios da condução atrioventricular e intraventricular; b) disfunção do nodo sinusal; c) transtornos primários e secundários da repolarização ventricular; d) fibrose e inflamação; e) disfunção autonômica; f) disfunção endotelial e coronariana. Todos estes distúrbios podem levar a arritmias de difícil controle(8). A morte súbita predomina como causa de morte cardíaca em todas as formas da doença, sendo fato comum em áreas endêmicas e diagnosticada, erroneamente, como síndrome coronariana aguda. 3) Síndrome tromboembólica, achado freqüente nos pacientes com IC, embora pouco diagnosticada, é fator contribuinte tanto para a refratariedade ao tratamento quanto para o maior risco de morte. Decorre, provavelmente, de: a) estase secundária à dilatação cardíaca; 2) arritmias; 3) fibrose endocárdica; 4) endocardite mural. Os órgãos sistêmicos mais afetados são, em ordem decrescente de freqüência, os rins, o baço e o cérebro(9,10). Contribuições da ressonância cardíaca na doença de Chagas O envolvimento cardíaco é determinante no prognóstico da doença de Chagas. Assim, a avaliação correta do coração é fundamental para o cuidado para com o paciente. Aproximadamente 30% a 40% das pessoas infectadas desenvolverão anormalidades cardíacas durante suas vidas, mas somente 10% a 20% apresentarão a forma sintomática. Os estudos histopatológicos revelam a presença de miocardite crônica leve, manifestada pelo infiltrado mononuclear disperso nos miócitos adjacentes que se submetem aos vários estágios de degeneração e necrose. A fibrose focal e difusa é proeminente, no miocárdio e no sistema de condução. A fibrose miocárdica foi detectada em diversos estudos anatomopatológicos da doença de Chagas, em que os locais predominantes para fibrose e anormalidades da microcirculação do VE foram o ápex do VE e o segmento ínfero-lateral basal (Figura 4).
A análise segmentar por RM e o realce miocárdico tardio mostram claramente, in vivo, que as regiões apical e ínfero-lateral do VE são os locais mais freqüentes para a fibrose miocárdica em pacientes com doença de Chagas, o que concorda com os dados da literatura(11,12). Isto reforça o conceito de que a fibrose miocárdica da doença de Chagas está freqüentemente relacionada com as regiões da circulação terminal como o ápex (circulação terminal entre a artéria coronária descendente anterior e a descendente posterior) e o segmento ínfero-lateral basal (circulação terminal entre a artéria coronária direita e a circunflexa esquerda)(11,12). Perspectivas futuras Os recentes avanços tecnológicos na RM cardíaca estão sendo usados para detectar e quantificar os sinais precoces do envolvimento cardíaco na doença de Chagas, podendo constituir uma informação prognóstica importante. Isto já está sendo feito rotineiramente por avaliação detalhada da função cardíaca, usando a técnica do tagging miocárdico, cine-RM de alta resolução, e o realce tardio para a detecção da fibrose miocárdica. No estudo por RM cardíaca na doença de Chagas estarão as aquisições em uma única apnéia com cine-3D, as técnicas de perfusão miocárdica, da detecção do edema e da inflamação miocárdica, e a monitoração das injeções intramiocárdicas de células-tronco para o tratamento da cardiomiopatia chagásica. Nossa opinião é que a RM do coração poderá ser usada, no futuro, na seleção de pacientes com envolvimento muito precoce do miocárdio pela doença de Chagas. Com este dado poderemos desenvolver novos métodos terapêuticos que mudarão a história natural da doença de Chagas.
REFERÊNCIAS 1. Maguire JH. Chagas' disease – can we stop the deaths? N Engl J Med 2006;355:760–761. 2. Siqueira-Batista R, Moraes HP, Hahn MD. Patogenia e patologia. In: Siqueira-Batista R, Corrêa AD, Gomes AP, Gerull B, editores. Moléstia de Chagas. Rio de Janeiro: Rubio, 2007. 3. Rassi A Jr, Rassi A, Little WC, et al. Development and validation of a risk score for predicting death in Chagas' heart disease. N Engl J Med 2006;355:799–808. 4. Rochitte CE, Tassi EM, Shiozaki AA. The emerging role of MRI in the diagnosis and management of cardiomyopathies. Curr Cardiol Rep 2006;8:44–52. 5. Rochitte CE, Oliveira PF, Andrade JM, et al. Myocardial delayed enhancement by magnetic resonance imaging in patients with Chagas' disease: a marker of disease severity. J Am Coll Cardiol 2005;46:1553–1558. 6. Edelman RR, Hesselink JR, Zlatkin MB, Crues JV III. Clinical magnetic resonance imaging. 3rd ed. Philadelphia: Saunders-Elsevier, 2006. 7. Higuchi ML, Benvenuti LA, Martins RM, Metzger M. Pathophysiology of the heart in Chagas' disease: current status and new developments. Cardiovasc Res 2003;60:96–107. 8. Higuchi ML, Fukasawa S, De Brito T, Parzianello LC, Bellotti G, Ramires JA. Different microcirculatory and interstitial matrix patterns in idiopathic dilated cardiomyopathy and Chagas' disease: a three dimensional confocal microscopy study. Heart 1999;82:279–285. 9. Kalil R, Bocchi EA, Ferreira BM, et al. Magnetic resonance imaging in chronic Chagas cardiopathy. Correlation with endomyocardial biopsy findings. Arq Bras Cardiol 1995;65:413–416. 10. Pereira Barreto AC, Arteaga E, Mady C, Ianni BM, Bellotti G, Pileggi F. Sexo masculino. Fator prognóstico na doença de Chagas. Arq Bras Cardiol 1993;60:225–227. 11. Kim RJ, Judd RM. Gadolinium-enhanced magnetic resonance imaging in hypertrophic cardiomyopathy: in vivo imaging of the pathologic substrate for premature cardiac death? J Am Coll Cardiol 2003;41:1568–1572. 12. Macedo R, Schmidt A, Rochitte CE, Lima JA, Bluemke DA. MRI to assess arrhythmia and cardiomyopathies. J Magn Reson Imaging 2006;24: 1197–1206.
Trabalho realizado no Hospital Pró-Cardíaco, Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554