Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 41 nº 6 - Nov. / Dez. of 2008
Vol. 41 nº 6 - Nov. / Dez. of 2008
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Danilo Bianchini Höfling, Giovanni Guido Cerri, Adriana Gonçalves Juliano, Suemi Marui, Maria Cristina Chammas |
|
|
Descritores: Ultra-sonografia, Ecogenicidade, Tireoidite, Crônica, Auto-imune |
|
|
Resumo: VDoutora, Diretora do Serviço de Ultra-Sonografia do Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil
INTRODUÇÃO As doenças auto-imunes da glândula tireóide representam um espectro de várias desordens que têm em comum a presença de infiltrado linfocítico de intensidade variável no parênquima tireoidiano e produção de anticorpos antitireóide(1). Dentre tais desordens, a tireoidite crônica linfocítica auto-imune destaca-se como a causa mais comum de hipotireoidismo(2) e uma das mais freqüentes doenças auto-imunes organoespecíficas que afetam os seres humanos(3). A tireoidite crônica auto-imune apresenta tendência para se manifestar após os 50 anos de idade(4,5). Acomete 5% a 15% das mulheres e 1% a 5% dos homens, de acordo com os critérios diagnósticos e a localização geográfica(6), podendo ser até nove vezes mais freqüente na mulher(7). Do ponto de vista clínico, a tireoidite crônica auto-imune apresenta-se principalmente sob duas formas: a forma atrófica (tireoidite atrófica) e a forma com bócio ou tireoidite de Hashimoto, descrita por este autor em 1912(8,9). Ambas são caracterizadas pela presença de tireoidite linfocítica, anticorpos antitireóide no sangue e vários graus de disfunção tireoidiana(6). A doença de Graves representa um dos espectros da doença auto-imune da glândula tireóide, que pode estar associada à presença de anticorpos antitireoidianos(6). A tireoidite silenciosa (indolor) e a pós-parto são, também, desordens auto-imunes que apresentam infiltrado linfocítico, geralmente autolimitadas, ambas supostamente atribuídas a manifestações de tireoidite crônica auto-imune(4). Outra forma de doença auto-imune da glândula tireóide, a tireoidite focal, pode simular neoplasias da tireóide(1,10). A tireoidite crônica auto-imune com bócio é caracterizada por infiltrado linfocítico difuso, com ocasionais centros germinativos, folículos tireoidianos contendo escasso colóide, fibrose, alterações oxifílicas, tais como as células de Hürthle ou Askanazy. Na tireoidite crônica auto-imune atrófica a glândula tireóide é pequena, com infiltrado linfocítico e fibrose substituindo o parênquima glandular(6). Em ambas as variantes, o infiltrado linfocítico é o achado patológico característico da presença de auto-imunidade na glândula tireóide(11).
DIAGNÓSTICO CLÍNICO-LABORATORIAL E CITOLÓGICO Os critérios diagnósticos da tireoidite crônica auto-imune baseiam-se no exame clínico e nos exames subsidiários(6). Os pacientes podem apresentar sintomas de hipotireoidismo e o exame físico pode revelar sinais de hipotireoidismo, mas tipicamente encontra-se apenas um bócio difuso, de consistência aumentada, cuja superfície é lobulada ou bocelada que, raramente, pode ser grande o suficiente para causar sintomas compressivos. Por definição, pacientes com a forma atrófica da tireoidite crônica auto-imune não têm bócio(6); ao contrário, apresentam-se com volume glandular reduzido ao diagnóstico. Esta forma pode apresentar-se sem que haja bócio preexistente ou pode resultar de evolução lenta e gradual da forma com bócio(12). O principal marcador laboratorial da tireoidite crônica auto-imune é a presença de anticorpos antitireóide no soro. Anticorpos antitireoglobulina (TgAb) mostram-se presentes em 60% dos pacientes, enquanto os anticorpos antimicrossomal estão presentes em aproximadamente 95% dos pacientes(6). As concentrações de anticorpos antimicrossomal são, na maioria das vezes, mais elevadas do que as de TgAb, e um teste positivo para anticorpos antiperoxidase tireoidiana (TPOAb) é um indicador discretamente mais sensível para a tireoidite crônica auto-imune do que um teste positivo para anticorpos antimicrossomal(6). A cintilografia de tireóide é desnecessária para a confirmação do diagnóstico de tireoidite crônica auto-imune(4,6). Na presença de suspeita clínica desta doença, um teste mostrando altas concentrações de anticorpos antitireóide e um teste para determinação dos níveis de TSH são suficientes para confirmar o diagnóstico(4,6). A biópsia aspirativa por agulha fina deve ser considerada naqueles pacientes em que, apesar de apresentarem manifestações clínicas de tireoidite crônica auto-imune e concentrações elevadas de anticorpos antitireóide, se suspeita de nódulo tireoidiano e, também, na presença de um bócio difuso de crescimento rápido, especialmente nos que recebem terapia com tiroxina, com o intuito de afastar o diagnóstico de linfoma da glândula(1,13).
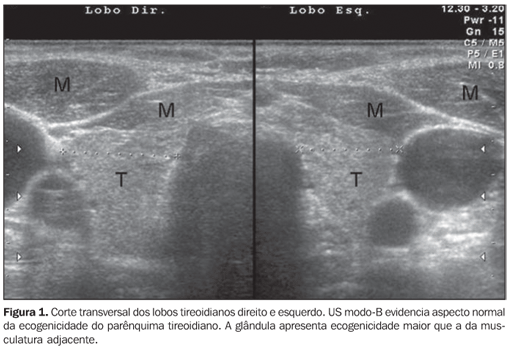
DIAGNÓSTICO ULTRA-SONOGRÁFICO Embora na presença de manifestações clínicas de tireoidite crônica auto-imune um teste positivo para anticorpos antitireóide possa ser considerado suficiente para o seu diagnóstico(6), este método pode se mostrar negativo na fase inicial da doença, bem como em alguns pacientes com hipotireoidismo subclínico(6). Com o desenvolvimento de ensaios mais sensíveis para a detecção de TPOAb, concentrações relativamente baixas podem ser constatadas em indivíduos com outras doenças tireoidianas (bócio multinodular e neoplasias da tireóide)(6) e em indivíduos saudáveis (falso-positivos)(14). Além disso, embora a confirmação de anticorpos antitireóide indique a presença de linfócitos na glândula tireóide (auto-imunidade), esses testes não contribuem para a distinção entre os diversos tipos de doenças auto-imunes da glândula tireóide, tais como a tireoidite focal, a tireoidite difusa e a doença de Graves(1). Dessa forma, um método simples, rápido, não-invasivo, reprodutível e que apresenta alta sensibilidade e especificidade, como a ultra-sonografia (US), pode ser de extrema utilidade para o diagnóstico precoce da tireoidite crônica auto-imune. A US vem evoluindo de forma muito rápida nos últimos anos e está assumindo papel cada vez mais importante no diagnóstico das doenças da glândula tireóide. Vários parâmetros avaliados pela US contribuem para o diagnóstico da tireoidite crônica auto-imune, desde a avaliação ao modo B (volume glandular, textura e ecogenicidade do parênquima tireoidiano) até a realização do dúplex-Doppler colorido. Na prática clínica, o volume da tireóide e a textura do parênquima são descritos em praticamente todos os laudos ultra-sonográficos; embora altamente correlacionado com a presença de tireoidite crônica auto-imune, o relato de ecogenicidade freqüentemente está ausente. Dessa maneira, este artigo tem o objetivo de revisar a importância da avaliação da ecogenicidade ultra-sonográfica do parênquima tireoidiano para o diagnóstico da tireoidite crônica auto-imune, recomendando a descrição sistemática desta variável. A análise da ecogenicidade do parênquima tireoidiano é realizada de modo subjetivo ao compará-la à ecogenicidade dos músculos pré-tireoidianos e da glândula submandibular, classificando-a em isoecogênica, hiperecogênica e hipoecogênica em relação a tais estruturas. Tipicamente, a glândula tireóide normal apresenta ecogenicidade maior que a dos músculos pré-tireoidianos e semelhante ou discretamente maior que a das glândulas submandibulares. Considera-se o parênquima tireoidiano hipoecogênico quando seus níveis de ecos são menores do que nas glândulas submandibulares, ou aproximam-se àqueles dos músculos pré-tireoidianos(15,16). Correlação entre a ecogenicidade e a citopatologia na tireoidite crônica auto-imune As evidências de correlação entre os achados citopatológicos (infiltrado linfocítico) e a redução da ecogenicidade foram obtidas com auxílio da punção aspirativa por agulha fina. Esta técnica foi empregada para avaliar a área ocupada por infiltração linfocítica e fibrose de pacientes com tireoidite crônica auto-imune e observou-se forte correlação entre a presença difusa de acentuado infiltrado linfocítico e fibrose com a intensa redução da ecogenicidade tireoidiana(15). O grau de ecogenicidade foi, também, correlacionado com o diâmetro médio do lúmen folicular, ou seja, ecogenicidade normal foi observada em pacientes com diâmetro médio do lúmen folicular de 67 µm e hipoecogenicidade nos pacientes com diâmetro médio de 25 µm. Dessa forma, a ecogenicidade normal representou estrutura tecidual normofolicular ou macrofolicular, enquanto um padrão de hipoecogenicidade indicou estrutura microfolicular ou sólida, nos pacientes com tireoidite crônica auto-imune(16). A diminuição da ecogenicidade foi provocada, provavelmente, pela redução da interface celular-coloidal dominante da tireóide, que representa o fator essencial na reflexão do som. Assim, na estrutura normofolicular (glândula tireóide normal) ou macrofolicular (bócio colóide), uma grande quantidade de ondas ultra-sônicas interagem com a porção celular-coloidal e são refletidas para o transdutor, proporcionando aspecto ecogênico normal (Figura 1).
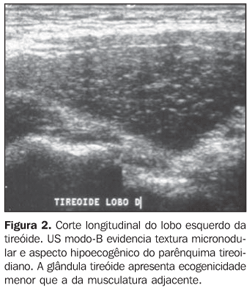
Na redução ou ausência de folículos há redução da interface acústica, provocando grande espalhamento e absorção das ondas ultra-sônicas e pouca reflexão sonora, originando o padrão hipoecogênico (Figura 2)(16). Desse modo, fica claro que a ecogenicidade do parênquima tireoidiano apresenta correlação inversa à presença de infiltrado linfocítico e à desagregação da estrutura folicular. Na doença de Graves a presença de hipoecogenicidade manifesta-se por um mecanismo diferente daquele encontrado na tireoidite crônica auto-imune, uma vez que é decorrente da hipervascularização e da hipercelularidade(17).
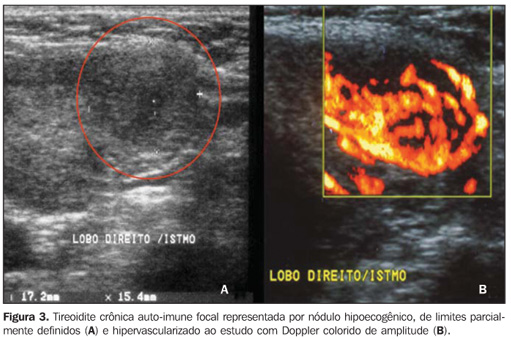
Ecogenicidade no diagnóstico da tireoidite crônica auto-imune: valor preditivo, sensibilidade, especificidade, acurácia e comparação com outros métodos Os valores preditivos da hipoecogenicidade para o diagnóstico das doenças auto-imunes da glândula tireóide (tireoidite crônica auto-imune e doença de Graves) foram estabelecidos com base em amostra de pacientes com hipoecogenicidade da tireóide. A punção aspirativa por agulha fina foi compatível com tireoidite crônica auto-imune em 352 pacientes e com doença de Graves em 47 pacientes. Os valores preditivos positivos e negativos de hipoecogenicidade como indicadores de doenças auto-imunes da glândula tireóide foram, respectivamente, 88,3% e 93%, demonstrando que a redução da ecogenicidade indica alta probabilidade de diagnóstico dessas doenças. Os valores preditivos positivos e negativos, isoladamente, para tireoidite crônica auto-imune foram, respectivamente, 59% e 93%, deixando claro que a ausência de hipoecogenicidade representa baixa probabilidade de diagnóstico dessa enfermidade(9). A avaliação de pacientes com diagnóstico de tireoidite crônica auto-imune por meio de punção aspirativa por agulha fina mostrou que 29,3% dos pacientes não apresentavam manifestações clínicas, 13% não tinham anticorpos antitireóide presentes e o hormônio estimulante da tireóide (TSH) estava normal em 41%. Enquanto a citologia foi isoladamente efetiva para o diagnóstico em 91,3% dos pacientes, a US mostrou sensibilidade de 94,6% para o diagnóstico da tireoidite crônica auto-imune (presença de hipoecogenicidade)(18). Quando o padrão isoecogênico é encontrado em uma população não-selecionada para doenças de tireóide, a especificidade deste parâmetro, isoladamente, para excluir tireoidite crônica auto-imune excede 95%(19). Em uma amostra selecionada em um ambulatório de doenças da tireóide, a ausência de hipoecogenicidade foi eficaz para afastar o diagnóstico de tireoidite crônica auto-imune em 84% dos pacientes(8). Dessa forma, a US apresenta alta especificidade para excluir esta doença. Já a presença de um padrão hipoecogênico não pode, isoladamente, diferenciar entre tireoidite crônica auto-imune e doença de Graves, principalmente em uma amostra selecionada de pacientes com doenças de tireóide, já que vários pacientes podem apresentar doença de Graves. Assim, a presença de hipoecogenicidade não é específica para o diagnóstico de tireoidite crônica auto-imune. Nesse caso, porém, a combinação dos achados clínico-laboratoriais com o estudo ultra-sonográfico permitirá a diferenciação, uma vez que esta combinação apresenta alta especificidade para o diagnóstico da tireoidite crônica auto-imune, mesmo em uma população selecionada(19). Além disso, o uso do dúplex-Doppler colorido pode, também, auxiliar na diferenciação entre tireoidite crônica auto-imune e doença de Graves(17). Aproximadamente 10% dos indivíduos de uma população geral apresentam algum grau de hipotireoidismo, cuja principal causa é a tireoidite crônica auto-imune(20). A presença de hipotireoidismo não-diagnosticado pode representar um grave problema, tanto em crianças, devido ao risco de retardo de crescimento(21), como em gestantes, pelo risco de abortamentos, complicações perinatais e retardo do desenvolvimento neurológico do feto(22). Por isso, o interesse em avaliar quais os métodos mais acurados para o diagnóstico. Com o objetivo de comparar a acurácia diagnóstica da hipoecogenicidade ultra-sonográfica com as concentrações elevadas de TPOAb no diagnóstico da tireoidite crônica auto-imune, Raber et al. avaliaram 451 pacientes com status tireoidiano desconhecido de ambulatório com alta freqüência de doenças tireoidianas. A ecogenicidade do parênquima foi classificada em três graus: grau 1 – normal, ecogenicidade similar à glândula submandibular e hiperecóico em relação à musculatura pré-tireoidiana; grau 2 – parênquima hipoecóico em relação à glândula submandibular e hiperecóico em relação à musculatura pré-tireoidiana; grau 3 – iso ou hipoecóico em relação à musculatura pré-tireoidiana. Quando foi observado o grau 3, o valor preditivo positivo da doença foi de 95% e a sensibilidade foi de 56%. Já a sensibilidade, incluindo os graus 2 e 3 para o diagnóstico da doença, foi de 84%, enquanto a sensibilidade do TPOAb foi de 58%. A especificidade do grau 1 (normal) para excluir tireoidite crônica auto-imune foi de 96%. Esses autores observaram que 95% dos pacientes com o grau 3 na US apresentavam concentrações elevadas de TPOAb(23). Corroborando esses resultados, outra pesquisa, na qual a tireóide foi classificada de acordo com quatro tipos de padrões ultra-sonográficos distintos, revelou que os pacientes que exibiram o padrão mais alto (grau 4 – glândula tireóide com volume aumentado e com difusa e marcada hipoecogenicidade do parênquima) apresentaram as maiores concentrações de anticorpos antitireóide, os menores níveis de T4 e os mais altos níveis de TSH(24). Nos pacientes com diagnóstico de tireoidite crônica auto-imune confirmado pelo estudo citopatológico, evidenciou-se que a presença de hipoecogenicidade do parênquima tireoidiano está associada a maior probabilidade de hipotireoidismo do que à presença de isoecogenicidade do parênquima(25). A hipoecogenicidade ultra-sonográfica é, também, mais eficaz do que os anticorpos antitireóide para predizer o desenvolvimento de hipotireoidismo durante o seguimento dos pacientes(26). É importante salientar que, em 90% dos casos, a hipoecogenicidade é decorrente de doenças auto-imunes, especialmente as tireoidites ou a doença de Graves. Todavia, uma forma de apresentação característica de hipoecogenicidade acentuada associada à presença de traves hiperecogênicas (fibróticas) atravessando o parênquima não deixa dúvida quanto ao diagnóstico de tireoidite crônica auto-imune(27). A forma atrófica da tireoidite crônica auto-imune também pode mostrar padrão ultra-sonográfico de hipoecogenicidade difusa ao exame de ultra-som. Esta condição apresenta uma típica redução de volume e da ecogenicidade glandular em 94,5% dos pacientes(28). Na tireoidite pós-parto, a hipoecogenicidade revelou-se máxima no período pós-parto, com normalização gradual durante o período de seguimento. Hipoecogenicidade persistente indicou processo contínuo de tireoidite destrutiva(29). A tireoidite focal pode representar uma forma mais branda ou precoce de tireoidite crônica auto-imune e apresenta-se, à US, habitualmente com aspecto nodular focal hipoecóico (Figura 3)(7). Entretanto, também pode se apresentar com aspecto nodular hiperecóico, isoecóico e, mesmo, com ecogenicidade mista. Calcificações e degenerações císticas podem estar presentes no nódulo. Neste caso, a biópsia aspirativa por agulha fina é necessária para comprovar a doença e descartar neoplasia(10).
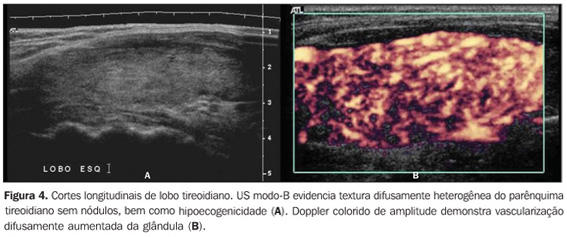
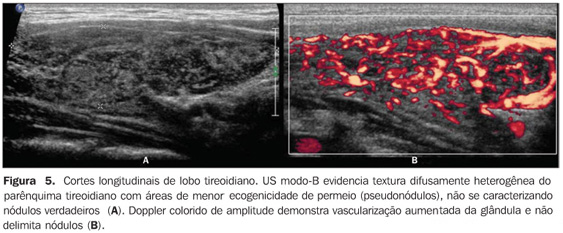
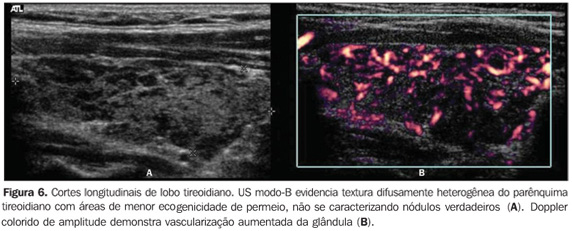
Vários estudos reportaram um padrão caracterizado por redução difusa da ecogenicidade em pacientes com tireoidite crônica auto-imune. Este parâmetro é importante tanto no diagnóstico da doença(8,9,15, 16,18,19,24,25,30) como para predizer disfunção tireoidiana ao longo do acompanhamento dos pacientes(25,26). Convém, dessa forma, salientar que o aspecto ultra-sonográfico clássico da tireóide em pacientes com tireoidite crônica auto-imune exibe, além da textura heterogênea(25,30) ou de padrão finamente micronodular(31), a presença da hipoecogenicidade (Figuras 2, 4, 5 e 6).
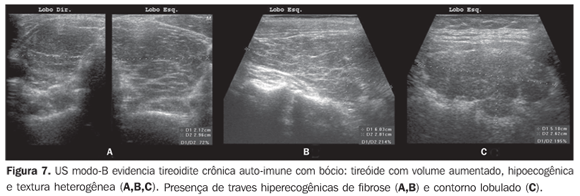
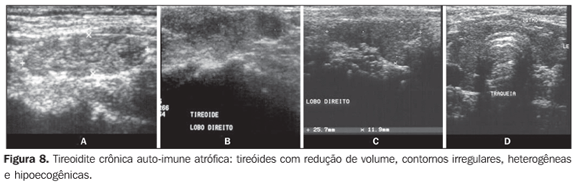
O volume tireoidiano mostra-se aumentado na maioria dos pacientes (Figura 7) e reduzido nos pacientes com tireoidite atrófica (Figura 8), mas pode apresentar-se normal em parte dos pacientes. A presença de linfonodos de aspecto habitual na cadeia cervical VI corrobora ainda mais o diagnóstico de tireoidite crônica auto-imune(32).
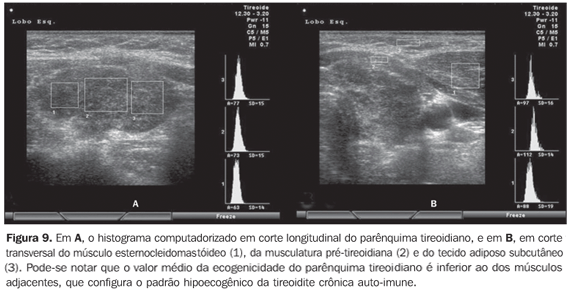
Diagnóstico ultra-sonográfico por meio do histograma computadorizado Nos estudos já citados, a avaliação e a classificação da ecogenicidade da tireóide foram realizadas por examinadores experientes, comparando-a à ecogenicidade da musculatura pré-tireoidiana ou das glândulas submandibulares; entretanto, a interpretação e a quantificação são realizadas de maneira subjetiva. Apesar de a padronização dos procedimentos de utilização do equipamento de ultra-som e da classificação ter sido proposta por alguns autores, o método ainda é dependente do operador. Na busca de uma avaliação mais objetiva e quantitativa, foram desenvolvidos programas de computador que atribuem escalas numéricas aos vários tons de cinza do histograma da glândula tireóide (Graw-Wert-Einheiten – GWE). Quanto maior a resolução das imagens, maior o número de tonalidades de cinza identificado. A cor preta corresponde ao valor 0 e a cor branca corresponde ao maior valor, que depende da resolução da imagem. Tal técnica permite eliminar a subjetividade do método ao quantificar numericamente a ecogenicidade, tornando-a uma variável objetiva, quantitativa, altamente sensível e reprodutível e, portanto, capaz de proporcionar análises estatísticas mais precisas. Este método foi empregado por vários autores, tanto na avaliação de doenças da tireóide quanto de outras estruturas. O histograma computadorizado foi utilizado na avaliação do corte transversal dos lobos tireoidianos (ganho de brilho constante) e mostrou redução significativa da ecogenicidade nos pacientes com tireoidite crônica auto-imune (GWE = 19,6) em comparação à do grupo controle (GWE = 25,6). Além disso, o alto grau de hipoecogenicidade foi correlacionado à ocorrência de altos níveis de TSH (incluindo hipotireoidismo subclínico) e TPOAb, contudo, sem correlação com os níveis de TgAb(33). Na experiência dos autores desta revisão, o histograma computadorizado pode, também, ser realizado utilizando-se o corte longitudinal do parênquima tireoidiano na comparação com a musculatura adjacente (Figura 9).
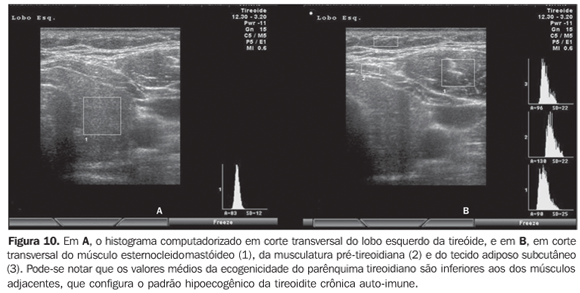
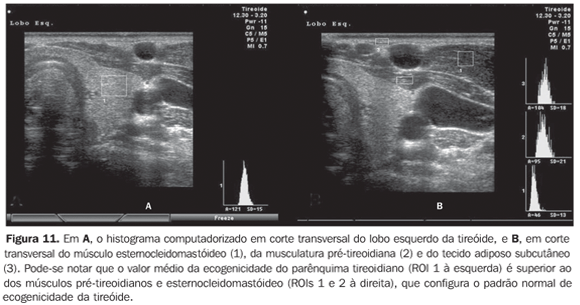
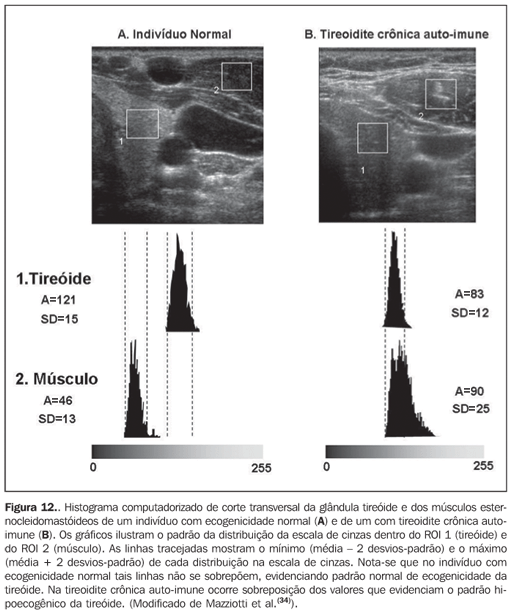
Considerando que a ecogenicidade da tireóide ao histograma computadorizado varia de acordo com o equipamento utilizado e, também, com o ajuste do ganho de brilho, foi proposto utilizar a comparação entre os valores obtidos no histograma da tireóide e dos músculos pré-tireoidianos em cortes transversais, com o objetivo de eliminar tais problemas. Este método torna o exame reprodutível mesmo com a utilização de diferentes aparelhos e, inclusive, permite que o examinador ajuste o ganho de brilho para melhor visualização do parênquima, desde que se utilize o mesmo ganho para a avaliação da musculatura. A tireóide foi considerada hipoecogênica quando os valores médios ± dois desvios-padrão do parênquima apresentaram sobreposição com aqueles da musculatura pré-tireoidiana. Todos os pacientes com tireoidite crônica auto-imune (100%) apresentaram valores de GWE do parênquima tireoidiano sobrepostos aos dos músculos pré-tireoidianos e todos os pacientes com hipotireoidismo apresentaram hipoecogenicidade envolvendo mais do que 68% da glândula(34). Além disso, em pacientes com tireoidite crônica auto-imune, o histograma revelou que pacientes com hipotireoidismo apresentaram significativa redução da ecogenicidade, quando comparados aos pacientes com eutireoidismo(35). Tais resultados obtidos com o histograma computadorizado corroboram a utilidade da hipoecogenicidade do parênquima tireoidiano no diagnóstico de tireoidite crônica auto-imune e também para predizer o hipotireoidismo. Os estudos acima avaliaram a ecogenicidade, selecionando regiões de interesse (ROI) em cortes transversais dos lobos direito e esquerdo. Inicialmente, era necessário armazenar as imagens em arquivos tipo JPEG e transportá-las ao microcomputador para efetuar a análise, o que limitava a utilização do método em decorrência do trabalho e do tempo necessários. Atualmente, alguns aparelhos de ultra-som disponibilizam o programa, realizando a análise em tempo real, o que adiciona praticidade ao procedimento (Figuras 10, 11 e 12).
O rápido desenvolvimento de novos programas para a avaliação da ecogenicidade resultou em novos aprimoramentos. Um deles permite a avaliação da ecogenicidade em uma ROI de três dimensões(36); o outro possibilita delinear os contornos de uma estrutura durante o exame, estimando o volume e a média volumétrica da ecogenicidade de todo o tecido e não apenas de um corte transversal ou longitudinal da área selecionada(37). Esta evolução permitirá que a região selecionada pelo examinador seja representativa da média real da ecogenicidade de toda a estrutura, proporcionando coeficientes de concordância elevadíssimos, tanto intra-observadores como interobservadores, tornando esse parâmetro ainda mais sensível e reprodutível.
CONCLUSÃO Demonstrado o valor do estudo da ecogenicidade no diagnóstico da tireoidite crônica auto-imune, recomenda-se a descrição sistemática no relatório ultra-sonográfico da glândula tireóide, além do volume e da textura, também a ecogenicidade do parênquima, ainda que de forma subjetiva.
REFERÊNCIAS 1. Weetman AP. Autoimmune thyroid disease. Autoimmunity. 2004;37:337–40. [ ] 2. Lindsay RS, Toft AD. Hypothyroidism. Lancet. 1997;349:413–7. [ ] 3. Rapoport B, McLachlan SM. Thyroid autoimmunity. J Clin Invest. 2001;108:1253–9. [ ] 4. Slatosky J, Shipton B, Wahba H. Thyroiditis: differential diagnosis and management. Am Fam Physician. 2000;61:1047–52. [ ] 5. Barbesino G, Chiovato L. The genetics of Hashimoto's disease. Endocrinol Metab Clin North Am. 2000;29:357–74. [ ] 6. Dayan CM, Daniels GH. Chronic autoimmune thyroiditis. N Engl J Med. 1996;335:99–107. [ ] 7. Solbiati L, Livraghi T, Ballarati E, et al. Thyroid gland. In: Solbiati L, Rizzatto G, editors. Ultrasound of superficial structures: high frequencies, Doppler and interventional procedures. New York: Churchill Livingstone; 1995. p. 73–6. [ ] 8. Nordmeyer JP, Shafeh TA, Heckmann C. Thyroid ultrasonography in autoimmune thyroiditis. A prospective study on 123 patients. Acta Endocrinol (Copenh). 1990;122:391–5. [ ] 9. Pedersen OM, Aardal NP, Larssen TB, et al. The value of ultrasonography in predicting autoimmune thyroid disease. Thyroid. 2000;10:251–9. [ ] 10. Langer JE, Khan A, Nisenbaum HL, et al. Sonographic appearance of focal thyroiditis. AJR Am J Roentgenol. 2001;176:751–4. [ ] 11. LiVolsi VA. The pathology of thyroid autoimmune disease: a review. Thyroid. 1994;4:333–9. [ ] 12. Buchanan WW, Harden RM. Primary hypothyroidism and Hashimoto's thyroiditis. A continuous spectrum. Arch Intern Med. 1965;115:411–7. [ ] 13. Hegedüs L. Thyroid ultrasound. Endocrinol Metab Clin North Am. 2001;30:339–60. [ ] 14. Prummel MF, Wiersinga WM. Thyroid peroxidase autoantibodies in euthyroid subjects. Best Pract Res Clin Endocrinol Metab. 2005;19:1–15. [ ] 15. Yoshida A, Adachi T, Noguchi T, et al. Echographic findings and histological feature of the thyroid: a reverse relationship between the level of echo-amplitude and lymphocytic infiltration. Endocrinol Jpn. 1985;32:681–90. [ ] 16. Müller HW, Schröder S, Schneider C, et al. Sonographic tissue characterization in thyroid gland diagnosis. A correlation between sonography and histology. Klin Wochenschr. 1985;63:706–10. [ ] 17. Vitti P, Rago T, Mazzeo S, et al. Thyroid blood flow evaluation by color-flow Doppler sonography distinguishes Graves' disease from Hashimoto's thyroiditis. J Endocrinol Invest. 1995;18:857–62. [ ] 18. Gutekunst R, Hafermann W, Mansky T, et al. Ultrasonography related to clinical and laboratory findings in lymphocytic thyroiditis. Acta Endocrinol (Copenh). 1989;121:129–35. [ ] 19. Gutekunst R, Smolarek H, Hasenpusch U, et al. Goitre epidemiology: thyroid volume, iodine excretion, thyroglobulin and thyrotropin in Germany and Sweden. Acta Endocrinol (Copenh). 1986;112:494–501. [ ] 20. Canaris GJ, Manowitz NR, Mayor G, et al. The Colorado thyroid disease prevalence study. Arch Intern Med. 2000;160:526–34. [ ] 21. Setian NS. Hypothyroidism in children: diagnosis and treatment. J Pediatr (Rio J). 2007;83(5 Suppl):209–16. [ ] 22. Poppe K, Glinoer D. Thyroid autoimmunity and hypothyroidism before and during pregnancy. Hum Reprod Update. 2003;9:149–61. [ ] 23. Raber W, Gessl A, Nowotny P, et al. Thyroid ultrasound versus antithyroid peroxidase antibody determination: a cohort study of four hundred fifty-one subjects. Thyroid. 2002;12:725–31. [ ] 24. Sostre S, Reyes MM. Sonographic diagnosis and grading of Hashimoto's thyroiditis. J Endocrinol Invest. 1991;14:115–21. [ ] 25. Hayashi N, Tamaki N, Konishi J, et al. Sonography of Hashimoto's thyroiditis. J Clin Ultrasound. 1986;14:123–6. [ ] 26. Rago T, Chiovato L, Grasso L, et al. Thyroid ultrasonography as a tool for detecting thyroid autoimmune diseases and predicting thyroid disfunction in apparently healthy subjects. J Endocrinol Invest. 2001;24:763–9. [ ] 27. Chammas MC. Ultra-sonografia nas tireoidites. Radiol Bras. 2007;40(2):v–vi. [ ] 28. Vitti P, Lampis M, Piga M, et al. Diagnostic usefulness of thyroid ultrasonography in atrophic thyroiditis. J Clin Ultrasound. 1994;22:375–9. [ ] 29. Premawardhana LD, Parkes AB, Ammari F, et al. Postpartum thyroiditis and long-term thyroid status: prognostic influence of thyroid peroxidase antibodies and ultrasound echogenicity. J Clin Endocrinol Metab. 2000;85:71–5. [ ] 30. Aydin O, Apaydin FD, Bosdogan R, et al. Cytological correlation in patients who have a pre-diagnosis of thyroiditis ultrasonographically. Endocr Res. 2003;29:97–106. [ ] 31. Set PA, Oleszczuk-Raschke K, von Lengerke JH, et al. Sonographic features of Hashimoto thyroiditis in childhood. Clin Radiol. 1996;51:167–9. [ ] 32. Yamashiro I, Saito OC, Chammas MC, et al. Achados ultra-sonográficos na tireoidite. Radiol Bras. 2007;40:75–9. [ ] 33. Schiemann U, Avenhaus W, Konturek JW, et al. Relationship of clinical features and laboratory parameters to thyroid echogenicity measured by standardized grey scale ultrasonography in patients with Hashimoto's thyroiditis. Med Sci Monit. 2003;9:13–7. [ ] 34. Mazziotti G, Sorvillo F, Iorio S, et al. Grey-scale analysis allows a quantitative evaluation of thyroid echogenicity in the patients with Hashimoto's thyroiditis. Clin Endocrinol. 2003;59:223–9. [ ] 35. Loy M, Cianchetti ME, Cardia F, et al. Correlation of computerized gray-scale sonographic findings with thyroid function and thyroid autoimmune activity in patients with Hashimoto's thyroiditis. J Clin Ultrasound. 2004;32:136–40. [ ] 36. Slapa RZ, Slowinska-Srzednicka J, Szopinski KT, et al. Grey-scale three-dimensional sonography of thyroid nodules: feasibility of the method and preliminary studies. Eur Radiol. 2006;16:428–36. [ ] 37. Mercé LT, Gómez B, Engels V, et al. Intraobserver and interobserver reproducibility of ovarian volume, antral follicle count, and vascularity indices obtained with transvaginal 3-dimensional ultrasonography, power Doppler angiography, and the virtual organ computer-aided analysis imaging program. J Ultrasound Med. 2005;24:1279–87. [ ]
Recebido para publicação em 14/4/2008. Aceito, após revisão, em 5/6/2008.
* Trabalho realizado no Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554