Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 41 nº 5 - Set. / Out. of 2008
Vol. 41 nº 5 - Set. / Out. of 2008
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Heitor Naoki Sado, Ruth Maria Graf, Jorge Rufino Ribas Timi, Cícero Andrade Urban, Airton Seiji Yamada, Luiz Carlos Woellner, Eduardo de Castro Ferreira, Jorge Eduardo Fouto Matias |
|
|
Descritores: Biópsia de linfonodo sentinela, Mamoplastia, Cintilografia, Implantes de mama, Neoplasias mamárias |
|
|
Resumo: VMédico Nuclear do Cermen, Curitiba, PR, Brasil
INTRODUÇÃO O câncer de mama representa a neoplasia de maior importância entre as mulheres. Estimativas norte-americanas demonstram que, para cada oito mulheres, uma apresentará a doença no decorrer da vida(1). Devido à crescente tendência de tratamento conservador do câncer de mama, a biópsia do linfonodo sentinela (LS) tornou-se técnica padrão no estadiamento da doença precoce, com ótimos resultados de sensibilidade (84% a 98%) e baixa taxa de falso-negativos (2,0% a 8,8%), permitindo a diminuição de esvaziamentos axilares desnecessários, com baixos índices de recorrência axilar e melhora significativa na qualidade de vida das pacientes(2-5). O LS baseia-se na existência de uma ordem de progressão linfática nos tumores sólidos, em que os primeiros linfonodos (sentinelas) de drenagem apresentariam a capacidade de predizer o status do restante da cadeia linfática(6). Paralelamente, estudos norte-americanos calculam que existam mais de dois milhões de mulheres submetidas a cirurgia de aumento mamário, estimando-se, para esta projeção, que cerca de 25 mil mulheres com mamoplastia de aumento desenvolverão câncer de mama no futuro(1). Em razão do esperado aumento do diagnóstico de câncer de mama precoce em mulheres submetidas a mamoplastia de aumento, dúvidas e controvérsias a respeito do tratamento conservador nesse subgrupo de pacientes necessitam ser esclarecidas, principalmente em relação à validade da biópsia do LS(7,8). Apesar de a biópsia do LS não ser recomendada em pacientes com cirurgia mamária prévia, em especial a mamoplastia por via transaxilar (1,9), publicações recentes demonstraram a aplicabilidade da técnica em pacientes com implantes mamários(8,10), entretanto, a maioria desses estudos foram retrospectivos, não-controlados e com amostra restrita(1,8,10). Portanto, o grau de comprometimento da drenagem linfática mamária, assim como a garantia da aplicabilidade futura da biópsia do LS em pacientes com mamoplastia de aumento pela via transaxilar, ainda não estão totalmente esclarecidos, havendo necessidade de se realizar estudos complementares(9).
MATERIAIS E MÉTODOS A proposta deste estudo prospectivo controlado foi avaliar a drenagem linfática mamária, por meio da linfocintilografia, em um grupo de pacientes submetidas a mamoplastia de aumento pela via transaxilar (grupo pós-mamoplastia - GPM) e em um grupo de pacientes sem cirurgia mamária prévia (grupo controle - GC). Não houve conflito de interesses. Todas as pacientes tiveram acesso ao termo de consentimento livre e esclarecido. O estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos da Instituição onde o trabalho foi realizado (protocolo 29EXT020/2004-10). Amostra selecionada No período de novembro de 2004 a julho de 2006, foram selecionadas 22 pacientes do sexo feminino, igualmente divididas em GPM e GC, segundo os critérios de inclusão e exclusão listados no Quadro 1. As estatísticas referentes às características de cada grupo estão mostradas na Tabela 1. No GPM, os implantes mamários correspondiam a próteses texturizadas de gel de silicone, com volume médio de 230,68 cm3 (180 a 300 cm3), sendo a linfocintilografia mamária realizada em média 16,55 meses após a cirurgia (6 a 41 meses). Houve predominância da etnia branca em ambos os grupos (GPM: 81,8%; GC: 90,9%).
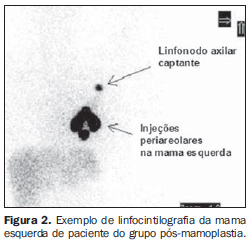
Mamoplastia de aumento por via transaxilar As pacientes do GPM foram submetidas a mamoplastia de aumento pela técnica transaxilar endoscópica, sendo operadas pela mesma equipe, com inserção subfascial do implante segundo técnica descrita por Graf et al.(11) (Figura 1). Linfocintilografia mamária Foram realizados 43 exames de linfocintilografia mamária por especialista em medicina nuclear. Exceto por uma paciente que fez o exame apenas na mama esquerda para biópsia do LS por câncer de mama precoce (T1b), todas as demais pacientes do GC se tratavam de mulheres saudáveis no pré-operatório de mamoplastia, sendo suas mamas bilateralmente avaliadas. Assim, as unidades observadas foram as mamas: 22 no GPM e 21 no GC. Para efeito de análise comparativa, as mamas foram consideradas independentes. O radiocolóide utilizado nos exames de linfocintilografia foi o fitato-99mTc (IPEN; São Paulo, Brasil), com tamanho estimado das partículas entre 5 e 500 nm(12). A via de injeção foi intradérmica periareolar (distante 5 mm da aréola), dividida em quatro aplicações na transição entre os quadrantes da mama, com volume de 0,15 a 0,2 ml e atividade de 14,8 a 29,6 MBq por injeção, seguida de massagem local por cerca de dois minutos para estimular a drenagem do radiofármaco(6). As imagens foram adquiridas imediatamente após a massagem, utilizando-se câmara de cintilação Millennium MPR (General Electric; Fairfield, USA) com detector retangular, colimador de alta resolução, matriz de 256, janela de 20% em 140 keV e imagens estáticas de 60 a 120 segundos nas incidências anterior, lateral e oblíqua do tórax após a identificação do linfonodo captante no monitor de persistência. A cadeia de drenagem linfática primária, assim como o tempo para visualização e número de linfonodos captantes, foram computados em arquivo digital. Exemplos de imagens de linfocintilografia de mama do GPM e GC estão ilustrados nas Figuras 2 e 3, respectivamente.
Análise estatística Para a comparação de grupos em relação às variáveis categóricas dicotômicas empregou-se o teste exato de Fisher. Em relação às variáveis quantitativas, utilizou-se o teste t de Student para amostras independentes ou o teste não-paramétrico de Mann-Whitney, quando apropriado. A condição de normalidade dos dados foi verificada pelo teste de Kolmogorov-Smirnov. Valores de p < 0,05 indicaram significância estatística.
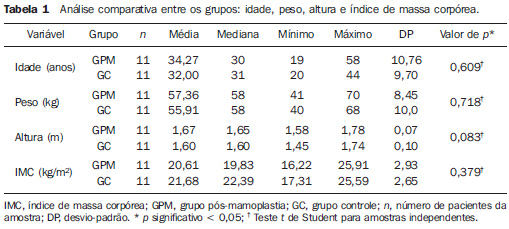
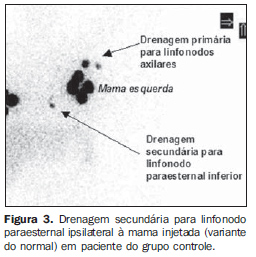
RESULTADOS Em relação às características da amostra, os resultados dos testes não demonstraram diferenças significativas entre os grupos (Tabela 1). Padrão de drenagem linfática do GPM A linfocintilografia demonstrou drenagem mamária em direção à cadeia axilar ipsilateral e identificação de pelo menos um linfonodo captante em 100% das mamas do GPM (Figura 2). O número médio de linfonodos captantes foi de 1,27, com o primeiro linfonodo sendo visualizado, em média, após 3,14 minutos da injeção (Tabela 2). Análise comparativa do padrão de drenagem linfática As linfocintilografias não demonstraram diferenças entre o GPM e o GC em relação à cadeia inicial de drenagem, ocorrendo para a axila ipsilateral à mama estudada em 100% da amostra, sendo confirmado pelo teste exato de Fisher (p = 0,488). Em uma mama de paciente saudável do GC (4,76%), após drenagem primária para linfonodo em cadeia axilar ipsilateral, houve drenagem secundária para linfonodo paraesternal inferior ipsilateral à mama injetada, sendo considerado como variante do normal (Figura 3). Em relação ao número e tempo de aparecimento dos linfonodos captantes, a análise estatística não demonstrou diferenças significativas entre os grupos estudados (Tabela 2).
DISCUSSÃO A biópsia do LS está revolucionando o manejo de pacientes com câncer de mama precoce, reduzindo o número de esvaziamentos axilares, com melhora na qualidade de vida das pacientes(5), e estimulando o atual interesse pela classe médica, exemplificado pela iniciativa no desenvolvimento de programas de educação a distância sobre LS no câncer de mama(13). Apesar deste interesse e de atualmente corresponder a procedimento padrão de estadiamento axilar em diversos centros, ainda existem inúmeros pontos de controvérsia, alguns relacionados a aspectos da técnica e outros relacionados a fatores da paciente. Fatores inerentes à paciente com potencial de prejudicar a detecção do LS pelo uso de radiocolóides estão descritos na literatura, com publicações demonstrando índices de identificação do LS inversamente proporcionais a idade e índice de massa corpórea(6,14-16). A amostra atual não apresentou diferença significativa de idade e índice de massa corpórea entre o GPM e o GC (Tabela 1). Em ambos os grupos a média de idade não ultrapassou 35 anos e o índice de massa corpórea médio não ultrapassou 22 kg/m2; inferior à idade e índice de massa corpórea limítrofes de 50 anos e 23 kg/m2 descritos por McMasters et al.(14) e Takei et al.(16), respectivamente. Tal constatação reforça a ausência de interferência dessas variáveis no padrão de drenagem mamária analisada, isolando, portanto, a mamoplastia de aumento transaxilar como principal variável que poderia ser responsável por diferenças no padrão de drenagem linfática entre os grupos. Atualmente, sabe-se que a principal causa de falso-negativo ou falha na identificação cintilográfica e cirúrgica do LS seria o comprometimento metastático do próprio LS, justificando sua contra-indicação em casos de axila clinicamente positiva ou tumores avançados(17,18). O mecanismo de obstrução mecânica das vias linfáticas pelas células neoplásicas serve como argumento para contra-indicar a biópsia do LS em pacientes com manipulação mamária ou axilar prévia, dentre as quais a mamoplastia de aumento transaxilar, na qual existe o risco de secção de linfáticos ou linfonodos no momento da dissecção cirúrgica e inserção do implante, além do risco de prejuízo da drenagem por fibrose cicatricial no plano axilar e no leito mamário. Em 2005, diretriz da American Society of Clinical Oncology(9) citou que a biópsia do LS não seria recomendada em pacientes com mamoplastia ou cirurgia axilar prévia, entretanto, afirmando que ainda não existem dados suficientes sobre o assunto, sendo sugerido, quando da decisão de aplicar o conceito do LS nesse subgrupo de pacientes, realizar exame de linfocintilografia no pré-operatório. A linfocintilografia permite o estudo da drenagem linfática e linfonodos funcionalmente ativos. Segundo Mariani et al.(19), a principal rota de drenagem linfática da mama corresponde à cadeia axilar, com menor fração drenando para a cadeia torácica interna e raramente para linfonodos intercostais posteriores. Borgstein et al.(20) suportaram a hipótese de que a mama, em razão da sua origem embriológica no ectoderma, apresenta via comum de drenagem com a pele, a qual converge para o plexo subareolar para, posteriormente, por intermédio de um ou dois troncos linfáticos principais, dirigir-se para linfonodos da cadeia axilar, em geral no nível I (região inferior da margem lateral do músculo peitoral menor). Chagpar et al.(21) testaram a hipótese de que não existe diferença entre a drenagem linfática da pele e do parênquima mamário, em estudo multicêntrico comparando as técnicas de injeção profunda peritumoral e superficiais de enxofre coloidal-99mTc, num total de 3.961 pacientes. Esses autores constataram que a taxa de identificação do LS era significativamente superior no grupo de injeção superficial, com taxa de falso-negativo similar ao grupo de injeção profunda peritumoral. Devido à facilidade e eficiência das técnicas de injeção superficial, estas podem ser indicadas em mamas previamente manipuladas, com elevados índices de sucesso de identificação do LS (94% a 100%) e drenagem preferencial para linfonodos axilares(21,22). Com base nessas considerações anatômicas e funcionais, para o presente estudo foi escolhido realizar linfocintilografia com injeção intradérmica (superficial) periareolar do radiocolóide, pois permitiu a análise global da drenagem linfática mamária. O radiocolóide fitato-99mTc foi escolhido em virtude da sua disponibilidade e do seu baixo custo relativo, além da experiência de outros serviços utilizando-o na biópsia do LS em câncer de mama, com valores de acurácia similares aos descritos na literatura internacional e ausência de efeitos colaterais graves(12,23). A partir do conhecimento do padrão de drenagem mamária após injeção superficial do radiocolóide, e pensando-se no potencial da mamoplastia de aumento transaxilar acarretar obstrução ou desvio linfático, era esperada no GPM uma proporção significativa de alteração do padrão de drenagem axilar, com drenagem para cadeias alternativas (linfonodos torácicos internos, intramamários, subpeitorais, intercostais posteriores, subfrênicos ou axilar contralateral), e com diferenças significativas em relação ao GC e dados da literatura. Todavia, os resultados demonstraram presença de drenagem linfática axilar em todas as mamas do GPM. Em comparação com o GC, não houve diferença da cadeia primária de drenagem (p = 0,488). O padrão de drenagem de 100% em direção à cadeia axilar é compatível com os dados de Tavares et al.(12) e Coelho-Oliveira et al.(23), os quais utilizaram o mesmo radiocolóide e técnica de injeção similar ao presente estudo, porém, em pacientes com câncer de mama selecionadas para biópsia do LS e sem histórico de mamoplastia, com taxas de detecção do LS e acurácia na predição do status axilar compatíveis com o descrito na literatura internacional, o que inicialmente nos leva a pensar na preservação de canais linfáticos responsáveis pela drenagem global da mama no GPM. Quanto ao número de linfonodos (Tabela 2), não se observou diferenças significativas entre os dois grupos (p = 0,895), permitindo concluir que na presente amostra não houve lesão significativa de linfonodos ou vias linfáticas axilares principais. Ainda, o intervalo entre as injeções mamárias e as imagens linfocintilográficas (Tabela 2) também não apresentou diferenças estatísticas (p = 0,745), não existindo, portanto, interferência do tempo disponível para migração linfática em nenhum dos grupos estudados. Em relação aos dados da literatura, o número de linfonodos detectados foi similar ao estudo de Tavares et al.(12). Apesar de a técnica de injeção superficial adotada acarretar drenagem preferencial para a axila, existe pequena possibilidade (1,7%) de drenagem para a cadeia torácica interna(24), observada em uma mama (4,76%) do GC. A drenagem exclusiva para a cadeia axilar e ausência de drenagem para cadeias alternativas, verificada no GPM, poderia ser explicada simplesmente pela técnica de injeção utilizada. Entretanto, o processo de dissecção, inserção e cicatrização dos implantes na região subfascial do músculo peitoral maior poderia resultar na lesão dos canais linfáticos que compõem o plexo fascial profundo, responsável pela drenagem em direção às cadeias torácica interna, subpeitoral e intercostal posterior(19,25). O impacto dessa hipótese de impedimento da drenagem linfática profunda teria a mesma analogia do significado da visualização da cadeia torácica interna na biópsia do LS(9), gerando nova controvérsia a respeito da real necessidade em se detectar linfonodos paraesternais, uma vez que o valor principal do LS consiste no correto estadiamento e diminuição da morbidade cirúrgica da axila(20). O atual estudo comparou padrões de drenagem linfática de 43 mamas divididas em GPM e GC, sendo que os autores não têm conhecimento de publicações com casuística e método semelhantes. Jakub et al.(1), em revisão de casos, verificaram taxa de 100% de identificação do LS em 49 pacientes com câncer de mama submetidas a biópsia do LS. Entretanto, da amostra total, apenas três pacientes foram submetidas a mamoplastia de aumento transaxilar, não sendo possível caracterizar o tipo, o volume e a localização dos implantes na maioria dos casos, não existindo também descrição da técnica linfocintilográfica adotada, assim como a caracterização do padrão de drenagem linfática. Gray et al.(8), realizando revisão de casos, avaliaram 11 mamas com câncer e mamoplastia de aumento no passado submetidas a biópsia do LS, demonstrando taxa de identificação de 100% do LS em cadeia axilar. Entretanto, esses resultados foram baseados apenas em pacientes com mamoplastia de aumento por via inframamária (54,5%) e periareolar (45,5%), com a maioria apresentando implantes infláveis de soro fisiológico (81,8%) de localização subpeitoral (72,7%). Os autores consideraram que a biópsia do LS seria possível em pacientes com mamoplastia de aumento por via inframamária e periareolar, sugerindo que a via transaxilar poderia interferir negativamente na biópsia do LS, devido ao risco de lesão linfática. Os resultados do presente estudo, ao contrário do suposto por Gray et al.(8), demonstraram que não houve prejuízo da drenagem axilar nas mamas submetidas a mamoplastia por acesso transaxilar. Apesar de não podermos comparar diretamente os resultados, por causa das diferentes vias de acesso utilizadas, a preponderância de implantes de soro fisiológico na amostra de Gray et al.(8) poderia contribuir para o menor risco de lesão linfática no trajeto de inserção, uma vez que os implantes são expandidos apenas no leito mamário. Apesar de lógico, o raciocínio inverso parece não ser verdadeiro. Teoricamente, os implantes de gel de silicone teriam maior potencial de lesão linfática durante o processo de inserção e acomodação, sendo o risco de lesão proporcional às dimensões da prótese. Nossos resultados permitem inferir que não houve prejuízo da drenagem no GPM, composto por 100% de próteses de gel de silicone (volume médio: 230,68 ± 38,58 cm3). Entretanto, não foi possível fazer uma correlação confiável entre as dimensões da prótese e os diversos padrões de drenagem linfática, em razão do padrão global de drenagem preservada, da amostra restrita e da pouca variação da relação volume da prótese/índice de massa corpórea, o que nos leva à conclusão de que houve uma proporção entre as dimensões da paciente e da prótese mamária. Munhoz et al.(10), utilizando injeção periareolar de dextran-99mTc, avaliaram 26 pacientes, sete dias antes e dez dias após mamoplastia de aumento transaxilar, demonstrando 100% de drenagem axilar no pré-operatório e falha na identificação de linfonodo captante axilar em 7,6% das pacientes no pós-operatório. Esses autores concluíram que a detecção do LS é possível na maioria das pacientes submetidas a mamoplastia transaxilar, sugerindo a importância de cuidados intra-operatórios para minimizar os riscos de lesão linfática. Apesar do método elaborado ao comparar o padrão de drenagem no pré e pós-operatório na mesma mama, as pacientes não apresentavam câncer de mama e não houve controle tardio para verificar possíveis efeitos do processo de cicatrização, sendo que os próprios autores sugerem a necessidade de estudos de longo prazo e com amostras maiores. Os resultados obtidos no presente estudo, envolvendo mulheres sem câncer de mama, não demonstraram prejuízo da drenagem linfática mamária nas pacientes submetidas a mamoplastia transaxilar quando comparadas a pacientes não-operadas, não representado, portanto, contra-indicação absoluta para biópsia do LS. Estudos com amostras significativas e maior tempo de seguimento, com linfocintilografia pré e pós-mamoplastia associada a controle de variáveis anatômicas e funcionais, poderão esclarecer em médio prazo dúvidas a respeito do impacto da mamoplastia de aumento na anatomia linfática, assim como possíveis influências da técnica cirúrgica empregada. O aumento do número de pacientes com câncer de mama precoce e mamoplastia no passado aumentará as perspectivas de estudos prospectivos, que, associados a linfadenectomia de rotina, fornecerão dados a respeito dos índices de detecção e acurácia do LS nesse subgrupo específico. Os autores não têm conhecimento de estudos randomizados multicêntricos em andamento para avaliar o impacto das mamoplastias de aumento na biópsia do LS em pacientes com câncer de mama(9,26). Em razão da complexidade de tais estudos, até o momento devemos nos basear com cautela nos dados disponíveis para tomarmos decisões sobre o real impacto da técnica transaxilar de mamoplastia de aumento na biópsia do LS.
CONCLUSÃO A mamoplastia de aumento transaxilar não alterou o padrão de drenagem linfática mamária, não havendo prejuízo da detecção futura de LS em cadeia axilar no grupo de pacientes estudados.
REFERÊNCIAS 1. Jakub JW, Ebert MD, Cantor A, et al. Breast cancer in patients with prior augmentation: presentation, stage, and lymphatic mapping. Plast Reconstr Surg. 2004;114:1737-42. [ ] 2. Miltenburg DM, Miller C, Karamlou TB, et al. Meta-analysis of sentinel lymph node biopsy in breast cancer. J Surg Res. 1999;84:138-42. [ ] 3. Veronesi U, Paganelli G, Viale G, et al. A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer. N Engl J Med. 2003;349:546-53. [ ] 4. Naik AM, Fey J, Gemignani M, et al. The risk of axillary relapse after sentinel lymph node biopsy for breast cancer is comparable with that of axillary lymph node dissection: a follow-up study of 4008 procedures. Ann Surg. 2004;240:462-71. [ ] 5. Mansel RE, Fallowfield L, Kissin M, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial. J Natl Cancer Inst. 2006;98:599-609. [ ] 6. Krynyckyi BR, Kim CK, Goyenechea MR, et al. Clinical breast lymphoscintigraphy: optimal techniques for performing studies, image atlas, and analysis of images. Radiographics. 2004;24:121-45. [ ] 7. Karanas YL, Leong DS, Da Lio A, et al. Surgical treatment of breast cancer in previously augmented patients. Plast Reconstr Surg. 2003;111: 1078-83. [ ] 8. Gray RJ, Forstner-Barthell AW, Pockaj BA, et al. Breast-conserving therapy and sentinel lymph node biopsy are feasible in cancer patients with previous implant breast augmentation. Am J Surg. 2004;188:122-5. [ ] 9. Lyman GH, Giuliano AE, Somerfield MR, et al. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer. J Clin Oncol. 2005; 23:7703-20. [ ] 10. Munhoz AM, Aldrighi C, Ono CR, et al. The influence of subfascial transaxillary breast augmentation in axillary lymphatic drainage patterns and sentinel lymph node detection. Ann Plast Surg. 2007;58:141-9. [ ] 11. Graf RM, Bernardes A, Auersvald A, et al. Subfascial endoscopic transaxillary augmentation mammaplasty. Aesthetic Plast Surg. 2000;24: 216-20. [ ] 12. Tavares MG, Sapienza MT, Galeb NA, et al. The use of 99mTc-phytate for sentinel node mapping in melanoma, breast cancer and vulvar cancer: a study of 100 cases. Eur J Nucl Med. 2001;28: 1597-604. [ ] 13. Kelmer S, Coelho-Oliveira A, Fonseca LMB. Educação a distância mediada pela internet: "Linfonodo sentinela, prevenção, diagnóstico precoce e biópsia - nova técnica de abordagem do câncer de mama". Radiol Bras. 2007;40:251-4. [ ] 14. McMasters KM, Tuttle TM, Carlson DJ, et al. Sentinel lymph node biopsy for breast cancer: a suitable alternative to routine axillary dissection in multi-institutional practice when optimal technique is used. J Clin Oncol. 2000;18:2560-6. [ ] 15. Birdwell RL, Smith KL, Betts BJ, et al. Breast cancer: variables affecting sentinel lymph node visualization at preoperative lymphoscintigraphy. Radiology. 2001;220:47-53. [ ] 16. Takei H, Suemasu K, Kurosumi M, et al. Added value of the presence of blue nodes or hot nodes in sentinel lymph node biopsy of breast cancer. Breast Cancer. 2006;13:179-85. [ ] 17. Van Lancker M, Goor C, Sacre R, et al. Patterns of axillary lymph node metastasis in breast cancer. Am J Clin Oncol. 1995;18:267-72. [ ] 18. Brenot-Rossi I, Houvenaeghel G, Jacquemier J, et al. Nonvisualization of axillary sentinel node during lymphoscintigraphy: is there a pathologic significance in breast cancer? J Nucl Med. 2003; 44:1232-7. [ ] 19. Mariani G, Moresco L, Viale G, et al. Radioguided sentinel lymph node biopsy in breast cancer surgery. J Nucl Med. 2001;42:1198-215. [ ] 20. Borgstein PJ, Meijer S, Pijpers RJ, et al. Functional lymphatic anatomy for sentinel node biopsy in breast cancer: echoes from the past and the periareolar blue method. Ann Surg. 2000;232: 81-9. [ ] 21. Chagpar A, Martin RC 3rd, Chao C, et al. Validation of subareolar and periareolar injection techniques for breast sentinel lymph node biopsy. Arch Surg. 2004;139:614-20. [ ] 22. Maza S, Thomas A, Winzer KJ, et al. Subareolar injection of technetium-99m nanocolloid yields reliable data on the axillary lymph node tumour status in breast cancer patients with previous manipulations on the primary tumour: a prospective study of 117 patients. Eur J Nucl Med Mol Imaging. 2004;31:671-5. [ ] 23. Coelho-Oliveira A, Rocha ACP, Gutfilen B, et al. Identificação do linfonodo sentinela no câncer de mama com injeção subdérmica periareolar em quatros pontos do radiofármaco. Radiol Bras. 2004;37:233-7. [ ] 24. Pelosi E, Bellò M, Giors M, et al. Sentinel lymph node detection in patients with early-stage breast cancer: comparison of periareolar and subdermal/peritumoral injection techniques. J Nucl Med. 2004;45:220-5. [ ] 25. Tanis PJ, Nieweg OE, Valdés-Olmos RA, et al. Anatomy and physiology of lymphatic drainage of the breast from the perspective of sentinel node biopsy. J Am Coll Surg. 2001;192:399-409. [ ] 26. Mansel RE, Goyal A. European studies on breast lymphatic mapping. Semin Oncol. 2004;31:304-10. [ ]
Recebido para publicação em 18/11/2007. Aceito, após revisão, em 9/1/2008.
* Trabalho realizado no Departamento de Cirurgia da Universidade Federal do Paraná (UFPR) e no Serviço de Medicina Nuclear do Cermen, Curitiba, PR, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554