Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Ahead of Print
Ahead of Print
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): José Raniery Ferreira Juniora; Marcel Koenigkam-Santosb; Camila Vilas Boas Machadoc; Matheus Calil Faleirosd; Natália Santana Chiari Correiae; Federico Enrique Garcia Ciprianof; Alexandre Todorovic Fabrog; Paulo Mazzoncini de Azevedo-Marquesh |
|
|
Descritores: Tomografia computadorizada; Interpretação de imagem radiográfica assistida por computador; Neoplasia pulmonar; Prognóstico. |
|
|
Resumo: INTRODUÇÃO
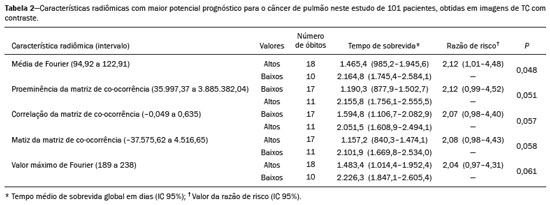
O câncer de pulmão é o que mais causa vítimas relacionadas a neoplasias no mundo, sendo responsável por uma em cada cinco mortes(1). O prognóstico do câncer de pulmão é um grande desafio, pois varia acentuadamente de acordo com o estádio do tumor no diagnóstico(2). A escolha do tratamento frente a um tumor maligno é tomada principalmente pelo sistema internacional de estadiamento de neoplasias, conhecido como TNM (tumor–linfonodo–metástase)(3). Todavia, alguns estudos mostram que outros fatores clínicos podem influenciar o prognóstico, a tomada de decisão clínica e o impacto no tratamento do paciente, como o tipo histológico e a presença de mutações genéticas específicas(4,5). A tomografia computadorizada (TC) é o principal método de imagem médica utilizado no diagnóstico e estadiamento da neoplasia pulmonar(6). Na rotina clínica, a avaliação do câncer pulmonar é feita com base nas medidas do tumor, nos sinais de invasão das estruturas adjacentes, na identificação de linfonodos patológicos e em lesões suspeitas para metástases a distância. Contudo, na literatura médica é possível também encontrar trabalhos mostrando que outras características do tumor nos exames de imagem podem influenciar no prognóstico e na tomada de decisão terapêutica, além do TNM clínico(2,7). Essas características mais comumente descrevem a forma e atenuação da lesão na imagem, em geral de maneira subjetiva, qualitativa ou semiquantitativa (por exemplo, realce heterogêneo, intensidade do realce, contornos espiculados, diâmetro bidimensional no plano axial, etc.)(8,9). A radiômica (do inglês radiomics) é descrita como uma ferramenta quantitativa e reprodutível promissora para a caracterização de imagens médicas(10,11). Basicamente, a radiômica estabelece a extração massiva e análise computadorizada de variáveis quantitativas das imagens, associando com dados clínicos e laboratoriais relacionados não somente ao diagnóstico, mas também com o desfecho clínico, dados histológicos e mutações genéticas, dessa maneira aumentando o poder dos biomarcadores e modelos de suporte à decisão(12–14). A radiômica é ainda capaz de quantificar a complexidade espacial do tumor e identificar a heterogeneidade intratumoral, que é a presença de múltiplas sub-regiões histológicas e genéticas em um mesmo tumor, aspecto que pode estar relacionado a progressão da doença e resistência terapêutica(15,16). Em face dos recentes avanços nas terapias-alvo e imunoterapias, a necessidade de uma abordagem completa e individualizada de avaliação das neoplasias se tornou imperativa, e a radiômica pode prover isto de uma maneira não invasiva, rápida e de baixo custo para a rotina clínica(17,18). O presente trabalho teve por objetivo realizar um estudo de análise do prognóstico de pacientes com lesões pulmonares representando câncer de pulmão, baseado na análise radiômica das imagens de TC obtidas na rotina clínica e sua associação com a sobrevida global dos pacientes. MATERIAIS E MÉTODOS Pacientes Este estudo retrospectivo foi aprovado pelo comitê de ética em pesquisa da instituição, bem como a solicitação de dispensa de aplicação do termo de consentimento livre e esclarecido. O conjunto total inicial de pacientes continha 126 casos consecutivos de lesões pulmonares representando câncer de pulmão, principalmente nódulos, confirmados histologicamente ou cirurgicamente, encaminhados para investigação e diagnóstico após discussão multidisciplinar. Os pacientes foram diagnosticados e tratados nos hospitais da instituição durante os anos de 2010 a 2017. Desses 126 casos, 19 não tinham as imagens obtidas com o protocolo padrão de injeção de meio de contraste iodado intravenoso para TC (influenciando o processo de caracterização das imagens) ou apresentavam imagens com artefatos significativos, 4 apresentaram outras opacidades adjacentes ao tumor (influenciando o processo de segmentação das imagens) e 2 não apresentaram todos os dados clínicos disponíveis. Portanto, 25 casos foram excluídos da análise e 101 foram incluídos, todos estes apresentando imagens de TC com contraste de qualidade diagnóstica adequada e os dados clínicos necessários disponíveis para análise. As informações clínicas, patológicas e laboratoriais foram obtidas dos arquivos do prontuário eletrônico do paciente (Tabela 1). 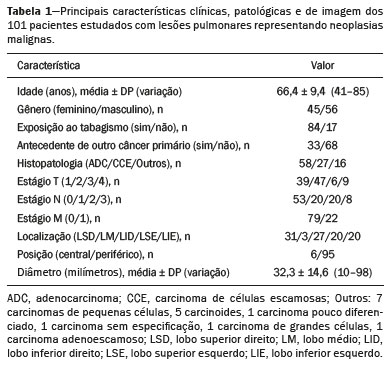 Aquisição das imagens tomográficas As imagens de TC foram obtidas em aparelhos de multidetectores Brilliance Big Bore de 16 detectores (Philips Healthcare, Eindhoven, Holanda) ou Aquilion Prime de 128 detectores (Toshiba Medical Systems, Tóquio, Japão) antes de qualquer intervenção diagnóstica ou terapêutica, utilizando protocolos semelhantes de aquisição e reconstrução das imagens, segundo protocolo da rotina clínica da instituição. Os exames do tórax são realizados com o paciente realizando inspiração profunda, em aquisição única volumétrica no sentido caudocranial, com controle automático de exposição à radiação ionizante, após administração intravenosa de meio de contraste iodado, utilizando volume de 80–100 mL (fluxo de 3,0 mL/s) ajustado de acordo com o peso do paciente em injeção de bolus rápida, seguida da injeção de solução salina (30 mL, fluxo de 3,0 mL/s). As imagens são reconstruídas utilizando matriz de 512 × 512 pixels, espessura de corte de 0,5–1,25 mm, com filtro padrão (utilizado para a análise radiômica) e filtro duro (utilizado para visibilização e mensuração manual das lesões em janela pulmonar). Outros parâmetros típicos de aquisição são kVp de 120, mAs de 39–464 e tempo de rotação < 1 s. Segmentação das lesões Para realizar a análise radiômica, foi necessário segmentar as lesões nos exames de TC. A segmentação separa anatomicamente as estruturas ou tecidos mostrados na TC. Neste trabalho, todas as lesões foram segmentadas semiautomaticamente pela ferramenta GrowCut (3D-Slicer, Boston, MA, EUA)(19), método já validado para neoplasias pulmonares em imagens de TC(20,21). Para realizar a segmentação semiautomática, duas regiões foram marcadas (uma interna e uma externa ao tumor – Figuras 1a e 1b), em três cortes do exame (um corte para cada plano anatômico – axial, sagital e coronal) utilizando janela de pulmão com nível de –500 UH e largura de 1400 UH. Em seguida, o algoritmo GrowCut detecta tridimensionalmente o tecido tumoral (Figura 1c). Após isto, a região externa ao tumor é removida (Figura 1d) e sua borda é delimitada (Figura 1e). Finalmente, a marcação do tumor é exportada como um arquivo estruturado tipo DICOM-RT(22) para ser usado no processo de extração de características radiômicas.  Figura 1. Segmentação semiautomática com o método GrowCut de um nódulo pulmonar de adenocarcinoma. a: Imagem de TC em janela de pulmão no plano axial com a lesão. b: Marcações internas e externas ao tumor. c: Resultado do GrowCut; d: Remoção da região externa; e: Delimitação da borda da lesão. Características radiômicas A extração de características radiômicas consiste no cálculo massivo de variáveis numéricas que representem o conteúdo visual de uma imagem (Figura 2). Neste trabalho, os tumores foram caracterizados por 2465 variáveis quantitativas (Ibex, Houston, TX, EUA; JFeatureLib-Lire, Austria; ImageJ, Bethesda, MD, EUA)(23–25). As características radiômicas foram classificadas em quatro grupos principais: primeira ordem, segunda ordem, mais alta ordem e forma(11,26). As características de primeira ordem (nível de cinza e histograma) descrevem individualmente a distribuição dos valores dos pixels do tumor. As características de segunda ordem (matriz de co-ocorrência, matriz de comprimento de sequência e textura de Tamura) descrevem relacionamentos espaciais dos voxels do tumor. As características de mais alta ordem (matriz de diferença de intensidade de vizinhança, filtros laplaciano de gaussianos, filtros de Gabor, transformada de Fourier, wavelet de Haar e estimativa da dimensão fractal) descrevem padrões repetitivos de textura impostos por filtros ou transformadas. E, por fim, as características de forma descrevem a borda do tumor e os seus elementos geométricos. 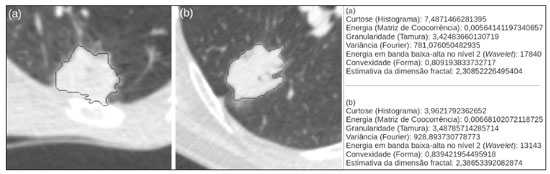 Figura 2. Exemplos de tumores em imagens de TC em janela de pulmão no plano axial e os respectivos valores de algumas características radiômicas. a: Adenocarcinoma pulmonar em um homem de 68 anos, com ocorrência de óbito e tempo de sobrevida global de 55 dias. b: Adenocarcinoma pulmonar em uma mulher de 77 anos, sem ocorrência de óbito e com tempo de sobrevida global de 2801 dias. Análise de sobrevida Para a análise de prognóstico utilizou-se a correlação entre as características radiômicas da TC e a sobrevida global dos pacientes. Esta análise foi baseada no método de Kaplan-Meier, com o cálculo das probabilidades de tempo para o evento de óbito por qualquer natureza. Pacientes vivos ou com perda de acompanhamento foram censurados para os cálculos das probabilidades de sobrevida global. Os grupos de pacientes foram divididos de acordo com a mediana do valor das características radiômicas(14). O teste de log-rank avaliou a diferença estatística entre as curvas Kaplan-Meier dos grupos de pacientes para a identificação das características com maior potencial prognóstico (pacote R survival, Áustria). Testes com valor de p < 0,05 foram considerados estatisticamente significantes. RESULTADOS Vinte e oito pacientes faleceram durante o estudo, 16 deles por câncer de pulmão. Setenta e três pacientes foram censurados. O tempo médio de sobrevida global foi de 1.819,4 dias (intervalo de confiança de 95% [IC 95%]: 1.481,2–2.157,5). Dos 28 pacientes que faleceram, 22 eram homens (79%) com idade média de 68,7 anos (desvio-padrão [DP]: 8,8) e 6 eram mulheres (21%) com idade média de 66,8 anos (DP: 7,7). A distribuição por estadiamento clínico foi de lesão T1 em 10 pacientes (36%), T2 em 14 pacientes (50%), T3 em 2 pacientes (7%) e T4 em 2 pacientes (7%); linfonodos N0 em 11 pacientes (39%), N1 em 4 pacientes (14%), N2 em 10 pacientes (36%) e N3 em 3 pacientes (11%); metástases M0 em 16 pacientes (57%) e M1 em 12 pacientes (43%). Os tipos histológicos foram: adenocarcinomas em 14 casos (50%), carcinomas de células escamosas em 8 casos (28%), carcinomas de pequenas células em 3 casos (10%), câncer de pulmão de células não pequenas (CPCNP) sem especificação em 1 caso (4%), CPCNP neuroendócrino pouco diferenciado em 1 caso (4%) e CPCNP adenoescamoso em 1 caso (4%). Uma característica radiômica apresentou diferença estatisticamente significante na análise das curvas Kaplan-Meier (Tabela 2): a média de Fourier. O grupo de pacientes de maior risco foi identificado pelos valores altos da média de Fourier (maior que a mediana 109,10), com razão de risco de 2,12 (IC 95%: 1,01–4,48), sendo formado por 29 homens (57%) com idade média de 68,1 anos (DP: 9,4) e 22 mulheres (43%) com idade média de 67,1 anos (DP: 7,5) (Figura 3). A distribuição por estadiamento clínico, neste grupo, foi de T1 em 16 pacientes (31%), T2 em 25 pacientes (49%), T3 em 5 pacientes (10%) e T4 em 5 pacientes (10%); N0 em 22 pacientes (43%), N1 em 10 pacientes (20%), N2 em 15 pacientes (29%) e N3 em 4 pacientes (8%); M0 em 38 pacientes (75%) e M1 em 13 pacientes (25%). Os tipos histológicos foram adenocarcinomas em 30 casos (59%), carcinomas de células escamosas em 10 casos (19%), carcinomas de pequenas células em 5 casos (10%), carcinoides em 2 casos (4%), carcinoma de grandes células em 1 caso (2%), CPCNP sem especificação em 1 caso (2%), CPCNP neuroendócrino pouco diferenciado em 1 caso (2%) e CPCNP adenoescamoso em 1 caso (2%). O grupo de pacientes de menor risco foi identificado pelos valores baixos da média de Fourier (menor ou igual a mediana 109,10) e apresentou razão de risco de 0,47 (IC 95%: 0,22–0,99). 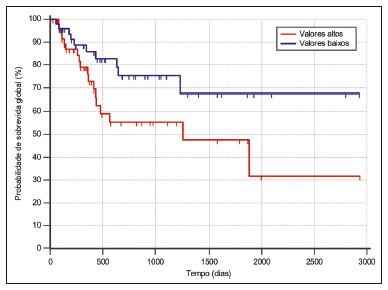 Figura 3. Curvas Kaplan-Meier da característica radiômica média de Fourier. Cada traço nas curvas representa um paciente censurado. A Figura 4 exemplifica a quantificação da heterogeneidade intratumoral em duas lesões dos grupos de risco estratificados pela média de Fourier. É possível observar nas imagens uma maior heterogeneidade intratumoral na lesão de maior risco pela maior quantidade de picos no gráfico de distribuição tridimensional dos níveis de cinza e pela presença de mais regiões infiltrativas no mapa da energia local em comparação com a lesão de menor risco.  Figura 4. Quantificação da heterogeneidade intratumoral de lesões estratificadas pela média de Fourier. a: Tumor segmentado de imagem de TC em janela de pulmão no plano axial. b: Distribuição tridimensional dos níveis de cinza da imagem. c: Mapa refletindo a energia local com aplicação de janela de 5 × 5 pixels do tumor. DISCUSSÃO A radiômica tem se mostrado uma ferramenta promissora no desenvolvimento de biomarcadores quantitativos nas imagens médicas, aumentando a precisão diagnóstica, a avaliação prognóstica e auxiliando a medicina personalizada(11,17). No presente trabalho foi investigada a associação radiômica entre características quantitativas de imagens de TC e a sobrevida global de pacientes com neoplasias malignas pulmonares. Na amostra estudada, uma característica radiômica (média de Fourier), relacionada a heterogeneidade tumoral, mostrou correlação com a sobrevida global. Alguns estudos mostraram que certas características dos tumores primários pulmonares em imagens de TC, além das incluídas no estadiamento clínico pelo sistema TNM, correlacionam com o prognóstico dos pacientes. A presença de cavidades e o volume tumoral total (incluindo componentes não sólidos), por exemplo, são fatores relacionados ao prognóstico para pacientes com CPCNP de células escamosas e adenocarcinoma, respectivamente(2). Já há trabalhos que avaliaram quantitativamente os tumores de CPCNP por meio da radiômica. Van Timmeren et al.(27) apresentaram três características de TC com valor prognóstico no CPCNP: a moda (valor mais frequente) do histograma da imagem após um filtro laplaciano de gaussiano, a média das intensidades de um volume centrado no voxel de maior nível de cinza e a variância inversa da matriz de co-ocorrência calculada após uma transformada wavelet. Carvalho et al.(28) descobriram a característica de ênfase de sequência curta da matriz de comprimento de sequências de níveis de cinza de imagens de tomografia por emissão de pósitrons acoplada a TC, correlacionada com o prognóstico dos pacientes com neoplasia pulmonar. Aerts et al.(14) identificaram uma assinatura radiômica da TC associada com a sobrevida de pacientes com CPCNP composta pela energia de primeira ordem, compacidade da forma, não uniformidade de nível de cinza da matriz de comprimento de sequência e esta mesma característica calculada após uma transformada wavelet. O presente trabalho identificou uma assinatura radiômica em imagens de TC de lesões pulmonares, relacionada à heterogeneidade tumoral, com valor prognóstico no paciente com câncer de pulmão. No conhecimento dos autores, esta assinatura consiste em achado ainda não relatado na literatura (apenas em trabalho preliminar na forma de resumo de conferência científica). A avaliação prognóstica do paciente pela radiômica em imagens de TC de tórax utilizadas na rotina clínica apresenta potencial para aplicação efetiva, após adequada validação científica e definição de modelos, para sua inserção como ferramenta no meio clínico real, por ser objetiva, não invasiva e de baixo custo(29). Conceitualmente, a transformada de Fourier é aplicada para obter características do domínio da frequência das imagens. A média das frequências do espectro da imagem após a transformada rápida de Fourier está associada com variações nos padrões mais finos ou mais rugosos da textura, dessa forma relacionadas à heterogeneidade intratumoral na imagem(29). As lesões com maior risco (mortalidade global) apresentaram maior média de Fourier e textura mais áspera, menos uniforme, enquanto as lesões de menor risco apresentaram menor média de Fourier e textura mais lisa, mais uniforme. Este trabalho apresenta algumas limitações. Primeiro, o conjunto de amostras foi relativamente pequeno. Os autores optaram por estudar apenas exames de TC com protocolo clínico adequado, com imagens pós-contraste de boa qualidade diagnóstica, descartando exames sem contraste ou com artefatos significativos. Apesar da utilização do mesmo protocolo clínico de injeção do meio de contraste neste estudo, não foi realizada correção para eventuais diferenças de volume e velocidade de injeção relacionadas ao biótipo ou status cardíaco do paciente, fatores que podem influenciar o realce das lesões. Além disso, foram incluídos exames de aparelhos de TC com e sem reconstrução iterativa, o que também pode influenciar a resolução das imagens e as características analisadas. Neste estudo ocorreram poucos eventos de óbito para a análise de sobrevida global, com apenas 16 pacientes tendo falecidos diretamente relacionados ao câncer pulmonar, dessa maneira reduzindo o poder estatístico da análise de sobrevida. Este fato provavelmente se deve ao estudo de lesões menores (principalmente T1 e T2) encaminhadas para definição de conduta em reunião multidisciplinar, excluindo-se em geral tumores mais agressivos, sabidamente com pior prognóstico e menor sobrevida. Ainda, a heterogeneidade das condutas relacionada aos diferentes tipos de neoplasia pulmonar e medicações disponíveis também pode influenciar a análise de sobrevida e prognóstico. Deve-se também destacar que estudos como o aqui apresentado servem como prova de conceito, mostrando a aplicabilidade do modelo radiômico como ferramenta prognóstica. Porém, a efetiva inserção no ambiente clínico passa necessariamente pela realização de estudos mais amplos, bem como no estabelecimento de modelos de uso dentro do fluxo de trabalho na área de diagnóstico por imagem. Por exemplo, análises de estabilidade e reprodutibilidade das variáveis radiômicas em volumes maiores de dados são importantes e recomendadas para proporcionar mais evidências da robustez das características e realizar a futura validação da abordagem radiômica. Embora tenha uma proposta mais abrangente, incluindo aspectos relacionados à avaliação prognóstica e tomada de decisão terapêutica, a radiômica compartilha a mesma base conceitual e metodológica utilizada no desenvolvimento de sistemas de auxílio ao diagnóstico. Recentemente, a agência americana Food and Drug Administration definiu um conjunto de regras visando a facilitar que desenvolvedores de sistemas de detecção auxiliada por computador consigam obter a liberação regulamentar de seus produtos(30). Essas regras estabelecem, entre outros requisitos, que a documentação dos referidos sistemas indique uma descrição detalhada da população de pacientes para a qual o uso do sistema está indicado, uma descrição detalhada de equipamentos e protocolos de aquisição de imagem compatíveis, bem como a presença de avisos e discussões sobre limitações que devem incluir situações nas quais o dispositivo pode falhar ou não funcionar no nível de desempenho esperado (por exemplo, pela baixa qualidade de imagem ou para determinadas subpopulações), conforme aplicável. Essas regras visam a garantir que variações de desempenho no processo de reconhecimento de padrão nas imagens sejam evitadas, ou pelo menos minimizadas, possibilitando o uso generalizado da solução computacional, uma vez garantidas as condições de contorno. É de se esperar que algo similar tenha que ser também definido para os algoritmos computacionais voltados para radiômica. Em conclusão, o estudo aqui apresentado investigou diferentes métodos de radiômica para servir como biomarcadores quantitativos de imagens para neoplasias malignas pulmonares. O trabalho identificou uma assinatura radiômica baseada em transformada de Fourier em imagem de TC potencialmente útil para a avaliação prognóstica do câncer de pulmão, a estratificação do risco do paciente e a quantificação da heterogeneidade intratumoral. REFERÊNCIAS 1. Howlader N, Noone AM, Krapcho M, et al. SEER cancer statistics review, 1975-2013. Bethesda, MD: National Cancer Institute [updated 2016 Sep 12]. [cited 2020 Nov 10]. Available from: www.seer.cancer.gov/archive/csr/1975_2013/. 2. Koenigkam-Santos M, Muley T, Warth A, et al. Morphological computed tomography features of surgically resectable pulmonary squamous cell carcinomas: impact on prognosis and comparison with adenocarcinomas. Eur J Radiol. 2014;83:1275–81. 3. Sobin LH, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours. Hoboken, NJ: Wiley-Blackwell; 2010. 4. Thawani R, McLane M, Beig N, et al. Radiomics and radiogenomics in lung cancer: a review for the clinician. Lung Cancer. 2018; 115:34–41. 5. Cooper WA, O’Toole S, Boyer M, et al. What’s new in non-small cell lung cancer for pathologists: the importance of accurate subtyping, EGFR mutations and ALK rearrangements. Pathology. 2011; 43:103–15. 6. Vlahos I. Dilemmas in lung cancer staging. Radiol Clin North Am. 2018;56:419–35. 7. Tailor TD, Schmidt RA, Eaton KD, et al. The pseudocavitation sign of lung adenocarcinoma: a distinguishing feature and imaging biomarker of lepidic growth. J Thorac Imaging. 2015;30:308–13. 8. MacMahon H, Naidich DP, Goo JM, et al. Guidelines for management of incidental pulmonary nodules detected on CT images: from the Fleischner Society 2017. Radiology. 2017;284:228–43. 9. Yip SSF, Liu Y, Parmar C, et al. Associations between radiologist-defined semantic and automatically computed radiomic features in non-small cell lung cancer. Sci Rep. 2017;7:3519. 10. Larue RTHM, Defraene G, De Ruysscher D, et al. Quantitative radiomics studies for tissue characterization: a review of technology and methodological procedures. Br J Radiol. 2017;90:20160665. 11. Gillies RJ, Kinahan PE, Hricak H. Radiomics: images are more than pictures, they are data. Radiology. 2016;278:563–77. 12. Koenigkam-Santos M, Ferreira Júnior JR, Wada DT, et al. Artificial intelligence, machine learning, computer-aided diagnosis, and radiomics: advances in imaging towards to precision medicine. Radiol Bras. 2019;52:387–96. 13. Gevaert O, Echegaray S, Khuong A, et al. Predictive radiogenomics modeling of EGFR mutation status in lung cancer. Sci Rep. 2017; 7:41674. 14. Aerts HJWL Velazquez ER, Leijenaar RTH, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach. Nat Commun. 2014;5:4006. 15. Lee G, Lee HY, Park H, et al. Radiomics and its emerging role in lung cancer research, imaging biomarkers and clinical management: state of the art. Eur J Radiol. 2017;86:297–307. 16. Divine MR, Katiyar P, Kohlhofer U, et al. A population-based Gaussian mixture model incorporating 18F-FDG PET and diffusion-weighted MRI quantifies tumor tissue classes. J Nucl Med. 2016;57:473–9. 17. Giardino A, Gupta S, Olson E, et al. Role of imaging in the era of precision medicine. Acad Radiol. 2017;24:639–49. 18. Sacconi B, Anzidei M, Leonardi A, et al. Analysis of CT features and quantitative texture analysis in patients with lung adenocarcinoma: a correlation with EGFR mutations and survival rates. Clin Radiol. 2017;72:443–50. 19. Fedorov A, Beichel R, Kalpathy-Cramer J, et al. 3D Slicer as an image computing platform for the quantitative imaging network. Magn Reson Imaging. 2012;30:1323–41. 20. Velazquez ER, Parmar C, Jermoumi M, et al. Volumetric CT-based segmentation of NSCLC using 3D-Slicer. Sci Rep. 2013;3:3529. 21. Parmar C, Velazquez ER, Leijenaar R, et al. Robust radiomics feature quantification using semiautomatic volumetric segmentation. PLoS One. 2014;9:e102107. 22. Pinter C, Lasso A, Wang A, et al. Slicer RT: radiation therapy research toolkit for 3D Slicer. Med Phys. 2012;39:6332–8. 23. Zhang L, Fried DV, Fave XJ, et al. IBEX: an open infrastructure software platform to facilitate collaborative work in radiomics. Med Phys. 2015;42:1341–53. 24. Lux M, Marques O. Visual information retrieval using Java and LIRE. San Rafael, CA: Morgan & Claypool Publishers; 2013. 25. Schneider CA, Rasband WS, Eliceiri KW. NIH image to ImageJ: 25 years of image analysis. Nat Methods. 2012;9:671–5. 26. Ferreira Jr JR, Azevedo-Marques PM, Oliveira MC. Selecting relevant 3D image features of margin sharpness and texture for lung nodule retrieval. Int J Comput Assist Radiol Surg. 2017;12:509–17. 27. van Timmeren JE, van Elmpt W, Leijenaar RTH, et al. Longitudinal radiomics of cone-beam CT images from non-small cell lung cancer patients: evaluation of the added prognostic value for overall survival and locoregional recurrence. Radiother Oncol. 2019;136:78–85. 28. Carvalho S, Leijenaar RTH, Troost EGC, et al. 18F-fluorodeoxyglucose positron-emission tomography (FDG-PET)-radiomics of metastatic lymph nodes and primary tumor in non-small cell lung cancer (NSCLC) – a prospective externally validated study. PLoS One. 2018;13:e0192859. 29. Ferreira-Junior JR, Koenigkam-Santos M, Tenório APM, et al. CT-based radiomics for prediction of histologic subtype and metastatic disease in primary malignant lung neoplasms. Int J Comput Assist Radiol Surg. 2020;15:163–72. 30. Federal Register. Radiology devices; reclassification of medical analyzers [updated 2020 Jan 22]. [cited 2020 Nov 10]. Available from: https://www.federalregister.gov/documents/2020/01/22/2020-00494/radiology-devices-reclassification-of-medical-image-analyzers. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Ribeirão Preto, SP, Brasil. a. https://orcid.org/0000-0002-8202-588X b. https://orcid.org/0000-0002-7160-4691 c. https://orcid.org/0000-0001-6812-506X d. https://orcid.org/0000-0003-1368-0917 e. https://orcid.org/0000-0002-5848-2861 f. https://orcid.org/0000-0002-6356-2516 g. https://orcid.org/0000-0002-7687-3161 h. https://orcid.org/0000-0002-7271-2774 Correspondência: Dr. José Raniery Ferreira Junior Avenida Doutor Enéas Carvalho de Aguiar, 44, Cerqueira César São Paulo, SP, Brasil, 05403-904 E-mail: jose.raniery@incor.usp.br Recebido para publicação em 27/11/2019 Aceito, após revisão, em 5/2/2020 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554