Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Ahead of Print
Ahead of Print
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Luiza de Campos Moreira da Silva1; Julia Teixeira de Oliveira2; Sandra Tochetto3; Claudia Pinto Marques Souza de Oliveira4; Rosa Sigrist5; Maria Cristina Chammas6 |
|
|
Descritores: Técnicas de imagem por elasticidade/métodos; Ultrassonografia/métodos; Fígado/diagnóstico por imagem; Fígado gorduroso/diagnóstico. |
|
|
Resumo: INTRODUÇÃO
Esteatose hepática ocorre em consequência de acúmulo de lipídios, microvesicular ou macrovesicular, nos hepatócitos, acima de 5% do peso do fígado, mais comumente por deposição de triglicérides. Essa condição tem como principal fator de risco doenças responsáveis por distúrbios metabólicos, como obesidade, diabetes mellitus tipo II e hiperlipidemias, e outras comorbidades que lesem os hepatócitos, como hepatite C e uso de drogas e álcool (Tabela 1). A doença hepática gordurosa não alcoólica (DHGNA), diferentemente de outras hepatopatias, é uma condição de esteatose hepática que não está associada ao consumo excessivo de álcool, mas sim a síndrome metabólica, destacando-se a resistência à insulina como um dos fatores mais predisponentes(1). O aumento da incidência de obesidade, diabetes mellitus tipo II e síndrome metabólica contribuiu para o aumento da incidência de DHGNA, de modo que a sua prevalência varia de 15% a 24%, de acordo com o país(2,3), atingindo 57,5% a 74% dos obesos(2,4,5), 22,5% das crianças(6) e 52,8% das crianças obesas(7). Estima-se que 50% dos indivíduos com diabetes mellitus tipo II apresentem algum grau de DHGNA(2,7). A cronificação da esteatose cursa com inflamação lobular e evolui com balonização dos hepatócitos e fibrose – esteato-hepatite não alcoólica (EHNA). Com o avanço da fibrose, a DHGNA evolui para cirrose e, posteriormente, para carcinoma hepatocelular(8). O diagnóstico preciso de fibrose e atividade inflamatória hepática é de extrema importância para determinar o estádio da doença, prognóstico do paciente e programar o tratamento(9). Marcadores biológicos e sorologias têm pouco valor para determinar o grau de fibrose; possuem maior significância quando associado a outros exames. A análise histopatológica da biópsia hepática continua sendo o padrão ouro no diagnóstico e estadiamento do grau de fibrose. Contudo, a biópsia apresenta limitações e complicações relevantes que levaram ao desenvolvimento de métodos não invasivos, como exames de imagem, para estimar a quantidade de fibrose hepática(10). Este artigo tem como objetivo realizar uma revisão dos diferentes métodos ultrassonográficos nos diagnósticos utilizados para investigação de graus de fibrose e acometimento hepático em pacientes portadores de esteatose hepática. MÉTODOS DIAGNÓSTICOS O diagnóstico acurado e precoce do acometimento hepático é desejável por proporcionar melhor resposta terapêutica dos pacientes na fase inicial da doença. Para isso, existem diversos métodos que permitem analisar o fígado(11). A avaliação e o diagnóstico da esteatose e fibrose hepática podem ser realizados por exames complementares laboratoriais, de imagens e biópsia. O exame clínico não permite um diagnóstico precoce das alterações hepáticas, já que a maioria dos pacientes na fase inicial da doença é assintomática e com exame físico sem alterações. Dentre os exames de imagem destacam-se a ultrassonografia (US) convencional e os métodos elastográficos elastografia transitória (transient elastography – TE), point-shear wave elastography (p-SWE) e 2D-shear wave elastography (2D-SWE). Além desses, existe a strain elastography, uma forma de quasi-static strain imaging, mas que não é utilizada no fígado, pois é mais eficaz em tecidos superficiais. A elastografia por ressonância magnética (RM) também pode ser utilizada na análise de fibrose hepática. Nesse contexto, a biópsia hepática ainda é considerada o padrão ouro no diagnóstico de esteatose hepática(10). Biomarcadores de esteatose e de fibrose hepática na DHGNA A DHGNA, na maioria das vezes, é suspeitada ou descoberta por acaso em avaliações de rotina, normalmente por meio de US simples de abdome ou exames laboratoriais abordando enzimas hepáticas. O exame inicial é a US abdominal, por ser de baixo custo e amplamente disponível. Deve-se salientar, contudo, que ela tem sensibilidade limitada para detectar esteatose quando menor que 20% ou em obesos com índice de massa corpórea (IMC) > 40 kg/m². A espectroscopia por RM, exame de imagem ideal para a detecção da esteatose hepática, tem custo elevado e é usada apenas em centros específicos e para propósitos de estudo. Outros meios de se abordar de forma não invasiva a DHGNA são os escores clínicos para esteatose, e três deles têm ganhado relevância por terem sido validados externamente, apesar de servirem apenas para estabelecer a presença, e não a gravidade: o índice de gordura hepática; o SteatoTest; e o escore de gordura hepática para DHGNA(12,13). Para diagnóstico de fibrose, grande determinante do prognóstico na DHGNA, os biomarcadores são menos precisos em detectar estágios intermediários de fibrose em comparação com cirrose. Em 65–90% dos indivíduos saudáveis, a relação aspartato aminotransferase/alanina aminotransferase (AST/ALT) é geralmente menor que 1. Já em pacientes portadores de esteatose, a relação começa a aumentar devido ao aumento dos níveis de AST, principalmente, e se inverte em estágios de fibrose acentuada, com a progressão da doença e evolução para cirrose. Os níveis de fosfatase alcalina e gama-glutamiltransferase estão aumentados em duas a três vezes em menos de 50% dos casos de fibrose avançada. Além desses marcadores, são utilizadas outras variáveis para a análise de fibrose, como idade, hiperglicemia, IMC, plaquetas e albumina(14). Na investigação de esteatose são utilizados marcadores de estresse oxidativo (níveis plasmáticos de vitamina E, glutationa peroxidase e teste respiratório), marcadores de inflamação (dosagens séricas de citocinas: TNF-alfa e adiponectinas) e marcadores de apoptose(15). No teste nonalcoholic steatohepatitis analisam-se os índices de alfa-2 macroglobulina, apolipoproteína, bilirrubina total e gamaglutamiltransferase, que estão aumentados(16). Além dos biomarcadores descritos, existem escalas para diagnóstico de fibrose: escores HAIR (hypertension, ALT, insuline resistance) e BAAT (BMI, age, ALT, triglicérides). O escore HAIR é utilizado para determinar se o paciente tem ou não DHGNA, por meio dos parâmetros de hipertensão arterial, ALT elevada e resistência à insulina. A presença de dois ou mais fatores indica EHNA(17). Já o escore BAAT deve ter, pelo menos, um dos seguintes resultados para não ser excluída a hipótese de fibrose e/ou cirrose hepática: IMC > 28 kg/m², idade igual ou maior que 50 anos, ALT duas ou mais vezes elevada que o normal e triglicérides maior ou igual a 1,7 mmol/L(16). Ambos os escores servem de parâmetro para fatores preditivos de fibrose hepática e de gravidade da EHNA. Contudo, atualmente, os escores mais validados externamente são o escore de fibrose na DHGNA e o calculador de fibrose 4(18), além do FibroTest, este já usado anteriormente em hepatite crônica B e C para estabelecer fibrose avançada. Esses testes são mais acurados para distinguir fibrose avançada (F3 ou maior) de não avançada. Uma outra ferramenta de avaliação não invasiva é a TE (FibroScan; Echosens, Paris, França)), também já de grande uso nas hepatites virais crônicas. Assim como outros testes, o desempenho é melhor para diferenciar fibrose avançada de não avançada. O parâmetro de atenuação controlada (controlled attenuation parameter – CAP) pode ser medido junto à elastografia e mostrou ser capaz de detectar esteatose com boa acurácia, mas é menos confiável para a determinação do grau de acometimento(19). Ainda não existe consenso quanto ao uso de todos esses marcadores para a avaliação inicial e continuada da DHGNA, especialmente no aspecto de se evitar biópsia hepática. Muitos autores sugerem a combinação de vários desses métodos. Biópsia hepática Para a confirmação do diagnóstico de EHNA ainda é necessária a biópsia. A decisão de se propor a biópsia deve ser discutida e individualizada com cada paciente. Um número de achados clínicos associados a EHNA e/ou também a fibrose avançada em pacientes com DHGNA pode auxiliar na indicação de biópsia hepática, destacando-se: idade acima da 45 anos, presença de obesidade ou de diabetes e relação AST/ALT > 1. As indicações da biópsia hepática são: alteração de enzimas hepáticas ou dos escores de fibrose no contexto de esteatose (frequentemente vista em ultrassom), ou ainda para diferenciar o tipo de acometimento hepático predominante em situações de doenças concomitantes. O estudo anatomopatológico é o procedimento ideal para se estadiar a doença. Os achados típicos da EHNA são: esteatose, normalmente macrogoticular e graduada em três níveis; balonização de hepatócitos; infiltrado inflamatório lobular misto; e fibrose, inicialmente perissinusoidal, predominando na zona 3 (zona centrolobular), mas podendo ainda haver fibrose periportal. A fibrose, contudo, não é necessária para se firmar o diagnóstico. Além desses achados, pode haver inflamação periportal, vacuolização glicogênica, megamitocôndrias e corpúsculos de Mallory-Denk, em número menor que na doença alcoólica, a qual, por sua vez, é em muitos aspectos idêntica, apesar de ter inflamação lobular mais exuberante e outras características próprias(19). Apesar de a biópsia ser o método padrão ouro no diagnóstico de DHGNA, há controvérsias sobre a sua validade. Uma questão seria a representatividade do material, já que o fragmento hepático analisado tem um volume de aproximadamente 1/50.000 do volume total do órgão, podendo subestimar o grau de lesão tecidual, tendo em vista que o processo de fibrogênese no parênquima é dinâmico e tem distribuição heterogênea. Além disso, é observada certa variação interobservador na interpretação de lâminas, podendo haver discordância entre patologistas, principalmente entre os menos experientes. Diversos estudos mostram que a concordância interobservador entre patologistas mais experientes chega a ser quase perfeita. Por isso, a avaliação interobservador pode apresentar variação de κ estatístico de 0,4 a 0,9(8). Por ser um procedimento invasivo, é um método com riscos de complicações graves, observadas em cerca de 1% dos casos(20). Dessa forma, em contexto de acompanhamento de indivíduos portadores de DHGNA, não é o exame mais indicado, apesar de ser o que melhor traduz o grau de injúria tecidual. US A US é o método diagnóstico mais simples, apresentando melhores resultados diagnósticos quando a esteatose é maior que 30%(21), não invasivo, sem radiação, de fácil acesso, com ótimo custo-benefício e que demonstra achados sugestivos de esteatose em mais de 16% das pessoas saudáveis não obesas e em cerca de 95% dos obesos que fazem uso de álcool. Todavia, tem sensibilidade limitada para detectar esteatose menor que 20% ou em obesos com IMC > 40 kg/m². Estudos revelam boa concordância entre a classificação por US e o exame histopatológico, além de sensibilidade de 89% e especificidade de 93%(22), no entanto, não é possível diferenciar a esteatose de EHNA pelo exame de US, necessitando análise histopatológica(7). Na classificação de Saadeh et al.(22), pode-se quantificar a esteatose por meio da US nos seguintes graus (Figuras 1 a 5): grau 1 (leve) – aumento difuso e brando da ecogenicidade hepática, com visualização normal dos vasos intra-hepáticos e do diafragma; grau 2 (moderada) – aumento difuso e moderado da ecogenicidade hepática, com borramento na visualização dos vasos intra-hepáticos e do diafragma; grau 3 (acentuada) – aumento acentuado da ecogenicidade hepática, não se visualizam os vasos intra-hepáticos, diafragma e região posterior do fígado(22,23). 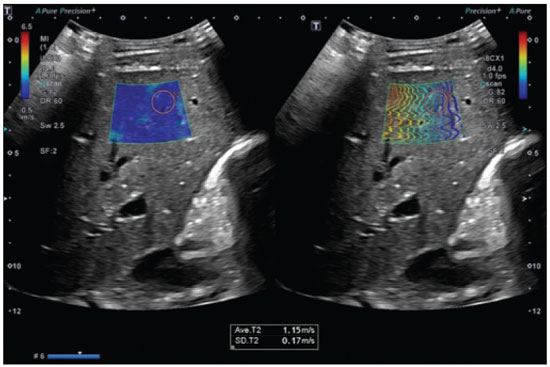 Figura 1. A 2D-SWE study showing normal elasticity of the liver parenchyma (1.15 m/s), consistent with a METAVIR stage of F0. The elastography map is homogeneous and predominantly blue, a color range that represents less stiffness, and the propagation mode (on the right) indicates normality. 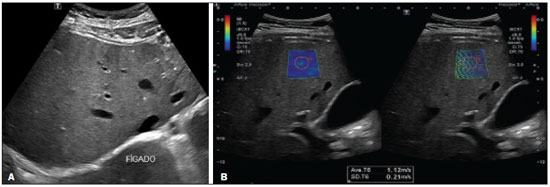 Figura 2. A: Ultrasound examination of a liver with mild steatosis, as characterized by the slightly increased echogenicity of the liver parenchyma. The hepatic vessels and diaphragm are clearly visible. B: A 2D-SWE study showing normal elasticity of the liver parenchyma (1.12 m/s), consistent with a METAVIR stage of F0. The elastography map is homogeneous and predominantly blue, indicating less stiffness. The propagation mode (on the right) indicates normality. 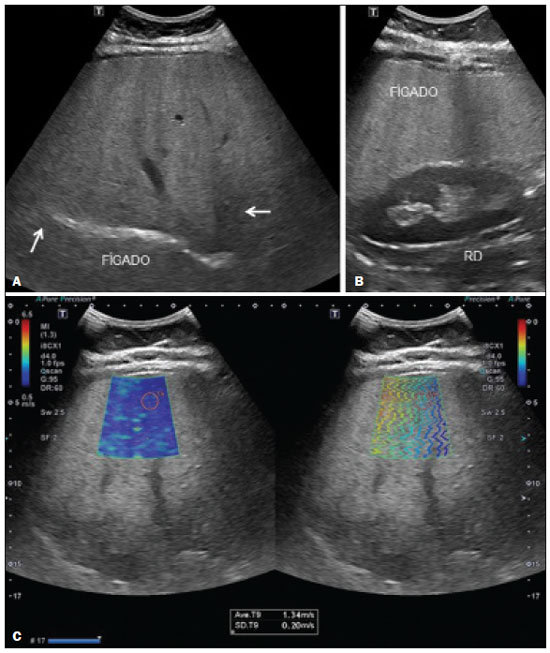 Figura 3. 3. A: Ultrasound examination of a liver with moderate steatosis, as characterized by increased echogenicity of the liver parenchyma and posterior attenuation of the ultrasound beam. The attenuation of the ultrasound beam decreases the definition of the hepatic vessels and the diaphragm, although they are still identifiable (arrow). The echogenicity of the liver is higher than is that of the right kidney (B). C: A 2D-SWE study showing greater parenchymal stiffness, albeit still within normal limits (1.34 m/s), consistent with a METAVIR stage of F0/F1. Although the elastography map is a bit less homogeneous, it is still predominantly blue, indicating less stiffness, despite a larger number of green areas. 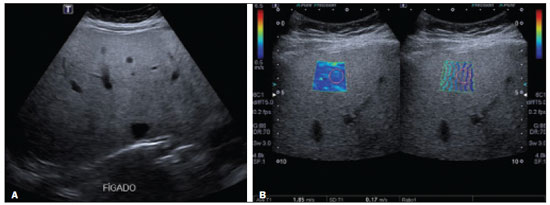 Figura 4. A: Ultrasound examination of a liver with marked steatosis, as characterized by increased echogenicity of the liver parenchyma and posterior attenuation of the ultrasound beam. Attenuation of the ultrasound beam obscures the view of the diaphragm. B: A 2D-SWE study showing greater stiffness of the liver parenchyma (1.85 m/s), consistent with a Metavir stage of F3. The blue and green tones are in equal proportions on the elastography map and the lines are further apart in the propagation mode. 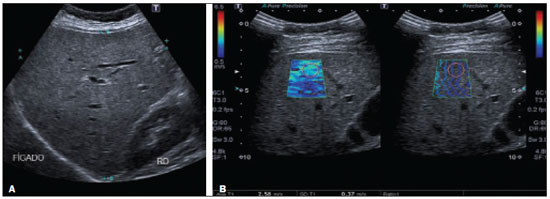 Figura 5. A: Ultrasound examination of a liver with mild steatosis and signs of chronic liver disease, as characterized by blunt edges, irregular contours, and heterogeneous parenchyma. B: A 2D-SWE study showing greater stiffness of the liver parenchyma (2.58 m/s), consistent with a Metavir stage of F4. On the elastography map, tones of green predominate, and there is greater line separation in the propagation mode. Elastografia A elastografia é um método que utiliza a medida da velocidade de propagação de ondas ultrassonográficas que atravessam o fígado para quantificar a fibrose hepática: quanto mais enrijecido o fígado, em função da evolução da fibrose, maior será a velocidade de propagação das ondas. Assim, com base na velocidade de propagação do som, é possível diagnosticar o estágio da fibrose pelo grau de rigidez do tecido hepático. Existem vários tipos de elastografia por US, sendo as principais para o estudo hepático a TE, a 2D-SWE e a p-SWE. Técnica de exame Em cada método de elastografia, o paciente deve estar na posição supina ou em decúbito lateral esquerdo, com o braço direito elevado sobre a cabeça para aumentar a janela acústica intercostal, e o transdutor colocado no espaço intercostal(24). O local selecionado para a medida deve levar em conta a profundidade e a escolha da janela acústica mais adequada para conseguir uma medida mais fidedigna da rigidez hepática, dada por múltiplas medidas no mesmo local. Para otimizar os resultados, a medida é realizada enquanto o paciente segura a respiração por alguns segundos, pois uma respiração profunda e manobra de Valsalva mudam a pressão venosa hepática, podendo alterar a medida da rigidez(8). A literatura sugere que 10 medidas devem ser obtidas, registrando-se a média entre elas. Mais de 60% das medidas devem ser consideradas adequadas. Uma boa medição é aquela que obtém um resultado numérico diferente de “x,xx” ou “0,00”(8). A razão interquartil /mediana é a medida estatística da dispersão, sendo igual à diferença entre o maior e o menor quartil e reflete a variabilidade das medidas válidas: uma razão interquartil/mediana < 0,30 reflete que os dados são válidos(8,25). TE O aparelho utilizado para fazer a TE é o FibroScan. Foi o primeiro dispositivo desenvolvido para medir a elasticidade hepática como alternativa à biópsia. É dedicado exclusivamente à análise da fibrose hepática, sem outras finalidades diagnósticas, já que não é um equipamento de US convencional. Um transdutor de ultrassom operando a 5 MHz é construído sobre o eixo de um pistão que atua como um vibrador. Ao pressionar um botão, vibrações transientes de baixa frequência (50 Hz) são transmitidas e as ondas de cisalhamento elásticas geradas propagam- se pelos tecidos subjacentes. É utilizada na avaliação da elasticidade tissular em pacientes com doenças hepáticas crônicas para estimar o grau de fibrose(25). Aquisições de ultrassom são usadas para seguir a propagação da onda de corte e medir a sua velocidade. A TE mede a rigidez do fígado em um volume que se aproxima a um cilindro de 10 mm de largura por 40 mm de comprimento entre 25 e 65 mm abaixo da superfície da pele, volume este que é pelo menos 100 vezes maior do que uma amostra de biópsia e, portanto, muito mais representativo do parênquima do fígado(9). As medidas devem ser realizadas em uma área de parênquima, sem vasos e osso; medidas adquiridas de forma inadequada e com pressão elevada do transdutor sobre a pele são descartadas automaticamente. A intensidade da onda de ultrassom está diretamente relacionada à elasticidade, diminuindo exponencialmente à medida que se propaga no meio, ou seja, quanto mais endurecido o tecido, mais rápida é a propagação das vibrações. Portanto, quanto maior o resultado (em kPa), maior o grau de fibrose do parênquima hepático(25). O CAP é uma ferramenta relacionada ao aparelho de TE, operador-independente, empregada para quantificação de esteatose hepática. As medidas realizadas pelo CAP são fornecidas em dB/m e seguem o mesmo padrão de aquisição das adquiridas pelo FibroScan. Um estudo realizado com pacientes com sobrepeso e obesos portadores de doenças hepáticas crônicas demonstrou sensibilidade e especificidade, respectivamente, de 76% e 79% na detecção de esteatose envolvendo menos que 10% dos hepatócitos (214–289 dB/m), 85% e 79% para 11–33% de acometimento hepático (233–311 dB/m) e 83% e 79% para 67–100% (266–318 dB/m). Apesar de poucos estudos realizados para avaliação do método, o CAP tem se revelado uma boa forma de avaliação e acompanhamento de pacientes com DHGNA, uma vez que é um procedimento fácil e capaz de analisar uma porção hepática equivalente a 100 vezes a analisada na biópsia, além de ser operador-independente e obter resultados imediatos(23). Estudos revelam que o FibroScan apresenta boa reprodutibilidade, embora o nível de concordância diminua em pacientes com um menor grau de fibrose e esteatose hepática ou com IMC aumentado(7). p-SWE A técnica p-SWE consiste na medida da velocidade de propagação de ondas de cisalhamento no parênquima hepático, como forma de avaliar o grau de rigidez do fígado(26). Um pulso acústico (acoustic radiation force impulse – ARFI) é aplicado numa região de interesse, escolhida pelo operador e, diferentemente da TE, não necessita de estímulo vibratório, tornando a medida mais precisa e com menos variação interobservador e maior reprodutibilidade(25,27). A área analisada é um retângulo de 10 mm × 5 mm que pode ser movido livremente na imagem bidimensional (modo-B) até uma profundidade máxima de 80 mm abaixo da superfície da pele(25), o que permite uma medida mais adequada em pacientes obesos e com ascite. As medidas são preferencialmente realizadas no lobo hepático direito, nos segmentos 5 e 8, nos espaços intercostais. A utilização no lobo esquerdo é útil nos pacientes obesos, nos quais pode haver dificuldades técnicas na obtenção das medidas no lobo direito. A p-SWE indica numericamente o grau de rigidez hepática pela emissão de pulsos acústicos que produzem ondas de cisalhamento, cuja velocidade é proporcional ao grau de rigidez do órgão examinado (quanto maior a velocidade, maior a rigidez). Conforme a esteatose progride para fibrose, a rigidez do órgão aumenta, de modo que a velocidade de propagação das ondas de cisalhamento será maior. Além disso, por ser uma técnica acoplada ao equipamento de US convencional, é possível avaliar o fígado morfologicamente (modo-B), realizar o exame de Doppler hepático, além de evitar áreas como vasos e outras estruturas que podem comprometer o procedimento, e distinguir áreas enrijecidas de preservadas ao se utilizar escala de cinza ou colorida, permitindo, portanto, uma avaliação mais global do fígado quando comparada à técnica de TE(26). Para o estadiamento da fibrose, utiliza-se o escore histológico METAVIR (Tabela 2), em que os resultados obtidos pela técnica p-SWE são comparados à biópsia hepática. Estudos revelam boa sensibilidade e especificidade do método quando comparado à biópsia(24), e uma metanálise realizada com 518 pacientes mostrou correlação entre os resultados da p-SWE e a biópsia hepática, com acurácia de 87% para fibrose F2, 91% para fibrose F3 e 93% para fibrose grau F4(20).  Apesar do alto custo de aquisição do equipamento, o que restringe a aplicação da técnica para além dos centros de referência, é possível em alguns equipamentos atualizar o software ou o hardware para se implementar a ferramenta de elastografia, sem necessidade de substituição, o que pode reduzir o impacto orçamentário da eventual incorporação dessa técnica em serviços menores. 2D-SWE Na técnica 2D-SWE são realizadas múltiplas medidas com técnica ARFI em um grande campo de visão, que pode ser realizado com uma única imagem em tempo real. A média, o máximo, o mínimo e o desvio-padrão da velocidade da onda de cisalhamento são analisados em uma região de interesse. Por ser em tempo real, avalia diversas regiões do fígado e permite a visualização da produção das medidas elastográficas num display colorido, conforme vão se acumulando(20,25). O foco da ARFI é arrastado para baixo do eixo acústico mais rápido do que a velocidade de onda de cisalhamento, de modo a gerar deslocamentos quase simultâneos de tecido (dezenas de µm) em todas as posições ao longo do eixo acústico, produzindo uma onda de cisalhamento na forma de cone com ângulo raso, que se desloca a partir da linha de pressão, se propagando menos e, assim, se decompondo menos rapidamente com a distância do que seria a partir de um único foco. Um scanner muito rápido alcança uma taxa de ultrassons de até 20 kHz, transmitindo uma onda plana e focando apenas em receber, de modo que cada imagem de eco ultrassonográfico seja criada com um único pulso de transmissão. Em seguida, é realizada a análise das diferenças entre os tempos de chegada em diferentes posições, para ser criada uma parte da imagem final da velocidade de onda de cisalhamento. O processo é repetido por um número de diferentes linhas de envio para criar uma imagem final quantitativa de elasticidade em uma caixa, a qual é apresentada como uma sobreposição de cores na imagem modo-B (em unidades de m/s) ou convertido para o módulo de Young (em kPa para TE). Dessa forma, o software utiliza três razões relacionadas: a imagem padrão do eco modo-B; um sistema ecográfico utilizado para rastrear o deslocamento; e o elastograma da onda de cisalhamento(27). Em pacientes com hepatopatias crônicas, a técnica 2D-SWE mostrou acurácia maior, quando comparada à técnica TE, na detecção de estágios iniciais e intermediário de fibrose. A dependência do operador de 2D-SWE é pequena, embora seja necessário cuidado para minimizar a pressão do transdutor durante o exame de imagem de tecidos superficiais, de modo a evitar um artefato de medidas de rigidez superestimadas. Alguns fatores afetam a qualidade dos dados, produzindo erros de velocidade ou perda de sinal: a força e velocidade da onda de cisalhamento; as variações na atenuação, absorção e reflexão do feixe de som e da densidade de dispersão do ultrassom; a continuidade do tecido; a dispersão, reflexão ou refração das ondas de cisalhamento(24). Vale ressaltar que as diferentes técnicas de elastossonografia comercializadas por diferentes fabricantes têm valores distintos de cut-offs em m/s ou kPa para cada grau de fibrose hepática. A Tabela 3 mostra como as diferentes técnicas se relacionam com a classificação METAVIR(29) (Figuras 1 a 5). 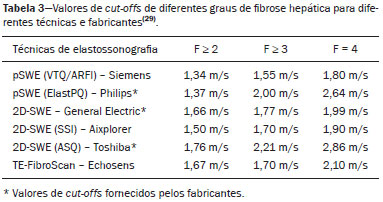 O QUE ESTÁ CONSOLIDADO NA LITERATURA A literatura indica que a técnica de elastografia pode ser utilizada para distinguir pacientes sem ou com fibrose mínima, além de diferenciá-los dos pacientes com fibrose grave ou cirrose, sem a necessidade de um procedimento invasivo, a não ser que haja outro fator de doença, como risco de agudização da hepatite crônica que não seria devidamente diagnosticada com método não invasivo(8). Além disso, a eficácia do uso da elastografia depende do conhecimento médico e da técnica empregada no exame, o que torna mais difícil pela complexidade da doença hepática e pela variedade de técnicas disponíveis. No Brasil, a conduta diagnóstica da DHGNA é direcionada pelo Consenso da Sociedade Brasileira de Hepatologia, que ressalta a importância da investigação de fatores metabólicos e doenças associadas a esteatose, principalmente por uma boa avaliação clínica e solicitação de exames laboratoriais (função e enzimas hepáticas, sorologias). Segundo esse consenso, os métodos de imagem, como US, tomografia computadorizada e RM, são classificados como métodos diagnósticos complementares à biópsia, pois são importantes para descartar diagnósticos diferenciais, mas não são capazes de distinguir esteatose de esteato-hepatite. Felizmente, a TE e outros métodos elastográficos estão descritos como colaboradores no diagnóstico da fibrose hepática nos pacientes com DHGNA. A biópsia só é fortemente indicada em casos de: suspeita de esteato-hepatite com diagnóstico diferencial com outras doenças crônicas do fígado; DHGNA com risco elevado de ter esteato-hepatite e/ou fibrose avançada sugerida pelos marcadores sorológicos e/ou elastografia hepática; enzimas hepáticas (ALT/AST) elevadas por mais de três meses; e portadores de síndrome metabólica não controlados com tratamento não medicamentoso e com alteração de hábito de vida depois de seis meses(30). A complexidade do diagnóstico de fibrose hepática e DHGNA é vista com entusiasmo pela comunidade de pesquisa, pois abre espaço para que sejam feitos estudos nessa área. Como resultado, a técnica de elastografia caminha para um considerável aprimoramento das técnicas atuais e espera-se aprimoramentos importantes na qualidade da imagem, na facilidade de uso, na quantificação e alcance das características do tecido que são mensuráveis, podendo um dia substituir completamente a biópsia hepática no diagnóstico de esteatose, evitando que muitas pessoas sejam submetidas a esse procedimento invasivo(20,27). REFERÊNCIAS 1. Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346: 1221–31. 2. Nomura H, Kashiwagi S, Hayashi J, et al. Prevalence of fatty liver in a general population of Okinawa, Japan. Jpn J Med. 1988;27:142–9. 3. Hilden M, Christoffersen P, Juhl E, et al. Liver histology in a ‘normal’ population—examinations of 503 consecutive fatal traffic casualties. Scand J Gastroenterol. 1977;12:593–7. 4. Bellentani S, Saccoccio G, Masutti F, et al. Prevalence of and risk factors for hepatic steatosis in Northern Italy. Ann Intern Med. 2000;132:112–7. 5. Luyckx FH, Desaive C, Thiry A, et al. Liver abnormalities in severely obese subjects: effect of drastic weight loss after gastroplasty. Int J Obes Relat Metab Disord. 1998;22:222–6. 6. Tominaga K, Kurata JH, Chen YK, et al. Prevalence of fatty liver in Japanese children and relationship to obesity. An epidemiological ultrasonographic survey. Dig Dis Sci. 1995;40:2002–9. 7. Franzese A, Vajro P, Argenziano A, et al. Liver involvement in obese children. Ultrasonography and liver enzyme levels at diagnosis and during follow-up in an Italian population. Dig Dis Sci. 1997;42:1428–32. 8. Barr RG, Ferraioli G, Palmeri ML, et al. Elastography assessment of liver fibrosis: Society of Radiologists in Ultrasound Consensus Conference Statement. Ultrasound Q. 2016;32:94–107. 9. Vergniol J, Foucher J, Terrebonne E, et al. Noninvasive tests for fibrosis and liver stiffness predict 5-year outcomes of patients with chronic hepatitis C. Gastroenterology. 2011;140:1970–9. 10. Rockey DC, Caldwell SH, Goodman ZD, et al. Liver biopsy. Hepatology. 2009;49:1017–44. 11. Chen J, Talwalkar JA, Yin M, et al. Early detection of nonalcoholic steatohepatitis in patients with nonalcoholic fatty liver disease by using MR elastography. Radiology. 2011;259:749–56. 12. Bedogni G, Bellentani S, Miglioli L, et al. The fatty liver index: a simple and accurate predictor of hepatic steatosis in the general population. BMC Gastroenterol. 2006;6:33. 13. Kahl S, Straßburger K, Nowotny B, et al. Comparison of liver fat indices for the diagnosis of hepatic steatosis and insulin resistance. PLoS One. 2014;9:e94059. 14. Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45:846–54. 15. Wieckowska A, McCullough AJ, Feldstein AE. Noninvasive diagnosis and monitoring of nonalcoholic steatohepatitis: present and future. Hepatology. 2007;46:582–9. 16. Poynard T, Ratziu V, Charlotte F, et al. Diagnostic value of biochemical markers (Nash test) for the prediction of non alcoholo steato hepatitis in patients with non-alcoholic fatty liver disease. BMC Gastroenterol. 2006;6:34. 17. Dixon JB, Bhathal PS, Hughes NR, et al. Nonalcoholic fatty liver disease: improvement in liver histological analysis with weight loss. Hepatology. 2004;39:1647–54. 18. Shah AG, Lydecker A, Murray K, et al. Use of the FIB4 index for non-invasive evaluation of fibrosis in nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2009;7:1104–12. 19. Bedossa P, Patel K. Biopsy and noninvasive methods to assess progression of nonalcoholic fatty liver disease. Gastroenterology. 2016;150:1811–22. 20. Cosgrove D, Piscaglia F, Bamber J, et al. EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 2: clinical applications. Ultraschall Med. 2013;34:238–53. 21. Parise ER. Métodos de imagem e testes não invasivos no diagnóstico da DHGNA. In: Sociedade Brasileira de Hepatologia. Doença hepática gordurosa não alcoólica. p. 10. [cited 2019 Oct 23]. Available from: sbhepatologia.org.br/pdf/revista_monotematico_hepato.pdf 22. Saadeh S, Younossi ZM, Remer EM, et al. The utility of radiological imaging in nonalcoholic fatty liver disease. Gastroenterology. 2002;123:745–50. 23. Lupşor-Platon M, Stefǎnescu H, Mureşan D, et al. Noninvasive assessment of liver steatosis using ultrasound methods. Med Ultrason. 2014;16:236–45. 24. European Association for Study of Liver; Asociación Latinoamericana para el Estudio del Hígado. EASL-ALEH clinical practice guidelines: non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63:237–64. 25. Piscaglia F, Marinelli S, Bota S, et al. The role of ultrasound elastographic techniques in chronic liver disease: current status and future perspectives. Eur J Radiol. 2014;83:450–5. 26. Yoneda M, Suzuki K, Kato S, et al. Nonalcoholic fatty liver disease: US-based acoustic radiation force impulse elastography. Radiology. 2010;256:640–7. 27. Bamber J, Cosgrove D, Dietrich CF, et al. EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 1: basic principles and technology. Ultraschall Med. 2013;4:169–84. 28. Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology. 1996;24:289–93 . 29. Sigrist RMS, Liau J, Kaffas AE, et al. Ultrasound elastography: review of techniques and clinical applications. Theranostics. 2017;7:1303–29. 30. Sociedade Brasileira de Hepatologia. Doença hepática gordurosa não alcoólica. Consenso da Sociedade Brasileira de Hepatologia. 2015. [cited 2017 Jun 16]. Available from: http://www.sbhepatologia.org.br/pdf/Consenso_DHGNA_da_SBH-2015.pdf. 1. Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brazil; https://orcid.org/0000-0002-6051-4228 2. Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brazil; https://orcid.org/0000-0002-8770-3096 3. Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brazil; https://orcid.org/0000-0003-3588-2069 4. Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brazil; https://orcid.org/0000-0002-2848-417X 5. Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brazil; https://orcid.org/0000-0002-5780-4136 6. Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brazil; https://orcid.org/0000-0001-7041-3079 Correspondência: Luiza de Campos Moreira da Silva. FMUSP – Instituto de Radiologia Rua Doutor Ovídio Pires de Campos, 75, Cerqueira César São Paulo, SP, Brazil, 05403-010 Email: luiza.silva@fm.usp.br Recebido para publicação em 18/2/2019 Aceito, após revisão, em 12/4/2019 Data de publicação: 28/10/2019 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554
