Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 55 nº 5 - Set. / Out. of 2022
Vol. 55 nº 5 - Set. / Out. of 2022
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Luísa Becker Savastano1,a; Juliana Ávila Duarte2,b; Thiago Bezerra1,c; José Thiago de Souza Castro1,d; Mariana Dalaqua3,e; Fabiano Reis1,f |
|
|
Descritores: Hipertensão intracraniana idiopática; Neuroimagem; Papiledema. |
|
|
Resumo: INTRODUÇÃO
A hipertensão intracraniana idiopática (HII), previamente descrita como hipertensão intracraniana benigna ou pseudotumor cerebri, é uma síndrome caracterizada por aumento da pressão intracraniana de causa não completamente elucidada, com exame neurológico e análise de líquor quase normais, exceto pela presença de sinais e sintomas como cefaleia, papiledema, tinnitus, paralisia dos nervos cranianos e perda da visão. Alguns estudos propõem que uma variante atípica é a presença da HII sem papiledema(1), porém, Toscano et al.(2) indicam que embora a prevalência de papiledema em sua casuística tenha sido de apenas 5%, este seria um sinal específico. Alguns mecanismos já foram propostos, como aumento do volume sanguíneo cerebral, excesso de líquor por aumento da produção ou redução da reabsorção, e mecanismos inflamatórios. Corroborando a ideia de mecanismo inflamatório, autoimunidade relacionada a astrócitos já foi caracterizada, assim como presença de bandas oligoclonais, um marcador de inflamação intratecal, observada em cerca de um terço dos pacientes. Anticorpos anti-GFAP foram detectados no soro de pacientes com HII em fase ativa(3). Disfunção do sistema linfático também poderia ter impacto na fisiopatologia da HII, por sobrecarga de fluido intersticial. Isto pode ser o resultado de uma perda de aquaporina-4 ou do aumento da permeabilidade da barreira hematoencefálica durante a inflamação perivascular, provocando expansão do compartimento intersticial(2). A ressonância magnética (RM) e a venografia por RM ou ângio-RM venosa são fundamentais para o diagnóstico, pois permitem caracterizar os aspectos de neuroimagem de HII e excluir outras causas estruturais de aumento da pressão intracraniana, principalmente a trombose venosa cerebral. A caracterização de pelo menos três achados de neuroimagem relacionados à HII (sela turca vazia, achatamento posterior do globo ocular/esclera, estenose do seio transverso bilateral ou do seio dominante e distensão do espaço liquórico perióptico, com ou sem tortuosidade do nervo óptico) permite o diagnóstico, destacando-se a importância dessas alterações radiológicas nos pacientes que não apresentam papiledema(1). EPIDEMIOLOGIA E FATORES PREDISPONENTES Há uma prevalência de HII em mulheres jovens com sobrepeso (índice de massa corpórea acima de 25), com incidência relatada de 19/100.000 na população. Dentre esses pacientes, 68% a 98% apresentam cefaleia. Outras características clínicas incluem dor, zumbido pulsátil e distúrbios visuais que podem causar cegueira(4). A HII também pode ser desencadeada pelo uso de fármacos e por outras doenças. Nesses casos, deve-se evitar a denominação “idiopática” para a síndrome e considerar que os achados de hipertensão intracraniana são decorrentes dos fatores em questão, os quais merecem ser todos pesquisados nos pacientes com quadro radiológico sugestivo de HII(2). MANIFESTAÇÕES CLÍNICAS Os sintomas da HII incluem cefaleia que piora ao se deitar, diplopia, obscurecimento visual transitório, escotomas, zumbido pulsátil, vertigem e dor retro-orbitária, cervical ou facial. Das manifestações observadas, são comuns a perda da acuidade visual periférica, a paresia do músculo reto lateral pelo comprometimento do nervo abducente e o papiledema bilateral simétrico ou assimétrico. Um em cada dez pacientes com HII desenvolve atrofia do nervo óptico e deficiência visual grave, em razão do curso prolongado de papiledema, e alguns se tornam cegos. A condição, portanto, requer detecção e ação imediata, que pode muitas vezes prevenir a perda da visão(2). Alguns pacientes com HII podem ser assintomáticos ou mesmo apresentar sintomas de hipotensão intracraniana, otoliquorreia ou rinoliquorreia, que são raros, mas sinais sugestivos de HII. Esta condição clínica pode se manifestar quando a pressão intracraniana cronicamente elevada causa extravasamentos do líquido cefalorraquidiano mediante remodelamento da base do crânio, envolvendo principalmente o trabeculado etmoidal e os recessos esfenoidais laterais, com associação de meningoencefaloceles. Tais casos são diagnosticados principalmente quando os sintomas de HII ocorrem após o reparo cirúrgico, levando a um novo aumento da pressão intracraniana, ou quando o líquor extravasa após a cirurgia. DIAGNÓSTICO Os critérios diagnósticos baseiam-se nos sinais e sintomas clínicos, nos achados de RM e na medida da pressão liquórica pela punção lombar. A maioria dos achados radiológicos da HII tem alta especificidade, mas baixa sensibilidade. O achatamento da esclera posterior é, isoladamente, o achado mais específico(5) (Figura 1). Achatamento da esclera posterior associado a sela vazia foram os achados mais prevalentes no estudo de Brodsky et al.(6) (Figura 1). Outros achados de RM são com distensão da bainha liquórica que circunda o nervo óptico, tortuosidade do nervo, protrusão intraocular da cabeça do nervo óptico e achatamento do globo ocular posterior do olho (Figura 2)(5). 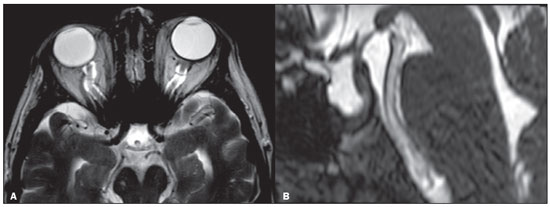 Figura 1. Cortes axial (A) e sagital (B) de RM ponderados em T2 mostram distensão da bainha liquórica dos nervos ópticos e discreta tortuosidade destes, achatamento da esclera posterior e sela turca vazia. 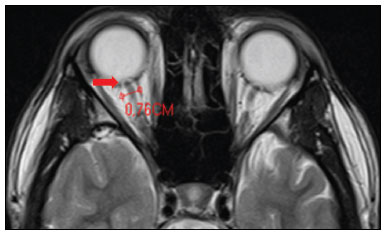 Figura 2. RM axial T2 demonstra aumento do diâmetro da bainha liquórica do nervo óptico (5 mm atrás da papila pode ser considerado o limite superior da normalidade). Nota-se, ainda, protrusão intraocular da cabeça do nervo óptico. Os ventrículos podem apresentar pequenas dimensões em casos de HII(5) (Figura 3). 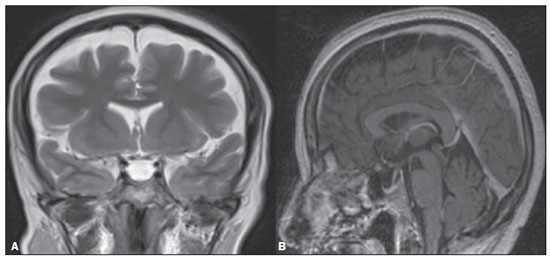 Figura 3. Imagens de RM coronal T2 (A) e sagital T1 após contraste (B) mostram a sela turca parcialmente vazia, com a haste estirada. Há discreta redução nas dimensões do III ventrículo e dos ventrículos laterais. Deslocamento inferior das tonsilas cerebelares, mimetizando quadro de Chiari I (Figura 4), pode ser observado. Inclusive, é importante diferenciar alterações relacionadas ao Chiari I (quando a ectopia tonsilar costuma ser mais acentuada) da HII, tendo em vista que o tratamento de ambas as condições é distinto(7). 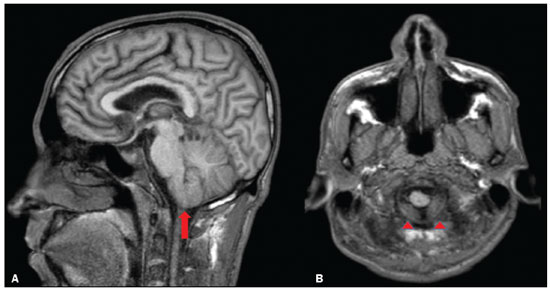 Figura 4. Imagens de RM sagital (A) e axial T1 (B) demonstram discreta insinuação inferior das tonsilas cerebelares pelo forame magno (seta em A; cabeças de setas em B). Na RM também é possível observar alargamento dos cava de Meckel (Figura 5), proeminência de granulações aracnoides e meningocele do ápice petroso. A meningocele é mecanicamente similar à sela vazia e aumenta o volume do espaço subaracnoide, auxiliando no controle do aumento da pressão intracraniana(5). 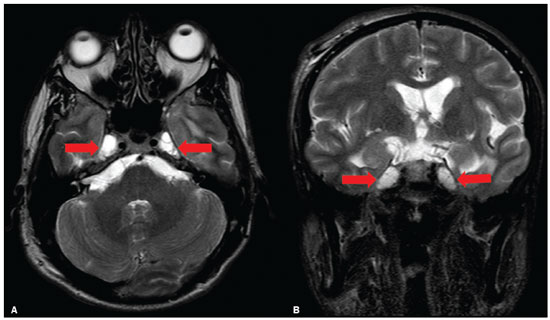 Figura 5. Imagens de RM axial (A) e coronal T2 (B) mostram ectasia dos cava de Meckel (setas), alteração que pode ser observada no contexto da HII. Como achados não associados, observam-se alterações pós-cirúrgicas nos tecidos extracranianos da convexidade frontal direita e alteração de sinal periventricular temporal esquerda, e diminuta sequela isquêmica corticossubcortical na periferia do hemisfério cerebelar direito. A RM, idealmente com ângio-RM venosa, é útil para excluir o diagnóstico de trombose venosa cerebral nos pacientes com os demais achados de HII. Adicionalmente, permite a identificação de estenoses de seio venoso dural (Figura 6) ou permite, ainda, visibilizar a veia emissária occipital proeminente, já descrita como via de colateralização do fluxo venoso em casos de HII secundária a estenose de seio venoso dural(8). 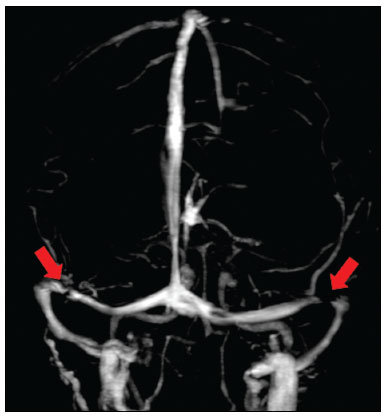 Figura 6. Reconstrução tridimensional de angio-RM venosa com máxima projeção de intensidade identifica estenose bilateral dos seios transversos (setas). Paralisia do nervo craniano VI é observada em 12% dos adultos e em 9% a 48% das crianças. Com menos frequência, paralisias de outros nervos cranianos podem ser encontradas, incluindo dos nervos cranianos III, IV, VII, IX e XII(9). A acetozolamida, inibidor da anidrase carbônica, pode ser usada com objetivo de reduzir a produção do líquido cerebrospinal pelo plexo coroide. Os efeitos esperados do uso dessa medicação são melhora da visão e do papiledema(2). Perda de peso, punção de alívio, uso de topiramato e furosemida, além de fenestração da bainha do nervo óptico em casos refratários, também podem ser utilizados com finalidade terapêutica. Colocação de stents em seios transversos com estenoses também tem sido opção terapêutica proposta em casos selecionados(10), assim como derivação ventricular pode ser estratégia de tratamento. Nesses casos, após a derivação ventricular, é importante que o radiologista esteja habituado a identificar manifestações relacionadas à hipotensão liquórica e suas complicações, pois estas podem ocorrer após o procedimento(11). A HII é uma doença rara, mas seu diagnóstico e tratamento precoces são essenciais para evitar possíveis sequelas irreversíveis, destacando-se que a recorrência do quadro é possível, sobretudo em situações de ganho de peso e gravidez. É fundamental que os casos sejam conduzidos por uma equipe multidisciplinar, composta por neurologistas, oftalmologistas e neurocirurgiões. Além disso, para o diagnóstico, acompanhamento e definição do tratamento são imprescindíveis os estudos oftalmológicos, particularmente a avaliação do fundo de olho e a campimetria visual, e em casos selecionados, a tomografia de coerência óptica, a ultrassonografia ocular, o potencial evocado visual e a autofluorescência(2). CONCLUSÃO A neuroimagem apresenta importante papel na avaliação da HII, condição que necessita de um diagnóstico rápido para que o paciente não tenha sequelas graves, sobretudo a perda de visão. A RM, idealmente com ângio-RM venosa, é útil para excluir o diagnóstico de trombose venosa cerebral nos pacientes com demais achados de HII. REFERÊNCIAS 1. Samancı B, Şahin E, Samancı Y, et al. The contribution of neuroimaging to diagnosis in idiopathic intracranial hypertension. Turk J Neurol. 2019;25:58–62. 2. Toscano S, Lo Fermo S, Reggio E, et al. An update on idiopathic intracranial hypertension in adults: a look at pathophysiology, diagnostic approach and management. J Neurol. 2021;268:3249–68. 3. Yetimler B, Tzartos J, Şengül B, et al. Serum glial fibrillary acidic protein (GFAP)-antibody in idiopathic intracranial hypertension. Int J Neurosci. 2021;131:775–9. 4. Aiken AH, Hoots JA, Saindane AM, et al. Incidence of cerebellar tonsillar ectopia in idiopathic intracranial hypertension: a mimic of the Chiari I malformation. AJNR Am J Neuroradiol. 2012;33:1901–6. 5. Bialer OY, Rueda MP, Bruce BB, et al. Meningoceles in idiopathic intracranial hypertension. AJR Am J Roentgenol. 2014;202:608–13. 6. Brodsky MC, Vaphiades M. Magnetic resonance imaging in pseudotumor cerebri. Ophthalmology. 1998;105:1686–93. 7. Alnemari A, Mansour TR, Gregory S, et al. Chiari I malformation with underlying pseudotumor cerebri: poor symptom relief following posterior decompression surgery. Int J Surg Case Rep. 2017;38:136–41. 8. Hedjoudje A, Piveteau A, Gonzalez-Campo C, et al. The occipital emissary vein: a possible marker for pseudotumor cerebri. AJNR Am J Neuroradiol. 2019;40:973–8. 9. Samara A, Ghazaleh D, Berry B, et al. Idiopathic intracranial hypertension presenting with isolated unilateral facial nerve palsy: a case report. J Med Case Rep. 2019;13:94. 10. Ahmed RM, Wilkinson M, Parker GD, et al. Transverse sinus stenting for idiopathic intracranial hypertension: a review of 52 patients and of model predictions. AJNR Am J Neuroradiol. 2011;32:1408–14. 11. Girão MMV, Sousa RMP, Ribeiro MC, et al. Spontaneous intracranial hypotension and its complications. Arq Neuropsiquiatr. 2018;76:507–11. 1. Departamento de Radiologia, Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil 2. Departamento de Radiologia e Diagnóstico por Imagem, Hospital de Clínicas de Porto Alegre (HCPA), Porto Alegre, RS, Brasil 3. Hôpitaux Universitaires de Genève, Service de Radiologie, Genebra, Suíça Correspondência: Dr. Fabiano Reis Divisão de Neurorradiologia do Hospital de Clinicas da Universidade Estadual de Campinas (Unicamp) Rua Vital Brasil, 251, Cidade Universitária Campinas, SP, Brasil, 13083-872 E-mail: fabianoreis2@gmail.com a. https://orcid.org/0000-0003-2135-0002 b. https://orcid.org/0000-0003-4973-2889 c. https://orcid.org/0000-0002-5741-9203 d. https://orcid.org/0000-0002-6009-8607 e. https://orcid.org/0000-0001-9360-0547 f. https://orcid.org/0000-0003-2256-4379 Recebido para publicação em 7/6/2021 Aceito, após revisão, em 10/9/2021 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554