INTRODUÇÃO
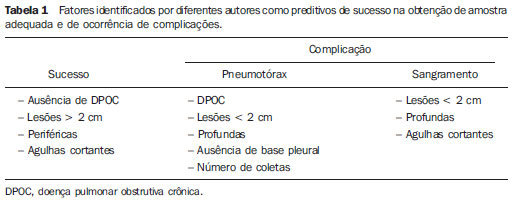
Biópsia percutânea dirigida por tomografia computadorizada tem sido amplamente utilizada como um procedimento efetivo e seguro para obtenção de diagnóstico histológico em muitas situações clínicas e em diversos órgãos(1). No pulmão, a biópsia percutânea através de punção aspirativa por agulha fina (PAAF) ou agulha cortante (BAC) tornou-se uma das principais escolhas para investigação de nódulos e massas. Sua versatilidade permite o acesso de lesões nas diversas localizações do pulmão, podendo ser utilizada para lesões periféricas e profundas mesmo de pequenas dimensões(2) (Figura 1).
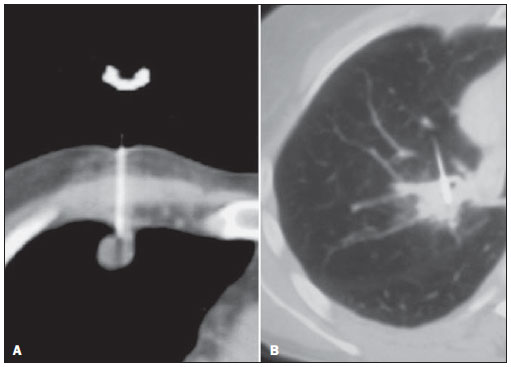
Figura 1. Biópsias percutâneas de nódulos pulmonares dirigidas por tomografia computadorizada. Lesões, agulhas e suas relações têm excelente visualização pela tomografia computadorizada. A: Lesão nodular periférica com base pleural medindo 10 mm. B: Lesão central medindo cerca de 20 mm.
Neste artigo discutiremos as indicações, os aspectos técnicos do procedimento e os índices esperados de sucesso e complicação das biópsias percutâneas de nódulos e massas pulmonares.
DISCUSSÃO
1. Indicações
Biópsias percutâneas de nódulos e massas pulmonares são realizadas em vários contextos clínicos, preferencialmente nas lesões periféricas de difícil acesso à broncoscopia ou nas lesões centrais em pacientes previamente submetidos a broncoscopias não diagnósticas.
Nódulos pulmonares
Nódulos pulmonares podem ser identificados incidentalmente ou em exames de rotina e serem considerados suspeitos para câncer primário do pulmão a partir da história clínica do paciente e de suas características radiológicas. Nestes casos, a biópsia poderá auxiliar na conduta de diversas maneiras. Nas lesões com menor probabilidade para malignidade, a documentação de benignidade através de uma biópsia percutânea poderá poupar o paciente de ser submetido a procedimentos mais invasivos, tais como a toracoscopia ou a toracotomia. Nas lesões altamente sugestivas de malignidade, a biópsia é mais frequentemente utilizada para documentação diagnóstica em pacientes que recusam ou não apresentam condições para tolerar procedimentos mais invasivos.
Nódulos pulmonares identificados em pacientes portadores de neoplasias malignas primárias de outros órgãos podem ser submetidos a biópsia percutânea toda vez que houver a necessidade de documentação de doença metastática, estudo imuno-histoquímico para auxílio de definição terapêutica ou quando houver a possibilidade de o nódulo pulmonar constituir uma segunda neoplasia primária ou secundária(3).
Massas pulmonares
Massas pulmonares com determinadas características radiológicas e em determinados contextos clínicos são fortemente sugestivas de neoplasia primária do pulmão. E, como estas lesões estão frequentemente acompanhadas de sinais inequívocos de doença localmente avançada ou metastática, a biópsia percutânea pode ser realizada para determinar o tipo histológico da neoplasia, a fim de permitir a instituição do tratamento não cirúrgico apropriado.
Ocasionalmente, biópsias percutâneas são solicitadas para definir a natureza de alterações radiológicas suspeitas para recidiva tumoral ou para estabelecer o perfil molecular de uma neoplasia previamente biopsiada, a fim de refinar a indicação de agentes quimioterápicos ou terapias-alvo(3).
2. Aspectos técnicos
Na maioria dos serviços a biópsia percutânea é realizada por radiologistas ou radiologistas intervencionistas. Os pacientes encaminhados para o procedimento estão normalmente sob os cuidados de clínicos ou cirurgiões, que, em algum momento, decidem solicitar uma biópsia percutânea.
Avaliação prévia ao procedimento
Alguns aspectos são importantes na avaliação do paciente candidato a biópsia percutânea e da lesão pulmonar a ser abordada. Idealmente, esta avaliação deverá ser feita em consulta prévia. Nesta ocasião será possível ainda esclarecer o paciente quanto às características e aos riscos inerentes ao procedimento.
Questões clínicas que devem ser avaliadas antes do procedimento incluem: o estado geral do paciente, o nível de consciência, a reserva funcional pulmonar, a coagulação e a capacidade do paciente em atender comandos referentes à respiração e em manter apneia(3,4).
Lesões pulmonares pequenas são difíceis de acessar em pacientes pouco colaborativos ou sob sedação. Nestes casos, a intubação traqueal e a apneia induzida podem ser necessárias a fim de permitir o acesso percutâneo da lesão.
A mais frequente complicação das biópsias pulmonares percutâneas é o pneumotórax. Normalmente, são facilmente controlados, mas pacientes com doença pulmonar obstrutiva crônica (DPOC), pequena reserva pulmonar (VEF
1 < 35%) ou com pulmão único podem ter consequências graves. Uma criteriosa avaliação de custo-benefício deve ser realizada nestes casos e, se realizado o procedimento, todas as condições para pronto controle das complicações devem ser providenciadas.
Níveis adequados de coagulação são necessários para minimizar sangramentos nas biópsias percutâneas e os anticoagulantes devem ser descontinuados. Tipicamente, quatro dias de interrupção de anticoagulantes são necessários, mas é importante estabelecer esta estratégia em conjunto com o médico que conduz a anticoagulação. Um coagulograma deve ser realizado com antecedência de até uma semana para pacientes sem suspeita de coagulopatia, ou com menor antecedência em pacientes submetidos à retirada de medicações anticoagulantes(3,5). Os tempos de protrombina, tromboplastina parcial ativada e a contagem de plaquetas devem ser avaliados antes do procedimento; a contagem de plaquetas abaixo de 100.000/ml e a relação dos tempos de protrombina ou tromboplastina parcial ativada acima de 1,4 do padrão são consideradas contraindicações relativas. Também nesta situação uma análise de custo-benefício deve ser realizada(4,6,7).
Características da lesão, como localização, dimensão e distância da pele, que podem afetar a chance de sucesso, de complicações ou o tempo do procedimento, devem ser incluídas na avaliação de custo-benefício que antecede o procedimento(6).
Deve-se ainda realizar sempre uma verificação criteriosa do contexto clínico e radiológico da indicação e da presença de lesões mais facilmente abordáveis em outros sítios ou por outros métodos diagnósticos menos invasivos.
Procedimento
Consentimento informado deve ser obtido antes do procedimento e os pacientes são orientados a se apresentar em jejum de quatro horas para o uso de anestésicos e, eventualmente, contrastes intravenosos.
As biópsias são realizadas sempre que possível em regime ambulatorial e sem sedação(3,4).
A partir de exames prévios, os pacientes são posicionados em decúbito que permita um acesso mais direto até a lesão. Uma série de imagens é então obtida para planejamento do ponto de entrada, do trajeto e cálculo da distância a ser percorrida pela agulha (Figura 2). Quando possível, trajetos minimizando a passagem da agulha por parênquima pulmonar aerado devem ser escolhidos, para reduzir o risco de pneumotórax(3). Após a assepsia e a anestesia local até a pleura (lidocaína 2%), a agulha é introduzida segundo o planejamento. Esta manobra pode ser acompanhada em tempo real nos equipamentos que possuam a fluoro-CT.
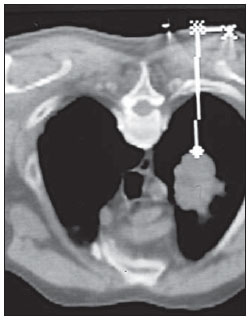
Figura 2. Corte tomográfico identificando marcador metálico fixado à pele do paciente e lesão pulmonar permitindo planejamento do ponto de
entrada e trajeto da agulha por meio de cursores.
Para lesões menores e de acesso mais difícil, a técnica de abordagem coaxial pode ser utilizada. Esta técnica consiste da introdução de uma cânula com uma haste central rígida (mandril) no interior da lesão. O mandril é então removido e a agulha de biópsia é introduzida através da cânula para realizar a coleta do material. Desta forma, múltiplas coletas podem ser realizadas através da cânula(3). Depois de posicionada a agulha, novos cortes tomográficos são obtidos para confirmar sua posição em relação à lesão. O material é então coletado.
Nos casos de PAAFs, agulhas do tipo “Chiba” com calibres de 22 a 25 gauge são utilizadas e a coleta é realizada pela técnica de aspiração, com movimentos de vaivém e pressão negativa. O material obtido pode ser preparado em esfregaços e fixado em álcool ou depositado em meio líquido (Figura 3).
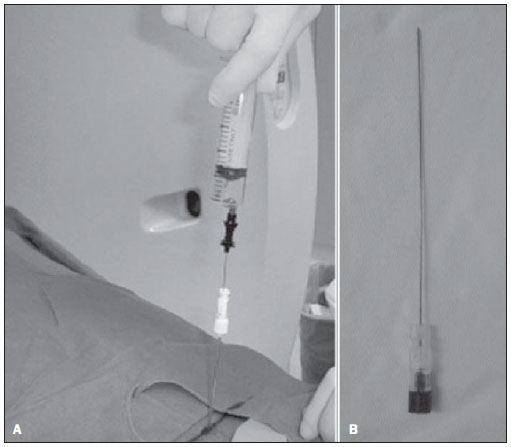
Figura 3. A: Técnica de punção aspirativa com agulha fina utilizando pressão negativa e movimento de vaivém. B: Agulha fina do tipo “Chiba” utilizada nas punções aspirativas com agulha fina.
Nos casos de BACs, agulhas com sistema automático de avanço da extremidade cortante, de 18 a 20 gauge, são utilizadas. Os fragmentos obtidos são normalmente preservados em solução de formol a 10% (Figura 4).
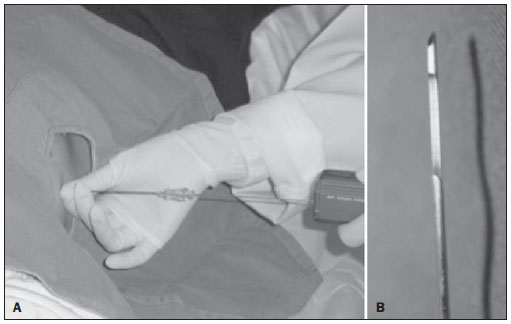
Figura 4. A: Biópsia com agulha cortante (“tru-cut”) acoplada em sistema de disparo automático por meio de mola. B: Detalhe da extremidade da agulha do tipo cortante com janela lateral para coleta do fragmento.
O número de coletas realizadas pode variar para ambos os tipos de agulha. Fatores que irão influenciar este número são: dificuldade do procedimento, ocorrência de complicações, qualidade das amostras e o tipo de análise patológica necessária. Tipicamente, de duas a três amostras são coletadas.
A análise imediata do material por um citopatologista é recomendada por alguns autores quando são utilizadas as agulhas de aspiração. Esta medida visa a aumentar as taxas de sucesso e diminuir o número de amostras coletadas, uma vez que permite a constatação da presença de material adequado desde a primeira punção. Mas, além de requerer a disponibilidade deste profissional, esta análise determina aumento do tempo total do procedimento. Com alguma experiência, um número maior de coletas pode produzir resultados comparáveis, sem aumento dos índices de complicação(8).
Pós-procedimento
Depois de realizado o procedimento, novas imagens são obtidas para avaliar a presença de possíveis complicações, como pneumotórax ou hemorragia. Pacientes sem sinais de complicação são monitorados por uma hora e liberados após a constatação de estabilidade hemodinâmica, respiratória e com radiografia de tórax confirmando ausência de pneumotórax. Complicações tardias são raras e os pacientes devem ser orientados a procurar serviço médico no caso de apresentarem dispneia ou hipotensão(3,4,7).
3. Resultados
Índices de sucesso
A literatura apresenta significativa variação nos índices de acurácia das biópsias percutâneas de lesões pulmonares. Muitos estudos mostram acurácia superior a 90%.
Os índices de sucesso na coleta de material adequado para análise e na obtenção de diagnóstico específico com biópsias percutâneas podem variar com diversos fatores, como as características do paciente, a experiência do serviço, o tipo de agulha utilizado e as características da lesão(2).
Entre os principais fatores apontados como preditivos de maior índice de sucesso na obtenção de diagnóstico através de biópsia percutânea podemos mencionar a ausência de DPOC, maiores dimensões da lesão (> 2 cm), localização periférica e utilização de agulhas cortantes (BAC)(1,2,9).
Seleção da agulha
Um dos fatores mais estudados na análise da acurácia das biópsias percutâneas é a influência do tipo de agulha utilizada. Em geral, agulhas cortantes utilizadas nas BACs apresentam índices superiores de acurácia. Mas, as diferenças de acurácia podem ser mais bem detalhadas.
A maioria dos estudos relata elevada especificidade e confiança nos resultados positivos para malignidade para ambos os tipos de agulha, com raros casos de resultados falso-positivos(1,10,11).
Os resultados falso-negativos são mais frequentes e, para esta ocorrência, os resultados relatados para os diferentes tipos de agulha se distanciam mais.
Agulhas finas de aspiração do tipo “Chiba” utilizadas para coleta de material para análise citológica (PAAF) possuem índice maior de falso-negativos em relação às agulhas do tipo cortante, e a depender da prevalência de malignidade na população estudada, pode chegar a até 50%(1,10–12).
Resultados mais confiáveis de benignidade são obtidos com as agulhas do tipo cortante (“tru-cut”), uma vez que permitem obtenção de material para análise histológica e o resultado falso-negativo é geralmente inferior a 10%(1,10,11,13).
Portanto, resultados positivos para malignidade em lesões altamente suspeitas são confiáveis com ambos os tipos de agulhas; porém, um resultado negativo obtido com agulhas finas (PAAF) deve ser analisado com cautela, e nova coleta, considerada.
Para definição confiável de ausência de malignidade, como no caso de lesões nodulares solitárias de baixa suspeita, ou para definição de diagnóstico específico benigno a utilização das agulhas cortantes deve ser priorizada(13).
Em linhas gerais, são considerados satisfatórios índices de sucesso na obtenção de material apropriado para análises superiores a 85%. Os índices de sensibilidade para malignidade são também geralmente superiores a 85%. E os resultados falso-positivos são extremamente raros e inferiores a 1%.
Na experiência previamente relatada dos autores, os índices de sucesso alcançados na obtenção de amostras adequadas nas punções aspirativas se mantiveram entre 84% e 88% ao longo dos anos, e para agulhas cortantes, entre 95% e 97%(1,2,10,11,14). Resultados histológicos específicos foram também obtidos com maior frequência na utilização de agulhas do tipo cortante(1,2,10,11,14). Alguns fatores associados com maior índice de sucesso na nossa casuística são lesões com dimensões maiores de 40 mm, localizadas nos lobos superiores e suspeitas para malignidade.
Atualmente, em função dos resultados apresentados e da experiência acumulada, realizamos todos os procedimentos com agulhas cortantes de 18 a 20 gauge. Reservamos o uso de agulhas finas para situações em que o paciente apresente alterações na coagulação. E, em condições ideais, realizamos três coletas.
Complicações
É considerável também a variação dos índices de complicações relatados na literatura para biópsias percutâneas de lesões pulmonares(4).
Complicações menores como hemorragia local discreta, dor e reação vaso-vagal não são raras, mas fáceis de serem resolvidas. A complicação moderada mais frequente é o pneumotórax, mas, na maioria das vezes, não requer drenagem torácica. Várias estratégias podem ser adotadas para a condução de pneumotórax identificados durante ou após o procedimento, variando com as condições clínicas do paciente, os sintomas, as dimensões do pneumotórax e as condições de suporte domiciliar do paciente(4,7,15) (Figura 5).
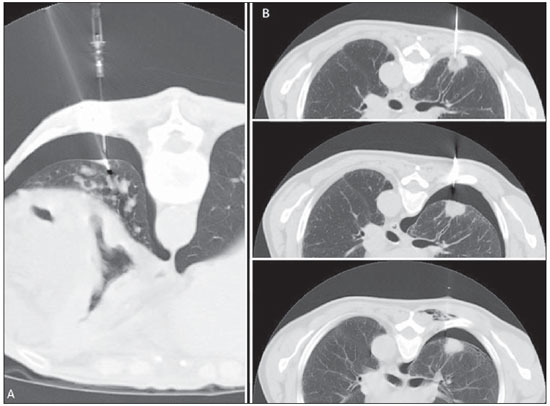
Figura 5. Técnicas de manejo do pneumotórax. A: Corte tomográfico observando simultaneamente o pneumotórax, um dreno de alívio e a agulha de biópsia. O controle de sintomas de um pneumotórax desenvolvido durante o procedimento permite prosseguir com a biópsia. B: Série de imagens realizadas durante a coleta, com o pneumotórax instalado e após a aspiração do pneumotórax através de agulha fina, permitindo muitas vezes evitar a drenagem.
Taxas relatadas de ocorrência de pneumotórax variam de 0% até 61%, com necessidade de drenagem que varia entre 3% e 15%(4).
Fatores como DPOC, lesões sem base pleural, maior profundidade e menores dimensões foram relacionados com risco aumentado de desenvolvimento de pneumotórax(4,14,16).
Historicamente, agulhas do tipo cortante têm sido associadas com maior risco de pneumotórax. Muitos destes dados foram baseados na utilização de agulhas de grosso calibre e sem sistemas automáticos de coleta. Estudos mais recentes têm demonstrado índices de pneumotórax semelhantes aos relatados para agulhas de aspiração (PAAF).
De modo geral, com alguma experiência, os índices de pneumotórax e drenagem devem ficar situados na faixa dos 20% e 5%, respectivamente. Índices mais baixos podem ser esperados para lesões maiores de 2 cm, com base pleural e na ausência de DPOC.
Medidas adotadas após o procedimento para redução da taxa de pneumotórax, como deitar o paciente sobre o ponto de entrada da agulha, a injeção de sangue autólogo no trajeto da agulha e a aspiração de pneumotórax, são adotadas por alguns autores e têm benefício ainda incerto(17).
Complicações hemorrágicas severas são raras e casos ainda mais raros de morte foram relatados. O índice de mortalidade é difícil de se estabelecer, mas foi estimado em estudo multicêntrico como sendo de 0,15%(18).
A Tabela 1 relaciona os fatores identificados como preditivos de sucesso na obtenção de amostra adequada e os fatores identificados como mais frequentemente relacionados às complicações relevantes.
Os médicos que realizam biópsias percutâneas devem ter treinamento para lidar com as complicações, e materiais de ressuscitação e drenagem torácica devem estar facilmente acessíveis.
Em nossa prática, identificamos índices de pneumotórax variando entre 11% e 16%, com a necessidade de drenagem em 2% a 5% dos casos quando utilizamos agulhas finas. No uso de agulhas do tipo cortante estes índices foram ainda inferiores(1,10,14). Apesar de estes dados terem sido obtidos com casuísticas distintas, os índices de complicação para ambos os tipos de agulha têm se mostrado semelhantes, como já sugerido por outros autores(4,6,12,15). Em análise retrospectiva, identificamos unicamente a ausência de base pleural como fator preditivo para a ocorrência de pneumotórax.
Quando identificamos a presença do pneumotórax durante o procedimento, prosseguimos com a coleta sempre que possível e, se necessário, utilizamos a aspiração ou um dreno de alívio para estabilizar o paciente e concluir a coleta (Figura 5).
As condutas pós-procedimento são adaptadas caso a caso. Os pacientes sem sinais de complicação ou com pneumotórax discreto e assintomático são geralmente monitorados por uma hora, sendo então liberados. Pacientes com pneumotórax maior ou sintomático poderão ser submetidos a observação, aspiração ou passagem de dreno torácico.
4. Conclusão
Biópsias percutâneas constituem procedimento indispensável na prática da oncologia torácica. Através deste procedimento, problemas diagnósticos podem ser rapidamente resolvidos nos departamentos de radiologia e patologia, evitando procedimentos mais invasivos na maioria das vezes. O aperfeiçoamento das técnicas de imagem, das agulhas e da experiência dos operadores tornou este procedimento mais versátil, seguro e acurado, expandindo progressivamente as suas indicações.
REFERÊNCIAS
1. Chojniak R, Isberner RK, Viana LM, et al. Computed tomography guided needle biopsy: experience from 1,300 procedures. Sao Paulo Med J. 2006;124:10–4.
2. Guimarães MD, Chojniak R, Gross JL, et al. Predictive success factors for CT-guided fine needle aspiration biopsy of pulmonary lesions. Clinics (Sao Paulo). 2009;64:1139–44.
3. Wu CC, Mather MM, Shepard JA. CT-guided percutaneous needle biopsy of the chest: preprocedural evaluation and technique. AJR Am J Roentgenol. 2011;196:W511–4.
4. Manhire A, Charig M, Clelland C, et al. Guidelines for radiologically guided lung biopsy. Thorax. 2003;58:920–36.
5. Baglin TP, Keeling DM, Watson HG; British Committee for Standards in Haematology. Guidelines on oral anticoagulation (warfarin): third edition – 2005 update. Br J Haematol. 2006;132:277–85.
6. Topal U, Ediz B. Transthoracic needle biopsy: factors effecting risk of pneumothorax. Eur J Radiol. 2003;48:263–7.
7. Aviram G, Schwartz DS, Meirsdorf S, et al. Transthoracic needle biopsy of lung masses: a survey of techniques. Clin Radiol. 2005;60:370–4.
8. Küçük ÇU, Yilmaz A, Yilmaz A, et al. Computed tomography-guided transthoracic fine-needle aspiration in diagnosis of lung cancer: a comparison of single-pass needle and multiple-pass coaxial needle systems and the value of immediate cytological assessment. Respirology. 2004;9:392–6.
9. Laurent F, Latrabe V, Vergier B, et al. CT-guided transthoracic needle biopsy of pulmonary nodules smaller than 20 mm: results with an automated 20-gauge coaxial cutting needle. Clin Radiol. 2000;55:281–7.
10. Yu LS, Deheinzelin D, Younes RN, et al. Computed tomography-guided cutting needle biopsy of pulmonary lesions. Rev Hosp Clin Fac Med Sao Paulo. 2002;57:15–8.
11. Guimaraes MD, de Andrade MQ, da Fonte AC, et al. CT-guided cutting needle biopsy of lung lesions – an effective procedure for adequate material and specific diagnose. Eur J Radiol. 2010 Oct 26. [Epub ahead of print].
12. Anderson JM, Murchison J, Patel D. CT-guided lung biopsy: factors influencing diagnostic yield and complication rate. Clin Radiol. 2003;58:791–7.
13. Gong Y, Sneige N, Guo M, et al. Transthoracic fine-needle aspiration vs concurrent core needle biopsy in diagnosis of intrathoracic lesions: a retrospective comparison of diagnostic accuracy. Am J Clin Pathol. 2006;125:438–44.
14. Guimarães MD, Andrade MQ, Fonte AC, et al. Predictive complication factors for CT-guided fine needle aspiration biopsy of pulmonary lesions. Clinics (Sao Paulo). 2010;65:847–50.
15. Gohari A, Haramati LB. Complications of CT scan-guided lung biopsy: lesion size and depth matter. Chest. 2004;126:666–8.
16. Yeow KM, Su IH, Pan KT, et al. Risk factors of pneumothorax and bleeding: multivariate analysis of 660 CT-guided coaxial cutting needle lung biopsies. Chest. 2004;126:748–54.
17. Collings CL, Westcott JL, Banson NL, et al. Pneumothorax and dependent versus nondependent patient position after needle biopsy of the lung. Radiology. 1999;210:59–64.
18. Tomiyama N, Yasuhara Y, Nakajima Y, et al. CT-guided needle biopsy of lung lesions: a survey of severe complication based on 9783 biopsies in Japan. Eur J Radiol. 2006;59:60–4.
1. Doutor, Médico Radiologista, Diretor do Departamento de Imagem do Hospital A. C. Camargo, São Paulo, SP, Brasil.
2. Mestres, Médicos Radiologistas do Departamento de Imagem do Hospital A. C. Camargo, São Paulo, SP, Brasil.
3. Doutora, Médica Radiologista do Departamento de Imagem do Hospital A. C. Camargo, São Paulo, SP, Brasil.
4. Doutorando, Médico Radiologista Pós-graduando do Hospital A. C. Camargo, São Paulo, SP, Brasil.
Endereço para correspondência:
Dr. Rubens Chojniak. Hospital
A. C. Camargo
Rua Professor Antônio Prudente, 211, Liberdade
São Paulo, SP, Brasil, 01509-010.
E-mail: chojniak@uol.com.br
Recebido para publicação em 28/3/2011.
Aceito, após revisão, em 24/5/2011.
Trabalho realizado no Hospital A. C. Camargo, São Paulo, SP, Brasil.
 Vol. 44 nº 5 - Set. / Out. of 2011
Vol. 44 nº 5 - Set. / Out. of 2011