Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 44 nº 2 - Mar. / Abr. of 2011
Vol. 44 nº 2 - Mar. / Abr. of 2011
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Marcos Duarte Guimarães1; Alexandre Calábria da Fonte2; Marcony Queiroz de Andrade3; Rubens Chojniak4; Jefferson Luiz Gross5 |
|
|
Descritores: Agulha; Biópsia; Pulmão; Câncer; Tomografia computadorizada. |
|
|
Resumo: INTRODUÇÃO
As biópsias percutâneas de lesões pulmonares são realizadas há mais de um século( 1). O desenvolvimento dos métodos de imagem, sobretudo da tomografia computadorizada (TC), contribuiu para a localização mais precisa das lesões pulmonares. Da mesma forma, o advento e aprimoramento das agulhas específicas contribuíram para que este procedimento fosse conhecido universalmente e realizado em larga escala. Tornou-se uma alternativa viável a outros procedimentos diagnósticos, como citologia do catarro, broncoscopia e toracotomia, com altas taxas de coleta do material adequado para análise(2,3). Contudo, considerando-se as lesões benignas, a exatidão desse método, em geral, é inferior à das lesões malignas, e considerando-se a dificuldade de manter um médico patologista no departamento de radiologia, detectou- se a necessidade de realizar biópsias que pudessem fornecer material adequado para a análise e diagnóstico específico(4). A biópsia de lesões pulmonares com agulha grossa guiada por TC foi amplamente aceita como procedimento efetivo e seguro para diagnóstico específico(5,6). Este procedimento obtém fragmentos de tecido para análise histológica, que determina a natureza específica das lesões pulmonares. É uma técnica simples para orientar decisões terapêuticas, que evita biópsias cirúrgicas em muitos quadros clínicos e demonstra ser alternativa viável à punção aspirativa com agulha fina (PAAF)(7,8). A finalidade do presente estudo é apresentar a experiência de um centro oncológico com o procedimento de biópsias de lesões pulmonares com agulha grossa guiadas por TC na obtenção de material adequado para análise e fornecimento de diagnóstico específico quando possível. MATERIAIS E MÉTODOS Este estudo relata uma análise retrospectiva de 94 pacientes admitidos em um centro oncológico referência no Brasil (Hospital do Câncer – A.C. Camargo), entre 1996 e 2004, e que foram submetidos a 97 biópsias de lesões pulmonares com agulha grossa guiadas por TC. Neste período foram realizados 459 procedimentos percutâneos pulmonares guiados por TC, distribuídos em 362 (78,9%) PAAFs e 97 (21,1%) biópsias por agulha grossa. As informações sobre a adequação do material e o diagnóstico específico foram coletadas dos prontuários do Serviço de Arquivo Médico do hospital. Termo de consentimento livre e esclarecido por escrito e assinado foi obtido de todos os pacientes. As biópsias foram realizadas e orientadas por TC axial (Pace Plus e Pro Speed; General Electric Medical Systems, Milwuakee, WI, EUA), utilizando-se técnica padrão. Todos os pacientes foram submetidos a aquisição panorâmica (scout), com cortes variando de 5 a 10 mm, para adequada localização da lesão e comparação com exames anteriores. A agulha foi introduzida com o paciente em apneia expiratória, e novas varreduras por TC foram obtidas para verificar a exata posição da agulha em relação à lesão. O sistema coaxial automático de calibre 18 (agulha e cânula introdutória Temno Biopsy) foi utilizado em 52 biópsias. Após o posicionamento da cânula introdutora com estilete, o sistema foi colocado na margem da lesão e o local foi confirmado com varreduras de TC. O estilete introdutor foi removido da cânula e a agulha foi inserida e disparada, avançando 20 mm com a borda cortante. Agulha de calibre 20 (MD Tech Tru-Core) foi usada em 45 biópsias. A pistola automática foi então conectada e disparada para que a ponta cortante da agulha avançasse 15 ou 20 mm, dependendo do tamanho da lesão. O local da biópsia pôde ser visualizado pelo controle com TC. O cursor do computador foi usado para medir as dimensões das lesões em suas distâncias até o marcador metálico posicionado na superfície da pele. O local exato de introdução da agulha na pele foi obtido por meio de uma marcação superficial com caneta cirúrgica, correlacionando o marcador metálico e o feixe de raio laser que incide sobre o paciente com os cortes tomográficos axiais da lesão e a experiência do médico executante. Estas informações permitiram o cálculo do ponto de introdução da agulha na pele, a inclinação necessária da agulha e da trajetória, e a profundidade que se deveria percorrer para atingir a lesão. Após a marcação, foi aplicado anestésico local com lidocaína a 1% e introduzida a agulha. Realizou-se varredura de controle com a TC para confirmar ou alterar o posicionamento da agulha em relação à lesão (Figuras 1 a 7). Em ambos os casos, o procedimento foi repetido até que as amostras fossem macroscopicamente apropriadas ou que houvesse pneumotórax. 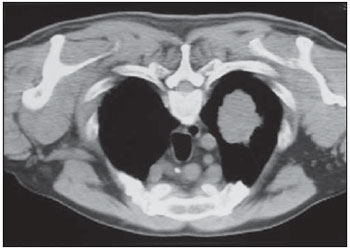 Figura 1. Paciente posicionado na mesa do tomógrafo de acordo com a localização da lesão. Neste caso, por se tratar de lesão do segmento posterior do lobo superior direito, a posição mais adequada para abordagem foi o decúbito ventral.  Figura 2. É colocado um marcador metálico na superfície cutânea, fixado com micropore, para definição do local de introdução da agulha em um plano paralelo e mais próximo à lesão, sempre que possível. Utiliza-se uma régua milimetrada para comparação da medida realizada no local da punção com a medida realizada na tela do computador. 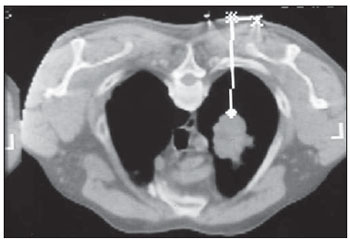 Figura 3. Após a confirmação da trajetória e da distância medida na tela do computador ser semelhante a trajetória e distância medida na superfície da pele, é realizada a mensuração da profundidade necessária para a agulha percorrer até atingir a lesão para coleta do material. 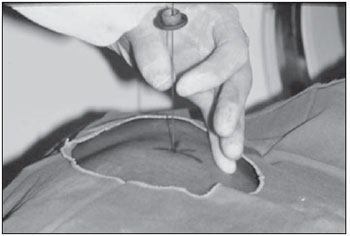 Figura 4. Após a assepsia, é realizada a anestesia local e dos planos profundos da parede torácica. Procede-se a introdução da agulha de biópsia exatamente no local selecionado na superfície cutânea, obedecendo a trajetória e distância determinadas pela análise realizada no computador. 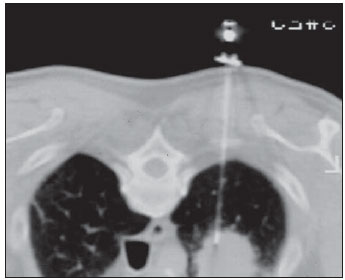 Figura 5. Uma vez confirmado o posicionamento adequado da agulha no interior da lesão, é realizada a coleta do material. 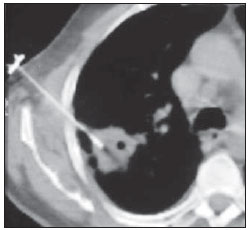 Figura 6. Um exemplo de lesão pulmonar localizada no segmento posterior do lobo superior direito. Foi decidido pelo posicionamento do paciente em decúbito dorsal. O local mais próximo da lesão escolhido para a introdução da agulha foi na linha axilar anterior, evitando a escápula, obedecendo a uma trajetória diagonal e posterior para poder atingir o centro da lesão. 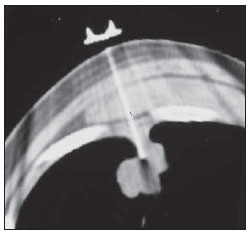 Figura 7. Um exemplo de lesão pulmonar lateral sendo abordada por uma trajetória com a menor distância possível entre a superfície cutânea e a lesão, com o paciente posicionado em decúbito lateral. Os fragmentos coletados foram preservados em formalina a 10% e submetidos a exame histológico. Em nosso estudo, a maioria dos diagnósticos específicos foi confirmada pela associação do resultado da análise histológica do fragmento obtido pela biópsia percutânea juntamente com o seguimento clínico do paciente em nossa instituição. No seguimento clínico das lesões malignas foi considerado o diagnóstico da biópsia pulmonar dentro do contexto relacionado à história natural da doença de base, critérios de resposta terapêutica dentro do esperado e progressão da doença a despeito do tratamento instituído. No seguimento clínico das lesões benignas foi considerada a regressão das lesões após tratamento específico ou estabilidade radiológica por pelo menos dois anos de seguimento. Quando ocorreram divergências entre o resultado da biópsia e a suspeita clínica, os pacientes foram encaminhados para ressecção cirúrgica da lesão. Estatísticas descritivas foram utilizadas para descrever a casuística. RESULTADOS Do total das 97 biópsias pulmonares com agulha grossa, 94 (96,9%) forneceram material adequado para análise histológica, divididas em 71 (73,2%) lesões malignas e 23 (23,7%) lesões benignas. Três (3,1%) biópsias não forneceram material adequado para análise. A frequência de diagnóstico específico foi de 83 (85,6%) casos, demonstrando elevadas taxas, tanto nas lesões malignas, com 63 (88,7%) casos, como nas lesões benignas, com 20 (86,7%) casos. Do total de 97 biópsias percutâneas, em 83 (85,6%) foi possível a confirmação dos diagnósticos específicos, incluindo 78 (80,4%) confirmados pela análise histológica dos fragmentos acrescidos do seguimento clínico e 5 (5,2%) confirmados pela ressecção cirúrgica da lesão. Em 11 (11,3%) biópsias não foi possível a confirmação do diagnóstico específico porque os pacientes não estavam mais sendo acompanhados em nossa instituição. Em 3 (3,1%) casos o material foi inadequado para análise, ou seja, não foi possível chegar a um diagnóstico. No grupo de lesões malignas havia 44 (61,2%) lesões broncogênicas, 23 (32,4%) lesões metastáticas e 4 (6,4%) lesões malignas inespecíficas. Em relação ao total de 23 lesões metastáticas, foram encontrados 21 (91,3%) diagnósticos específicos, distribuídos em 14 (60,9%) carcinomas, 4 (17,4%) sarcomas e 3 (13%) linfomas. Em 2 (8,7%) casos o material fornecido foi adequado para diagnóstico malignidade, porém insuficiente para o estabelecimento de um diagnóstico específico. Do total de 44 biópsias que forneceram diagnósticos de carcinomas broncogênicos, 38 (86,4%) corresponderam a carcinomas de células não pequenas, distribuídos em 24 (54,5%) adenocarcinomas e 14 (31,9%) carcinomas epidermoides. Em 2 (4,5%) casos o diagnóstico específico foi de carcinoma de células pequenas e em 4 (10,5%) casos não foi possível especificar o tipo de carcinoma broncogênico. Do total de 23 biópsias de lesões benignas, em 20 (86,7%) foi possível a confirmação do diagnóstico específico, incluindo 15 (65,2%) diagnósticos específicos confirmados pela análise histológica dos fragmentos acrescidos do seguimento clínico e 5 (21,7%) diagnósticos específicos confirmados pela ressecção cirúrgica da lesão. Em 3 (13,3%) biópsias não foi possível a confirmação do diagnóstico específico porque os pacientes não estavam mais sendo seguidos em nossa instituição e as amostras coletadas pelas biópsias foram consideradas negativas para doença maligna de acordo com a análise histológica, conforme demonstrado na Tabela 1. 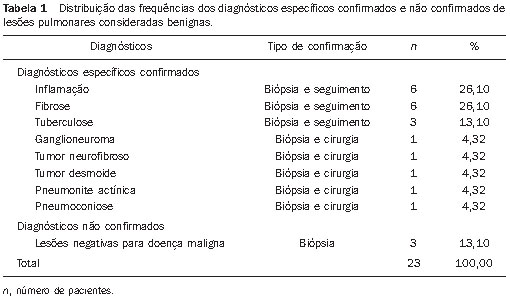 Do total das 97 biópsias com agulha grossa, ocorreram 12 (12,4%) casos de complicações, divididos em 7 (7,2%) casos de hematoma, 3 (3,1%) casos de pneumotórax e 2 (2,1%) casos de hemoptise. Apesar da ocorrência das complicações, não houve necessidade de colocação de dreno torácico ou de internação hospitalar (Figura 8). 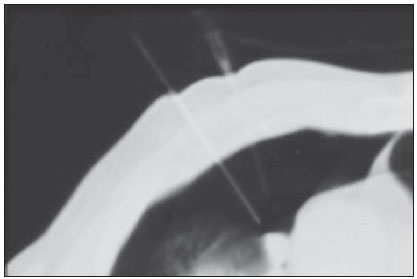 Figura 8. Após a coleta do material, é realizado controle tomográfico para verificação da ocorrência de complicações. Uma das mais frequentes e temidas é o pneumotórax. Nota-se o nódulo localizado profundamente e a extremidade da agulha distando cerca de 0,5 cm do nódulo. Neste caso foi introduzido um cateter (jelco nº 14) de alívio no interior do espaço pleural preenchido por material aéreo (pneumotórax). O pneumotórax foi controlado e o procedimento foi concluído normalmente. Não foi necessária a realização de drenagem torácica e o paciente teve alta ambulatorial quatro horas após o procedimento. DISCUSSÃO A biópsia percutânea com agulha grossa de lesões pulmonares guiada por TC é um método relativamente seguro de diagnosticar lesões benignas e malignas(5,6,8–10). Nas últimas décadas as técnicas foram aprimoradas e diversos estudos evidenciaram vantagens com este procedimento, demonstrando aceitável incidência de complicações e ótimos resultados diagnósticos quando comparado com a PAAF(1,5,6,8,11,12). Em condições ideais, todo procedimento percutâneo guiado por método de imagem deveria ser acompanhado por um patologista para análise imediata do material coletado, definindo a qualidade e o diagnóstico específico quando possível. Isto certamente contribuiria para reduzir o número de punções realizadas, potencializaria os resultados e, consequentemente, reduziria a morbidade relacionada ao procedimento. No entanto, por questões logísticas, incluindo espaço na sala de TC, rotina do departamento de anatomia patológica, disponibilidade do patologista de acordo com a rotina do departamento de imagem e questões de custos, poucos serviços conseguem dispor de uma estrutura que atenda a estas condições, e frequentemente os procedimentos percutâneos são realizados sem a presença deste profissional. Na ausência de um patologista, a obtenção de fragmento tecidual de uma lesão pulmonar por meio de biópsia com agulha grossa permite o fornecimento de material adequado para análise capaz de definir um diagnóstico específico, tanto para lesões benignas como malignas, sendo possível até mesmo determinar o tipo celular nos pacientes com diagnóstico de carcinoma(9,13–15). O índice de sucesso relatado na literatura na obtenção de amostras adequadas em PAAF de lesões pulmonares varia de 64,6% a 96,6%(3,16–18). Mais recentemente, estudos demonstraram maiores garantias da segurança e melhor desempenho diagnóstico obtidos por sistemas automáticos de biópsias com agulha grossa, de modo que a utilização deste procedimento vem ganhando espaço, especialmente quando se deseja um diagnóstico específico de doença benigna ou maligna(7,9,11–14). Contudo, a PAAF ainda tem sua relevância devido a alguns fatores. Dentre eles, enumeramos a menor complexidade na sua execução, podendo ser realizada com maior rapidez, notadamente em pacientes enfermos, com defeitos de coagulação ou que apresentam dificuldades para manutenção do decúbito e apneia durante o procedimento. Alguns estudos demonstram elevados índices de diagnóstico da PAAF, sobretudo quando se considera apenas a necessidade de documentação da doença maligna, dispensando a necessidade de um diagnóstico específico para tomada de decisão e conduta terapêutica( 1,3,4,16–18). Klein et al.(9) demonstraram acurácia global de 88%, com 95% de sensibilidade e 91% de especificidade para o diagnóstico de malignidade por meio de biópsias com agulha grossa. Lucidarme et al.(14) demonstraram acurácia diagnóstica global de 88% com o emprego destas agulhas para o diagnóstico de lesões benignas e malignas. Laurent et al.(19), comparando PAAF com biópsias com agulha grossa guiadas por TC no diagnóstico de malignidade de lesões pulmonares, encontraram sensibilidade de 88% e 97,4%, respectivamente, demonstrando uma diferença estatisticamente significativa. Yu et al.(5) demonstraram que as agulhas grossas, com ou sem sistema coaxial, proporcionaram material adequado (98,1%) para análise histológica e diagnóstico específico, com exatidão de 97,2%, sensibilidade de 96,8% e especificidade de 100% na identificação de lesões malignas. Chojniak et al.(6) demonstraram que, para as lesões pulmonares, as taxas de material adequado e de diagnóstico específico sempre foram melhores com a biópsia com agulha grossa do que com a PAAF. Excetuando-se as três lesões biopsiadas e que não forneceram material adequado para análise, o presente estudo demonstrou elevados índices de material adequado, com 96,9% do total analisado, e elevados índices de diagnósticos específicos, tanto das lesões benignas como das lesões malignas, com 86,9% e 88,7%, respectivamente, resultados estes similares a outros resultados descritos na literatura(11,15). Chojniak et al.(6) e Guimarães et al.(18) demonstraram taxa de complicação em 16% e 11,1% e de drenagem torácica em 4,9% e 3,0%, respectivamente, dos pacientes submetidos a PAAF guiada por TC de lesões pulmonares. Khan et al.(20), estudando fatores preditivos de complicações em biópsias com agulha grossa, demonstraram taxa de 17% de pneumotórax e de 2% de drenagem torácica. Carazzai et al.(21), analisando PAAF e biópsia com agulha grossa de lesões pulmonares guiadas por TC, encontraram uma taxa global de complicações de 28,6%, com 6,0% de hematoma sem maiores implicações e 22,6% de pneumotórax, sendo que dois deles foram submetidos a aspiração com jelco nº 14 no segundo espaço intercostal na linha hemiclavicular, sem necessidade de drenagem torácica posteriormente. Em nosso estudo foram avaliadas apenas as biópsias com agulha grossa. A taxa total de complicações foi de 12,4%, sendo 7,2% de hematoma, 2,1% de hemoptise e 3,1% relacionadas a pneumotórax, sem necessidade de drenagem torácica ou internação hospitalar, o que pode ser considerada taxa reduzida quando comparada com taxas encontradas na literatura(4,9,13,14,20–22). O Departamento de Radiologia do Hospital A.C. Camargo vem realizando, rotineiramente, procedimentos percutâneos transtorácicos guiados por TC, tornando-se um serviço de referência nos últimos dez anos(3,5,6,18,23,24). O alto desempenho da biópsia com agulha grossa pode ser parcialmente explicado pela seleção de diferentes tipos e tamanhos de agulha, de acordo com as características das lesões. No pulmão, existe uma premissa no que diz respeito ao uso de agulhas finas em lesões menores, mais profundas e provavelmente malignas, e ao uso de agulhas grossas em lesões maiores e superficiais e com dúvidas existentes em relação à sua natureza benigna. Talvez a experiência adquirida com estes procedimentos nos últimos anos tenha contribuído para minimizar a ocorrência de complicações nesta casuística. No entanto, em razão da natureza retrospectiva deste estudo, existem limitações que devem ser consideradas, sobretudo quanto à possibilidade de ocorrência de viés de seleção e à possibilidade de que as taxas de complicações tenham sido subestimadas. Com base neste estudo, nos relatos da literatura e na experiência adquirida com esse procedimento por mais de 15 anos no Departamento de Imagem do Hospital A.C. Camargo, atualmente utilizamos as agulhas grossas para a maioria das biópsias pulmonares, reservando as agulhas finas para os pacientes acentuadamente enfermos, com defeitos de coagulação, não colaborativos ou que possuam apenas a necessidade de confirmação de doença maligna para tomada de decisão e conduta terapêutica. CONCLUSÃO A biópsia percutânea com agulha grossa de lesões pulmonares guiada por TC demonstrou elevadas taxas de material adequado e diagnóstico específico e reduzidas taxas de complicações no presente estudo. REFERÊNCIAS 1. Zavala DC, Schoell JE. Ultrathin needle aspiration of the lung in infectious and malignant disease. Am Rev Respir Dis. 1981;123:125–31. 2. Junqueira MAF, Camara-Lopes LH, Albertotti C, et al. Biópsia pulmonar transtorácica orientada por tomografia computadorizada. J Pneumol. 1990;16:1–5. 3. Guimarães MD, Chojniak R, Gross JL, et al. Predictive success factors for CT-guided fine needle aspiration biopsy of pulmonary lesions. Clinics. 2009;64:1139–44. 4. Küçük CU, Yilmaz A, Yilmaz A, et al. Computed tomography-guided transthoracic fine-needle aspiration in diagnosis of lung cancer: a comparison of single-pass needle and multiple-pass coaxial needle systems and the value of immediate cytological assessment. Respirology. 2004;9: 392–6. 5. Yu LS, Deheinzelin D, Younes RN, et al. Computed tomography-guided cutting needle biopsy of pulmonary lesions. Rev Hosp Clin Fac Med Sao Paulo. 2002;57:15–8. 6. Chojniak R, Isberner RK, Viana LM, et al. Computed tomography guided needle biopsy: experience from 1,300 procedures. Sao Paulo Med J. 2006;124:10–4. 7. Moulton JS, Moore PT. Coaxial percutaneous biopsy technique with automated biopsy devices: value in improving accuracy and negative predictive value. Radiology. 1993;186:515–22. 8. Haaga JR, Alfidi RJ, Zelch MG, et al. Computed tomography of the pancreas. Radiology. 1976; 120:589–95. 9. Klein JS, Salomon G, Stewart EA. Transthoracic needle biopsy with a coaxially placed 20-gauge automated cutting needle: results in 122 patients. Radiology 1996;198:715–20. 10. Westcott JL, Rao N, Colley DP. Transthoracic needle biopsy of small pulmonary nodules. Radiology. 1997;202:97–103. 11. Boiselle PM, Shepard JAO, Mark EJ, et al. Routine addition of an automated biopsy device to fine needle aspiration of the lung: a prospective assessment. AJR Am J Roentgenol. 1997;169:661–6. 12. Arakawa H, Nakajima Y, Kurihara Y, et al. CTguided transthoracic needle biopsy: a comparison between automated biopsy gun and fine needle aspiration. Clin Radiol. 1996;51:503–6. 13. Haramati LB. CT-guided automated needle biopsy of the chest. AJR Am J Roentgenol. 1995; 165:53–5. 14. Lucidarme O, Howarth N, Finet JF, et al. Intrapulmonary lesions: percutaneous automated biopsy with a detachable,18-gauge, coaxial cutting needle. Radiology. 1998;207:759–65. 15. Horrigan TP, Bergin KT, Snow N. Correlation between needle biopsy of lung tumors and histopathologic analysis of resected specimens. Chest. 1986;90:638–40. 16. Shimizu K, Ikeda N, Tsuboi M, et al. Percutaneous CT-guided fine needle aspiration for lung cancer smaller than 2 cm and revealed by ground-glass opacity at CT. Lung Cancer. 2006;51:173–9. 17. Stanley JH, Fish GD, Andriole JG, et al. Lung lesions: cytologic diagnosis by fine-needle biopsy. Radiology. 1987;162:389–91. 18. Guimarães MD, Andrade MQ, Fonte AC, et al. Predictive complication factors for CT-guided fine needle aspiration biopsy of pulmonary lesions. Clinics. 2010;65:847–50. 19. Laurent F, Latrabe V, Vergier B, et al. Percutaneous CT-guided biopsy of the lung: comparison between aspiration and automated cutting needles using a coaxial technique. Cardiovasc Intervent Radiol. 2000;23:266–72. 20. Khan MF, Straub R, Moghaddam SR, et al. Variables affecting the risk of pneumothorax and intrapulmonal hemorrhage in CT-guided transthoracic biopsy. Eur Radiol. 2008;18:1356–63. 21. Carazzai EH, Andreosi M, Gonzalez FM, et al. Biópsia pulmonary percutânea guiada por tomografia computadorizada: dados de um hospital. Radiol Bras. 2006;39:277–82. 22. Yeow KM, See LC, Lui KW, et al. Risk factors for pneumothorax and bleeding after CT-guided percutaneous coaxial cutting needle biopsy of lung lesions. J Vasc Interv Radiol. 2001;12:1305– 12. 23. de Farias AP, Deheinzelin D, Younes RN, et al. Computed tomography-guided biopsy of mediastinal lesions: fine versus cutting needles. Rev Hosp Clin Fac Med Sao Paulo. 2003;58:69–74. 24. Guimaraes MD, de Andrade MQ, da Fonte AC, et al. CT-guided cutting needle biopsy of lung lesions – an effective procedure for adequate material and specific diagnose. Eur J Radiol. 2010; 26. [Epub ahead of print]. 1. Doutorando em Ciências, Preceptor das Residências Médicas em Radiologia e Diagnóstico por Imagem dos Hospitais A.C. Camargo e Heliópolis, São Paulo, SP, Brasil. 2. Mestre, Médico Radiologista Assistente do Hospital A.C. Camargo, São Paulo, SP, Brasil. 3. Médico Radiologista do Hospital Aliança, Salvador, BA, Brasil. 4. Doutor, Diretor do Departamento de Radiologia e Diagnóstico por Imagem do Hospital A.C. Camargo, São Paulo, SP, Brasil. 5. Doutor, Diretor do Departamento de Cirurgia do Tórax do Hospital A.C. Camargo, São Paulo, SP, Brasil. Endereço para correspondência: Dr. Marcos Duarte Guimarães Hospital A.C. Camargo – Departamento de Radiologia e Diagnóstico por Imagem Rua Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 01509-010 E-mail: marcosduarte500@ yahoo.com.br Recebido para publicação em 18/9/2010. Aceito, após revisão, em 31/3/2011. Trabalho realizado no Hospital A.C. Camargo – Fundação Antônio Prudente, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554