Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 36 nº 6 - Nov. / Dez. of 2003
Vol. 36 nº 6 - Nov. / Dez. of 2003
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Ernesto Lima Araújo Melo, Marcio Ricardo Taveira Garcia, Rodrigo Yacubian Fernandes, Nélio Garcia de Barros, Giovanni Guido Cerri, Claudia da Costa Leite |
|
|
Descritores: Plexo coróide, Tumores, Lesões expansivas |
|
|
Resumo: IIIProfessor Titular do Departamento de Radiologia da FMUSP
INTRODUÇÃO O plexo coróide (do lat. plexu, enlaçamento, e do gr. choroeidés, membrana delicada), doravante denominado PC, é uma estrutura resultante da invaginação do teto do epêndima para a cavidade ventricular. É recoberto por epitélio cubóide ou colunar simples, perfazendo uma área total estimada em 39,2 cm². Em situações normais, os PC dos ventrículos laterais são geralmente simétricos em forma e tamanho, e é aí onde se dá a principal produção do líquido cefalorraquiano (LCR). Num adulto, ocorre produção de cerca de 0,35 ml/min, ou seja, 500 ml/dia, de forma que todo o volume de LCR é trocado em torno de três a quatro vezes por dia. Ao contrário da maioria das áreas do encéfalo, onde há uma barreira hemato-encefálica, seus capilares são fenestrados. A ausência da barreira hemato-encefálica nos plexos os torna alvos de doenças sistêmicas. Alvo, rota, seletividade e reação cruzada são palavras-chave para enfatizar a importância da fisiologia do PC nas diversas doenças que o acometem(1,2). As lesões tumorais do PC são raras, representando, entre os tumores intracranianos, cerca de 0,4% a 0,6% dos casos em todas as idades e de 1,0% a 4,0% dos casos até os 15 anos de idade(3). Elas ocorrem predominantemente na primeira década de vida (38%), especialmente nos primeiros dois anos, sendo descritos de 12,5% a 20% dos casos em pacientes com menos de um ano de idade(4). Em um estudo realizado por Reed et al.(5), analisando 44 casos de tumores cerebrais nos dois primeiros anos de vida, um terço das lesões supratentoriais representou tumores do PC, sendo estes os tumores mais freqüentes nesse compartimento. Dentre eles, o mais comum é o papiloma do plexo coróide (PPC), seguido pelo carcinoma do plexo coróide (CPC). O CPC representa de 1% a 3% dos tumores malignos em crianças(3). Os sintomas e sinais são inespecíficos e vão depender da localização da lesão. Nas crianças, os achados clínicos mais freqüentes são: aumento do perímetro encefálico, retardo do desenvolvimento neuropsicomotor, vômitos, letargia, irritabilidade, distúrbios motores/sensoriais, convulsões, alargamento das suturas cranianas e papiledema. Podem estar presentes o sinal de MacEwen (nota mais ressonante à percussão do crânio no hidrocéfalo, que lembra o som de pote quebrado e indica alargamento de suturas cranianas), o olhar em "sol poente" e o sinal de Parinaud. Quando localizados nos ventrículos laterais e terceiro ventrículo, manifestam-se com quadro clássico de hipertensão intracraniana (HIC), com cefaléia, vômitos e papiledema nas crianças acima de dois anos e macrocrania nas crianças com menos de dois anos. Quando acometem o quarto ventrículo, sinais cerebelares, geralmente ataxia de marcha ou astasia, associam-se ao quadro de HIC. A capacidade de expansão da calvária e de adaptação funcional nas crianças permite que esses tumores alcancem grandes dimensões antes do diagnóstico. Essas grandes dimensões, especialmente em pacientes no período neonatal, sugerem que muitas dessas lesões sejam congênitas. Alguns autores questionam se o PPC não seria parte integrante da síndrome de Aicardi (criança do sexo feminino, retardo do desenvolvimento neuropsicomotor, convulsões tipo espasmo em flexão, coriorretinite lacunar e agenesia do corpo caloso)(3,4). O diagnóstico é feito por métodos de imagem, como a tomografia computadorizada (TC) e a ressonância magnética (RM). Geralmente, o estudo pela TC é suficiente para confirmar o diagnóstico, mostrando o grau de hidrocefalia, a localização tumoral, se está confinado à cavidade ventricular ou se invade o parênquima cerebral, além de possíveis disseminações no sistema nervoso central (SNC)(3). No entanto, a RM, pela possibilidade de aquisição multiplanar de imagens de alta resolução, oferece vantagem adicional na visualização da lesão. Isto facilita o estudo da anatomia ventricular, a programação cirúrgica e a avaliação pós-operatória(4). O PC é isoatenuante à substância cinzenta à TC e isointenso à RM em T1 pré-contraste em situações normais. Em T2 e em densidade de prótons, o sinal é intermediário. Quando calcificado, apresenta áreas hiperatenuantes à TC e hipointensas à RM nas imagens pesadas em T2. Após a administração do contraste venoso, observa-se realce homogêneo tanto à TC quanto à RM. A ausência de qualquer barreira hemato-encefálica e a permeabilidade característica do epitélio do PC explicam a difusão do contraste para o espaço extracelular, resultando em realce. Normalmente, não há realce no LCR.
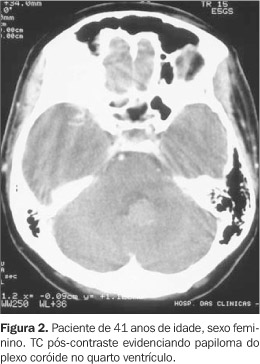
LESÕES TUMORAIS Os dois tumores primários mais freqüentes do PC são o PPC e o CPC. Outros tumores, tais como metástases, linfoma, meningioma, ependimoma e sarcoma granulocítico (cloroma), também podem acometer esta estrutura. Muito importante no diagnóstico diferencial são a idade e o sexo do paciente, a localização da massa e a presença ou não de doença de base(1). Os PPC (Figuras 1 e 2) são as massas do PC mais comuns em crianças, principalmente antes dos cinco anos de idade, preferencialmente nos ventrículos laterais (45% a 85% dos casos), usualmente envolvendo o átrio e o trígono, com preferência pelo glomo. A segunda localização mais freqüente é no quarto ventrículo, mais comum em adultos (Figura 2), sendo incomuns no terceiro ventrículo. Raramente são bilaterais. Dez por cento são malignos (carcinomatosos), sendo a degeneração maligna comum quando ocorrem nos ventrículos laterais(6-9).
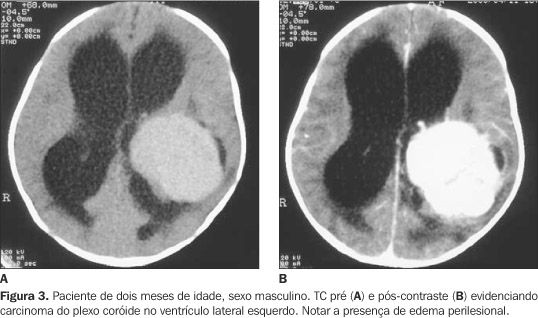
Os PPC são histológica, ultra-estrutural, bioquímica e fisiologicamente similares ao PC normal. À macroscopia têm coloração rosa-acinzentada, lembrando uma couve-flor. São freqüentemente pedunculados, com a haste vascular aderida ao PC, permitindo um certo movimento desses tumores no interior dos ventrículos, a menos que aderências devidas a hemorragia estejam presentes(4). Angiograficamente esses tumores são hipervasculares, com numerosos vasos finos e tortuosos vistos na fase arterial e um "blush" homogêneo na fase venosa(10). Os sintomas das lesões supratentoriais são devidos à hidrocefalia decorrente de uma superprodução de LCR pelo próprio tumor, pela obstrução do fluxo liquórico e/ou pelo déficit de reabsorção (fibrose secundária à hemorragia prévia ou à descamação tumoral)(11-13). Pianetti et al.(3) observaram a saída de gotículas de liquor da superfície tumoral, em grande velocidade, levando a um aspecto de uma "árvore de gotas d'água". A produção de LCR nos pacientes com PPC tem sido quantificada como sendo de quatro a cinco vezes maior que em pessoas sãs(14-16). À TC o PPC é isoatenuante ou levemente hiperatenuante em relação à substância cinzenta. Notam-se calcificações em 25% dos casos. É incomum haver calcificações no PC normal na primeira década de vida. O achado de calcificações extensas no terceiro ou no quarto ventrículo ou no ângulo cerebelo-pontino (especialmente em adultos) deve alertar para a possibilidade de haver PPC, principalmente se há hidrocefalia associada. Os contornos são lobulados, com margens levemente irregulares. O realce é intenso e finamente heterogêneo(1,4). À RM observa-se grande massa lobulada isointensa à substância branca em T1. Calcificações apresentam-se como hipossinal em T2, vasos apresentam-se com ausência de sinal em T1 e T2. Nota-se hipersinal heterogêneo em T2. A injeção de contraste venoso determina intenso realce. Os CPC (Figura 3) são raros, acometendo principalmente crianças de dois a quatro anos de idade, sendo os ventrículos laterais os mais atingidos. Os sintomas são secundários à hidrocefalia, que é, porém, menos intensa que a dos PPC. Comumente causam déficits neurológicos focais(1).
À TC os CPC são comumente grandes massas intraventriculares, irregulares, heterogêneas, isoatenuantes/hiperatenuantes em relação à substância branca, podendo ter áreas de necrose no seu interior e calcificações. Claramente invadem o parênquima adjacente causando edema vasogênico peritumoral intenso, desvio da linha média e, eventualmente, aumento assimétrico da calvária ipsilateral à lesão. A invasão extensa parenquimatosa é o principal sinal de diferenciação com o PPC(4,17). Apesar disso, os achados não são nem característicos nem específicos de PPC ou de CPC(1). Os ependimomas (Figura 4) são tumores bem diferenciados das células ependimárias que revestem os ventrículos. Têm como localização mais freqüente a região infratentorial, no soalho do quarto ventrículo. Acometem também, em ordem decrescente de freqüência, a região supratentorial, a medula espinhal e a cauda eqüina. É característica a expansão da lesão do quarto ventrículo pelos forames de Luschka e/ou de Magendie. À TC apresentam-se como massas multilobuladas, circunscritas, isoatenuantes/levemente hiperatenuantes, apresentando realce heterogêneo após a administração de contraste venoso. À RM são heterogêneos, com hipossinal ou sinal intermediário em T1 e com focos de hipersinal em T2, correspondendo a áreas císticas e/ou necróticas. O gadolínio determina um realce heterogêneo do tumor.
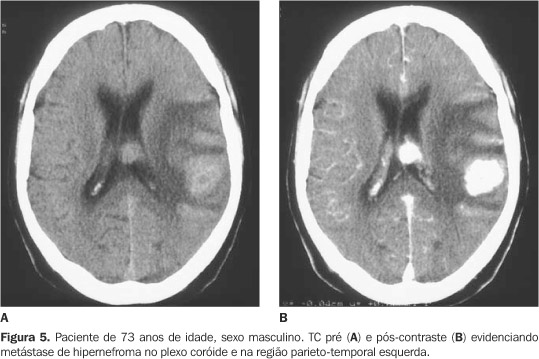
As metástases (Figura 5) mais freqüentes para o PC são de tumor de Wilms, retinoblastoma e neuroblastoma em crianças, e de tumor gástrico e de pulmão em adultos. Os achados de imagem são inespecíficos, apresentando-se como massas heterogêneas situadas principalmente no glomo do ventrículo lateral, realçando após a injeção de contraste venoso(18).
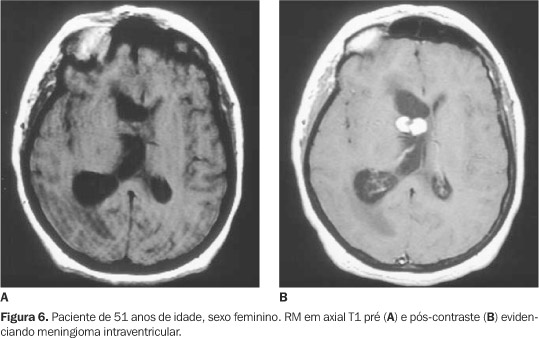
Os meningiomas (Figura 6) originam-se de células estromais da tela coróidea e crescem como massas intraventriculares. Ocorrem mais freqüentemente nos ventrículos laterais, em pacientes de meia e terceira idades (40-60 anos e mais de 60 anos, respectivamente). Têm crescimento lento, podendo apresentar mínimo edema adjacente e grande expansão ventricular cursando com hidrocefalia obstrutiva. Geralmente são massas ovaladas de margens lisas. À TC os meningiomas intraventriculares são tipicamente hiperatenuantes, apresentando focos de calcificação em 45% dos casos. Embora sejam homogêneos na maioria das vezes, após a administração do contraste venoso, podem ser vistos focos císticos, necróticos e/ou hemorrágicos. À RM apresentam-se iso/hipointensos em T1 e iso/hiperintensos em T2 em relação à substância branca. O padrão textural é comumente heterogêneo, devido às alterações descritas previamente na TC pós-contraste(19).
Os linfomas de PC podem ser primários ou secundários a doença extracraniana. A maioria deles consiste de linfoma não-Hodgkin de células B. A incidência aumenta nos pacientes imunocomprometidos. Os sintomas variam segundo a localização da lesão, incluindo desde convulsões até déficits focais. Freqüentemente apresentam-se como lesões múltiplas. À TC são isoatenuantes/moderadamente hiperatenuantes em relação à substância branca. À RM são isointensos/levemente hipointensos em T1 e isointensos/levemente hiperintensos em T2. A administração de contraste venoso determina realce intenso e homogêneo(1). Na leucemia, principalmente na leucemia mielóide aguda, pode haver associação com o sarcoma granulocítico. É um tumor raro, heterogêneo, de contornos irregulares e base dural, que realça após a administração de contraste venoso. Sua coloração esverdeada originou o termo descritivo geral de cloroma. Esse tumor pode preceder em alguns meses o diagnóstico de leucemia(1,20).
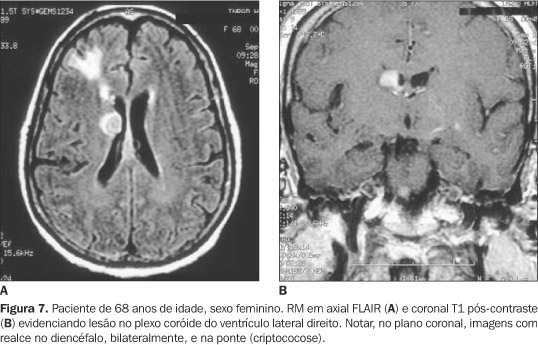
OUTRAS LESÕES EXPANSIVAS Os PC podem servir como porta de entrada para infecções do SNC. Doenças comuns no nosso meio, como meningite tuberculosa ou meningocócica, geralmente se iniciam pelos PC antes de tornarem-se difusas. As infecções dos PC (coroidoplexites) podem também ocorrer secundariamente a encefalite, ependimite ou ruptura de abscesso. Bactérias (Nocardia asteroides, Stomatococcus mucilaginosus, Mycobacterium tuberculosis), fungos (Cryptococcus neoformans) (Figura 7) e vírus (citomegalovírus) são os agentes infecciosos mais freqüentemente envolvidos. Parasitas são extremamente raros. Nos estudos com métodos de imagem os PC encontram-se aumentados e apresentam realce intenso após a injeção de contraste venoso, além de haver edema periventricular(1).
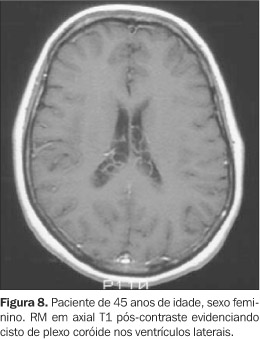
Os cistos do PC (Figura 8), também denominados de cistos neuroepiteliais intraventriculares não-colóides, cistos coróideo-epiteliais, cistos ependimários ou cistos subependimários, são achados acidentais, particularmente na RM. Cistos pequenos são relativamente comuns à autópsia. São mais freqüentemente encontrados nos ventrículos laterais, particularmente à esquerda, acometendo principalmente crianças e adultos com menos de 40 anos de idade. Postula-se que, numa etapa precoce do desenvolvimento, as endentações epiteliais (recobrindo as fissuras interlobulares) podem ficar aprisionadas no estroma, determinando seu surgimento. Geralmente são menores que 1,0 cm. Quando maiores, podem produzir sintomas obstrutivos. No seu interior há LCR, mas podem sangrar, ou regredir espontaneamente. Nos estudos com métodos de imagem os cistos não complicados têm mesma atenuação, à TC, e mesmo sinal, à RM, do LCR. Na RM podem ter sinal um pouco mais intenso que o LCR em T1 e T2, devido ao conteúdo protéico/líquido não-pulsátil. Na TC geralmente não se pode ver a parede do cisto. Para melhor demonstração, utiliza-se a RM com seqüências em T1/FLAIR ("fluid attenuated inversion recovery")(1).
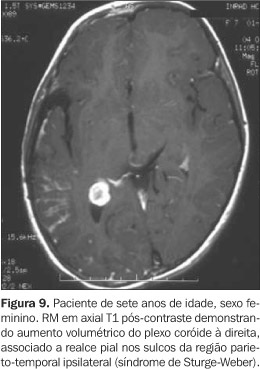
As hemorragias do PC são mais freqüentes no período neonatal. Geralmente são secundárias a trauma (revisão de "shunt" ventricular/ventriculografia, enfarte secundário a trombose/embolia das artérias coróideas, trauma crânio-encefálico) ou malformação vascular, mais vistas em crianças. Em pacientes com síndrome de Down que desenvolvem coagulação intravascular disseminada há maior propensão à trombose e hemorragia do PC. Como outras causas, podem ser citadas: PPC, desidratação hipernatrêmica, vasculites e, experimentalmente, ciclofosfamida, aminas terciárias e sais de metais pesados (cloreto de mercúrio, por exemplo). Nos estudos tomográficos, o PC pode apresentar-se aumentado e hiperatenuante. Algumas anomalias congênitas podem cursar com presença de lesões expansivas nos PC. Na síndrome de Sturge-Weber-Dimitri-Krabbe-Kalischer (angiomatose encéfalo-trigeminal, angiomatose meningo-facial) (Figura 9), caracterizada clinicamente por convulsões, demência e hemiparesia, pode haver aumento do PC ipsilateral às lesões cutâneas — nevus flammeus. Outros achados à TC são atrofia cerebral, hipertrofia óssea, seios paranasais amplos, elevação do assoalho da fossa média, calcificações girais e espessamento leptomeníngeo. À RM pode notar-se hipersinal relacionado a aumento de conteúdo de fluido ou a uma lentificação do fluxo venoso do PC em T2. Na síndrome de Klippel-Trenaunay-Weber, caracterizada pela presença de hemangiomas cutâneos em "vinho do Porto" (usualmente unilateral e envolvendo uma extremidade), hipertrofia de tecidos ósseos e moles e malformação vascular parenquimatosa profunda (arteriovenosa ou capilar), pode haver achados variáveis à TC e à RM, como lesões vasculares, hemangiomas e hemimegaencefalia. Pode haver intenso realce dos PC associado a calcificações, bem como realce leptomeníngeo.
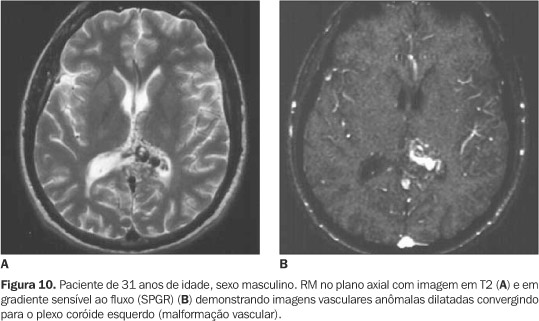
Com relação às malformações vasculares envolvendo os PC, poucos casos têm sido descritos, ocorrendo freqüentemente em recém-nascidos. Estas incluem malformação arteriovenosa (Figura 10), angioma cavernoso e hemangioma. Essas malformações podem estar associadas a malformações da veia de Galeno(1,21).
Os xantogranulomas representam um fenômeno benigno degenerativo de etiologia desconhecida, podendo estar relacionados ao extravasamento de lipídios plasmáticos. São mais comumente vistos em ambos os ventrículos laterais. Geralmente são assintomáticos, sendo diagnosticados incidentalmente em autópsias. Se grandes, podem causar sintomas obstrutivos. À TC podem mostrar-se como tumefações simétricas, com calcificações periféricas e região central hipoatenuante, mas não-negativa, nos trígonos. À RM apresentam hipersinal em T2. Tanto na TC quanto na RM a maioria não realça com contraste venoso. Em alguns casos, têm realce marginal. Essas alterações distróficas podem ser de difícil diferenciação com outras massas. O pseudotumor inflamatório representa uma lesão expansiva dos PC de crescimento benigno. O perfil patológico é de proliferação de tecido conectivo associada a infiltrado inflamatório com elementos mononucleares. À TC e à RM observa-se grande massa espontânea no átrio do ventrículo lateral, associada a edema perilesional e hidrocefalia. Nota-se realce homogêneo em ambos os métodos. O envolvimento do SNC na sarcoidose e na doença de Hand-Schüler-Christian também foi demonstrado, ocorrendo tardiamente no curso destas. O envolvimento do PC nessas doenças é extremamente raro e manifesta-se como grandes granulomas. Esses granulomas tendem a ocorrer em pacientes mais jovens e usualmente causam sintomas sérios. À TC, apresentam-se como massa hipoatenuante/isoatenuante, com edema perilesional. À RM apresentam-se como massa hipointensa/isointensa em T1 e relativamente hiperintensa em T2. A injeção de contraste venoso determina realce intenso e homogêneo. Anomalias no SNC por artrite reumatóide são muito raras, vistas apenas em doença sistêmica em atividade. Aparecem como vasculites ou como nódulos reumatóides durais, podendo afetar o PC. Causam principalmente distúrbios comportamentais. A hipertrofia vilosa é uma condição rara que causa produção excessiva de LCR. Usualmente envolve os ventrículos laterais, com hidrocefalia marcante. A análise histológica revela um PC normal. À TC e à RM observa-se aumento simétrico e difuso dos PC dos ventrículos laterais. A injeção de contraste venoso determina realce intenso e homogêneo. O diagnóstico diferencial das lesões expansivas do PC é vasto, englobando enorme variedade de entidades nosológicas. Por meio dos métodos de imagem, não há sinais patognomônicos descritos desta ou daquela doença. No entanto, a avaliação criteriosa e sistemática das características das lesões pode apontar para determinado grupo de condições, bem como sugerir a etiologia.
REFERÊNCIAS 1. Guermazi A, De Kerviler E, Zagdanski AM, Frija J. Diagnostic imaging of choroid plexus disease. Clin Radiol 2000;55:503-16. [ ] 2. Laterra J, Goldstein GW. Ventricular organization of cerebrospinal fluid: blood-brain barrier, brain edema, and hydrocephalus. In: Kandel ER, Schwartz JH, Jessell TM, eds. Principles of neural science. 4th ed. New York, NY: McGraw-Hill, 2000:1295-7. [ ] 3. Pianetti G, Fonseca LF. Tumores do plexo coróideo. Arq Neuropsiquiatr 1998;56:223-31. [ ] 4. Coates TL, Hinshaw DB Jr, Peckman N, et al. Pediatric choroid plexus neoplasms: MR, CT, and pathologic correlation. Radiology 1989;173:81-8. [ ] 5. Reed UC, Rosemberg S, Gherpelli JLD, Matushita H, Almeida GGM, Diament AJ. Brain tumors in the first two years of life: a review of forty cases. Pediatr Neurosurg 1993;19:180-5. [ ] 6. Lena G, Genitori L, Molina J, Legatte JRS, Choux M. Choroid plexus tumours in children: review of 24 cases. Acta Neurochir (Wien) 1990;106:68-72. [ ] 7. Matson DD, Crofton FDL. Papilloma of the choroid plexus in chidhood. J Neurosurg 1960;17: 1002-27. [ ] 8. Raimondi AJ, Gutierrez FA. Diagnosis and surgical treatment of choroid plexus papillomas. Child's Brain 1975;1:81-115. [ ] 9. Knierim DS. Choroid plexus tumors in infants. Pediatr Neurosurg 1990;16:276-80. [ ] 10. Aaron JO, Taveras JM. Angiographic features of supratentorial neoplasms. In: Taveras JM, Ferrucci JT, eds. Radiology. Vol. 3. Philadelphia, PA: Lippincott, 1986:4-5. [ ] 11. Fairburn B. Choroid plexus papilloma and the relation to hydrocephalus. J Neurosurg 1960;17: 166-71. [ ] 12. Ghatak NR, McWhorter JM. Ultrastructural evidence for CSF production by a choroid plexus papilloma. J Neurosurg 1976;45:409-15. [ ] 13. Husag L, Costabile G, Probst C. Persistent hydrocephalus following removal of choroid plexus papilloma of the lateral ventricle. Neurochirurgia (Stuttg) 1984;27:82-5. [ ] 14. Pascual-Castroviejo I, Villarejo F, Perez-Higueras A, Morales C, Pascual-Pascual SI. Childhood choroid plexus neoplasms: a study of 14 cases less than 2 years old. Eur J Pediatr 1983;140:51-6. [ ] 15. Milhorat TH, Hammock MK, Davis DA, Fenstermacher JD. Choroid plexus papilloma. I. Proof of cerebrospinal fluid overproduction. Child's Brain 1976;2:273-89. [ ] 16. Ford WJ, Brooks BS, El Gammal T, Massey CE, Beveridge WD. Adult cerebellopontine angle choroid plexus papilloma: MR evaluation. Am J Neuroradiol 1988;9:611. [ ] 17. Packer RJ, Perilongo G, Johnson D, et al. Choroid plexus carcinoma of childhood. Cancer 1992;69: 580-5. [ ] 18. Nakabayashi H, Murata K, Sakaguchi M, Nakajima K, Katsuyama J. Choroid plexus metastasis from gastric cancer - case report. Neurol Med Chir (Tokyo) 1994;34:183-6. [ ] 19. Perry RD, Parker GD, Hallinan JM. CT and MR imaging of fourth ventricular meningiomas. J Comput Assist Tomogr 1990;14:276-80. [ ] 20. Burger PC, Scheithauer BW, Vogel FS. Brain tumors. In: Burger PC, Scheithauer BW, Vogel FS, eds. Surgical pathology of the nervous system and its coverings. 3rd ed. New York, NY: Churchill Livingstone, 1991:193-437. [ ] 21. Griffiths PD. Sturge-Weber syndrome revisited: the role of neuroradiology. Neuropediatrics 1996;27: 284-94. [ ]
Recebido para publicação em 26/12/2002
* Trabalho realizado no Departamento de Radiologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554