Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 36 nº 2 - Mar. / Abr. of 2003
Vol. 36 nº 2 - Mar. / Abr. of 2003
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Cristina Caetano Stefenon, Alex Assis de Carvalho, Maria Célia Resende Djahjah, Hilton Augusto Koch |
|
|
Descritores: Cicatriz radial, Neoplasias mamárias, Doença fibrocística da mama, Mamografia, Ultra-sonografia mamária |
|
|
Resumo: IIIProfessora de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ)
Introdução A cicatriz radial/lesão esclerosante complexa (CR/LEC) é uma doença benigna da mama, a maioria microscópica, com diâmetro de 0,1 a 0,6 cm, freqüentemente múltipla e bilateral, não detectada pela palpação ou mamografia(1). Sua detecção tem-se tornado mais freqüente com o aumento do uso da mamografia em mulheres assintomáticas(2). A incidência reportada na literatura especializada é de 0,3 - 0,9 por 1.000 mamografias de rastreamento(3 - 5). Quando detectadas na mamografia, as CR/LECs são habitualmente maiores que 5 mm, formando estruturas estreladas ou espiculadas, com centro radiolúcido(6).Entretanto, esses achados não são específicos e podem ser encontrados em carcinomas infiltrativos. São raras antes dos 30 anos e mais freqüentes entre 40 - 60 anos(6).Essas lesões não são verdadeiramente cicatrizes, mas entidades idiopáticas sem relação com trauma ou cirurgia prévia(7). Seu maior significado clínico é a semelhança com os carcinomas estrelados na mamografia e sua associação com hiperplasia atípica e câncer em pelo menos 10 - 40% dos casos(8). O presente trabalho destina-se a estudar, retrospectivamente, as várias formas de apresentação da CR/LEC na mamografia, correlacionando-as com o exame clínico e os achados ultra-sonográficos, bem como a sua associação com hiperplasia atípica e carcinoma.
Pacientes, materiais e métodos No período de outubro de 1993 a dezembro de 2001 foram realizadas 646 localizações pré-cirúrgicas no Centro de Diagnóstico por Imagem, Vitória, ES, e de novembro de 1998 a setembro de 2001, 280 localizações pré-cirúrgicas no Hospital Santa Rita de Cássia, Vitória, ES, em pacientes que apresentavam lesões não-palpáveis de mama, com a finalidade de orientar a biópsia cirúrgica para diagnóstico histopatológico. Do total de 926 lesões em 901 pacientes, 57 tiveram diagnóstico histopatológico de CR/LEC. Em todos os casos as lesões foram minuciosamente estudadas com compressão localizada e ampliação, e as radiografias dos espécimes cirúrgicos foram realizadas em todos os 57 casos, confirmando a retirada da lesão. Os equipamentos empregados para a obtenção dos exames foram o Senographe 600T e o Estereotix I da General Electric (GE), e cassete, filmes e processadora M35 da Kodak. Os exames de ultra-sonografia foram realizados com os aparelhos Hitachi 310 com transdutor de 5,0 MHz e Logiq 500-GE com transdutor de 7,5 MHz. As localizações pré-cirúrgicas foram guiadas por estereotaxia acoplável ou ultra-sonografia, e a marcação da área de interesse com fio metálico modificado de Kopans em todos os casos. Na mamografia as alterações detectadas foram descritas e classificadas de acordo com a orientação do Registro de Imagem da Mama e Sistema de Dados BI-RADS(9) e recomendada pelo Colégio Brasileiro de Radiologia (CBR)(10,11). Para a denominação de distorção arquitetural era obrigatória a presença de espículas, independentemente do seu comprimento e de sua espessura, com área central radiolúcida ou radiopaca, porém desproporcional ao comprimento das espículas, e nos nódulos espiculados a presença de uma área central sólida proporcional às espículas. A densidade assimétrica foi denominada como um aumento no volume de tecido fibroglandular, comparado com a mama contralateral, e que se acentuava à compressão localizada com ampliação. Na descrição do estudo ultra-sonográfico foram registrados: realizado ou não realizado; realizado, porém sem expressão ultra-sonográfica; expressada como área hipoecóica irregular com forte atenuação acústica posterior; ou expressada como nódulo hipoecóico irregular com atenuação acústica posterior. A partir da paciente número 14, o aparelho ultra-sonográfico utilizado foi sempre o Logiq 500-GE, com sonda 7,5 MHz, e o critério para enumerar as pacientes foi a data da localização pré-cirúrgica, sendo o de número 1 a mais antiga. O exame histopatológico foi considerado o teste ouro para o diagnóstico de CR/LEC. As alterações histopatológicas foram classificadas de acordo com a definição no guia para patologistas do Royal College of Pathologists(12). Cicatriz radial (CR) foi definida como lesão de até 10 mm, com centro fibroelastótico denso e geralmente pouco celular, em que estruturas epiteliais se irradiavam em uma configuração estrelada. A lesão esclerosante complexa (LEC) foi definida como uma estrutura básica idêntica, porém maior que 10 mm. Nos dados referentes à avaliação histopatológica foram incluídos os 57 casos, e as duas lesões foram consideradas como única entidade, todas denominadas CR. Os cortes histológicos corados pela hematoxilina-eosina de todas as lesões, exceto três, foram reexaminados por um anatomopatologista, que listou as seguintes alterações morfológicas: adenose, metaplasia apócrina, ectasia ductal, infiltrado inflamatório, hiperplasia ductal típica, hiperplasia ductal atípica, neoplasia lobular, carcinoma ductal in situ, carcinoma tubular e carcinoma ductal infiltrativo; realizou, ainda, medição micrométrica da lesão, que incluiu a mensuração do maior diâmetro, do centro fibroelastótico isoladamente e da maior espícula. Foram montadas tabelas de contingência e os dados epidemiológicos foram apresentados na forma descritiva. Os dados foram organizados em tabelas e gráficos, utilizando os recursos do programa estatístico SPSS, versão 8.0. Foi realizado o teste qui-quadrado de Pearson e observado o seu p-valor para medir a associação entre pares de variáveis. Foi adotado nível de significância de 5% para todos os testes.
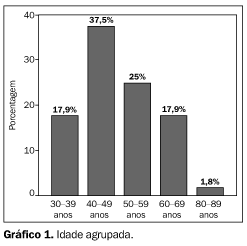
Resultados Das 926 lesões submetidas a biópsia cirúrgica após a localização com fio metálico, resultaram 58 casos de CR/LEC, em 57 pacientes (6,15%). Em uma paciente o achado de CR foi incidental, encontrada no espécime cirúrgico da quadrantectomia e não relacionada, topograficamente, com o carcinoma, sendo incluída apenas nos dados histopatológicos. Uma outra paciente apresentou duas CR/LECs na mama esquerda, sendo considerada aquela que revelou expressão mamográfica. A idade das pacientes variou de 31 a 84 anos (média de 49 anos), com a freqüência por faixa etária mostrada no Gráfico 1. Dos 56 casos de CR/LECs, as lesões foram palpáveis em dez (17,9%), como espessamento de consistência endurecida, fixa, sugestiva de malignidade. Em duas dessas pacientes as lesões eram retroareolares e provocavam retração do mamilo. A mama direita foi acometida em 33 casos (59%), e a esquerda, em 23 casos (41%). Houve um caso de multicentricidade e nenhum caso de bilateralidade.
Uma paciente tinha história pregressa de câncer na mama contralateral. O teste qui-quadrado de Pearson encontrou existência de associação entre a idade agrupada e a presença de lesão palpável, sendo que nos dez casos de lesão palpável seis ocorreram na faixa etária de 30 a 39 anos e três entre 40 e 49 anos (p < 0,005) (Tabela 1).
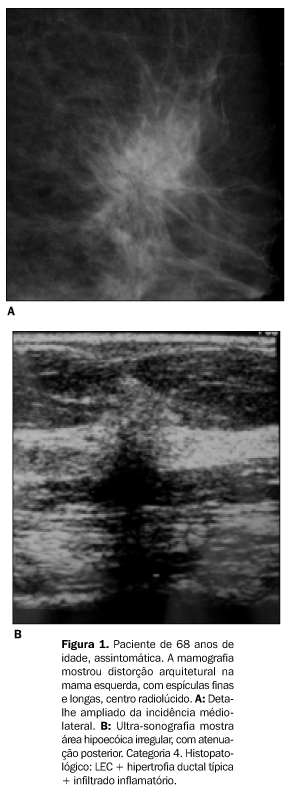
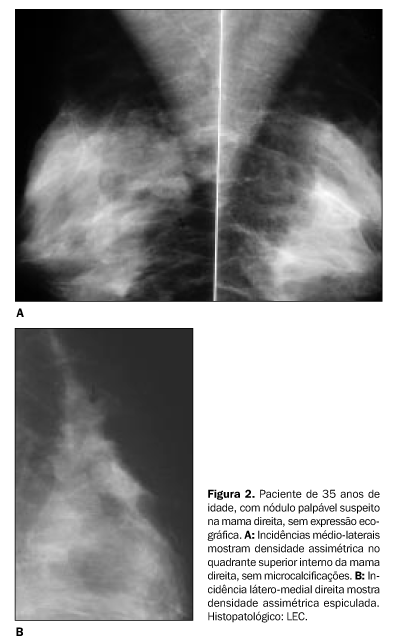
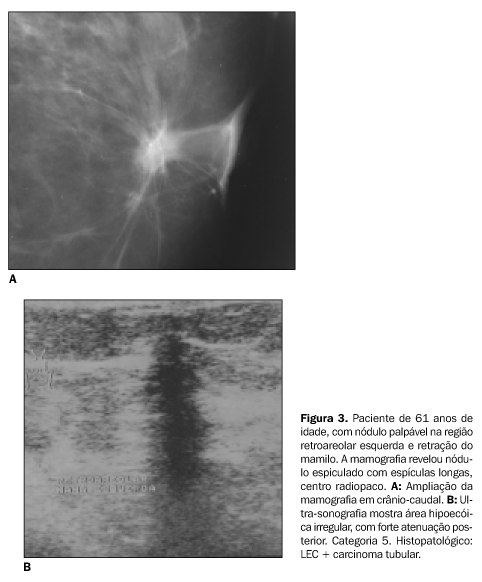
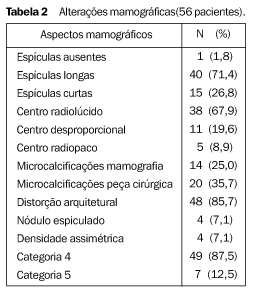
Todas as alterações mamográficas incluíam-se em três grupos: distorção arquitetural (Figuras 1A, 4A e 4B), densidade assimétrica (Figuras 2A e 2B) e nódulo espiculado (Figura 3A). Não houve nenhum caso de microcalcificações, nem de nódulo circunscrito como única alteração. A distorção arquitetural foi a alteração mais freqüente nesta série, ocorrendo em 48 casos (85,7%), e com a mesma freqüência foram observados a densidade assimétrica e o nódulo espiculado, em quatro casos cada (7,1%). Todas as densidades assimétricas, exceto uma, eram espiculadas na compressão seletiva com magnificação. Das 55 lesões nas quais espículas estavam presentes, em 40 (72,7%) essas espículas eram longas e em 15 (27,3%) eram curtas. O centro das lesões era radiolúcido em 38 casos (67,9%), desproporcional ao comprimento das espículas em 11 (19,6%), radiopaco em cinco (8,9%) e ausente em dois casos (3,6%). As duas lesões nas quais o centro estava ausente eram densidades assimétricas (Tabela 2).
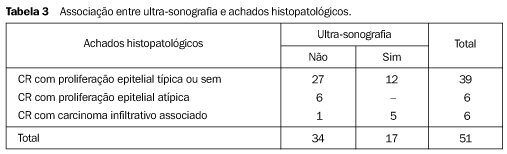
As microcalcificações foram detectadas na mamografia em 14 casos (25%) e em 20 casos (35,7%) quando o espécime cirúrgico foi avaliado. As características morfológicas das microcalcificações eram amorfas em 18 casos e pleomórficas em dois casos. Em nenhum caso as microcalcificações eram tipicamente malignas (Tabela 2). De acordo com a morfologia da alteração mamográfica, correlacionando-se aos achados ultra-sonográficos e exame clínico, era dada a impressão do laudo mamográfico em categorias, segundo a recomendação do CBR. A categoria 4 foi encontrada em 49 casos (87,5%), e a categoria 5, em sete casos (12,5%). Dos 49 casos categoria 4, 46 eram distorções arquiteturais e três eram densidades assimétricas. Dos sete casos categoria 5, quatro eram nódulos espiculados, dois eram distorções arquiteturais e um era densidade assimétrica. O teste qui-quadrado de Pearson encontrou existência de associação entre o histopatológico e a categoria (p = 0,001). Dos seis casos de CR/LEC com carcinoma infiltrativo, cinco foram classificados na categoria 5, e dos 41 casos de CR/LEC com proliferação epitelial típica ou sem, 39 foram classificados na categoria 4. A ultra-sonografia foi realizada em 51 pacientes, sendo que em 34 (66,7%) a alteração mamográfica não teve expressão ultra-sonográfica. Dos 17 casos (33,3%) com alterações à ultra-sonografia, em 14 foi encontrada área hipoecóica irregular com forte atenuação acústica posterior (Figuras 1B, 3B e 4C), e em três casos observou-se nódulo hipoecóico de contorno irregular com discreta a moderada atenuação acústica posterior, sendo o eixo ântero-posterior maior que o craniopodálico em dois casos e o eixo ântero-posterior igual ao craniopodálico em um caso. A localização pré-cirúrgica foi guiada por ultra-sonografia em todos os 17 casos. O teste qui-quadrado de Pearson encontrou existência de associação entre os achados do exame histopatológico e a presença de alteração ultra-sonográfica. Dos seis casos de CR/LEC com carcinoma infiltrativo associado, cinco apresentaram alterações ultra-sonográficas, e dos 39 casos de CR/LEC sem proliferação epitelial ou com proliferação epitelial típica, 27 não apresentaram alterações ultra-sonográficas (p = 0,007) (Tabela 3).
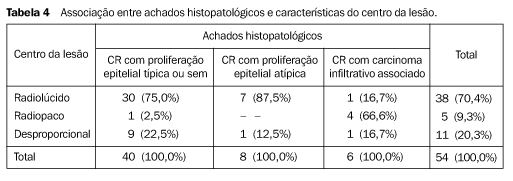
Houve 33 casos de CR e 24 de LEC. Adenose estava presente em 32 casos, hiperplasia ductal típica em 39, metaplasia apócrina em 24, ectasia ductal em 35, infiltrado inflamatório em 15, hiperplasia ductal atípica em cinco, neoplasia lobular em quatro, carcinoma tubular com carcinoma ductal in situ em três (Figuras 4A, 4B e 4C), carcinoma tubular em dois e carcinoma ductal infiltrativo em um caso (ver Tabela 5, em Discussão). A aferição micrométrica dos 53 casos reavaliados mostrou que a menor CR/LEC foi de 2 mm e a maior foi de 23 mm (média de 10,5 mm). O centro fibroelastótico variou de 1 a 13 mm (média de 4,8 mm) e o da maior espícula variou de 1 a 9 mm (média de 4,1 mm). Os resultados histopatológicos foram correlacionados com as características do centro da lesão, e o teste qui-quadrado de Pearson encontrou existência de associação entre essas variáveis (p = 0,010). Dos seis casos de CR com carcinoma infiltrativo associado, quatro tinham centro radiopaco (Figura 3), e dos 40 CRs com proliferação epitelial típica ou sem, 30 apresentavam centro radiolúcido, e nove, desproporcional (Tabela 4).
Discussão Embora no passado a maioria das CR/LECs fossem detectadas durante exame histológico realizado por outras razões, atualmente a detecção tem-se tornado mais freqüente com o acréscimo do uso da mamografia em mulheres assintomáticas, conseqüentemente aumentando a importância do seu conhecimento clínico, radiológico e anatomopatológico. Na presente série a CR e a LEC foram consideradas uma só entidade, todas denominadas CR/LEC, visto que a LEC tem estrutura básica igual à da CR, mas é maior que 10 mm e geralmente exibe extensas e mais complexas alterações benignas ao redor da periferia, sem aumento na incidência de hiperplasias atípicas ou carcinomas, segundo vários relatos na literatura e resultados deste estudo(8,12,13). Assim como Tavassoli(14), aqui é defendido o termo CR, independentemente do tamanho e grau de complexidade da lesão. As CR/LECs têm sido classicamente descritas como impalpáveis e não causam espessamento ou retração cutânea(3,5,15 - 18), embora alguns poucos autores demonstrem que podem ser palpáveis, com uma variação de 3,3% a 50%(2,4,19 - 21). No presente estudo a presença de lesão palpável foi encontrada em dez casos (17,9%), como espessamento de consistência endurecida, sugestiva de malignidade. Retração e/ou espessamento cutâneo não foram observados. O exame clínico, realizado pelo médico após a análise da mamografia, direcionado para a área da alteração mamográfica, pode justificar a prevalência de 17,9% de lesões palpáveis nesta série. Das dez lesões palpáveis, seis ocorreram em mulheres de 30 - 39 anos e três em mulheres de 40 - 49 anos, sendo esta associação estatisticamente significante (p < 0,05). A maior prevalência de CR/LEC palpável em mulheres abaixo de 50 anos foi observada por Sloane e Mayers(22), que em 126 lesões de 91 pacientes demonstraram que nove eram palpáveis, com idade de 23 a 55 anos (média de 35,2 anos). A maior prevalência de CR/LEC em mulheres com menos de 50 anos de idade, no presente estudo, pode ser explicada porque mamografias nessas mulheres são geralmente realizadas quando elas apresentam anormalidades no exame clínico. Contudo, considerando que a maioria das CR/LECs foram impalpáveis, a real associação entre CR/LECs palpáveis em mulheres abaixo de 50 anos não pode ser excluída. Não foi encontrada correlação entre a presença de lesão palpável e exame histopatológico. Das dez lesões palpáveis, oito eram CR/LEC sem associação com proliferação epitelial atípica ou carcinoma. Devido à semelhança no aspecto mamográfico da CR com os carcinomas espiculados, critérios radiológicos para diferenciar as duas lesões têm sido sugeridos(23). As características mamográficas clássicas da CR/LEC foram minuciosamente descritas por Tabar e Dean(5) como sendo uma lesão espiculada com finas e longas espículas, com aparência variável de uma incidência para outra, ausência de área central tumoral radiopaca equiparável ao comprimento das espículas e que raramente produzem lesão palpável, espessamento ou retração cutânea. No presente estudo a distorção arquitetural com espículas finas, centro radiolúcido ou com discreta opacidade central, porém totalmente desproporcional ao comprimento das espículas, foi a forma constatada de apresentação mais freqüente, ocorrendo em 36 (64,3%) dos 56 casos. Esses aspectos são semelhantes à descrição clássica relatada por Tabar e Dean(5) e encontrados por outros autores(3,4,13,15,18). O centro radiolúcido ou desproporcional ao comprimento das espículas, um dos aspectos clássicos da CR/LEC na mamografia, foi observado em 49 casos (85,7%), e o teste qui-quadrado de Pearson encontrou associação estatisticamente significante entre essas características do centro e os diagnósticos histopatológicos. A possibilidade de carcinoma infiltrativo associado a CR/LEC foi maior na presença do centro radiopaco, assim como a presença de centro radiolúcido ou desproporcional torna menos provável esta associação. Apesar do centro radiolúcido ser um dos aspectos clássicos da CR na mamografia, não é exclusivo, pois pode ser encontrado em carcinomas estrelados(2,13). Ciatto et al.(4) notaram centro radiolúcido em 35 dos 38 casos de CR e em seis de 30 casos de carcinomas estrelados impalpáveis. Mitnick et al.(17) observaram centro radiolúcido em cinco das nove CRs e em 14 dos 73 carcinomas estrelados impalpáveis. A presença de finas e longas espículas, outra característica clássica da CR, foi encontrada em 40 dos 56 casos nesta série (71,4%), em concordância com resultados encontrados por outros autores(2,4,13,18). Porém, não são exclusivas, pois podem ser observadas em carcinomas, especialmente nos tubulares. Sheppard et al.(24), em um estudo de 17 carcinomas tubulares, relataram espículas longas em 53% dos casos. Portanto, as características mamográficas clássicas da CR não são suficientemente específicas para o diagnóstico diferencial entre CR e carcinoma, especialmente os carcinomas tubulares. Embora a possibilidade de CR/LEC possa ser sugerida, o diagnóstico final deve ser baseado em evidências histológicas(1,2,4,8,13,18). A clássica distorção arquitetural não foi a única forma de apresentação, tendo havido quatro casos (7,1%) de nódulos espiculados tipicamente malignos à mamografia e quatro casos (7,1%) de densidades assimétricas. Vários autores relataram, com freqüência semelhante, a apresentação da CR/LEC como nódulos espiculados, simulando lesões tipicamente malignas(13,18). Em um estudo retrospectivo de 98 casos de CR/LEC, Sabate et al.(18) encontraram a clássica aparência da CR/LEC, descrita por Tabar e Dean(5), em 74 casos (75,5%) e nódulo espiculado em 14 casos (14%). A outra forma de apresentação da CR nesta série foi a densidade assimétrica (4 de 56 casos), caracterizada como área radiopaca, sem configurar nódulo, de densidade semelhante ao tecido fibroglandular, sem correspondência na mama contralateral. Em dois casos as densidades assimétricas eram palpáveis, muito semelhantes ao tecido fibroglandular. Espículas estavam ausentes em um caso e presentes em outro somente na compressão seletiva. O exame clínico aumentou a suspeição radiológica, pois eram palpáveis. Os outros dois casos tinham microcalcificações associadas e eram espiculadas nas incidências de rotina. Não há relatos na literatura em que a CR/LEC tenha se apresentado dessa maneira, provavelmente pela dificuldade na padronização da descrição dessas lesões na mamografia, embora esta possibilidade tenha sido defendida por Alleva et al.(8). Segundo Mitnick et al.(17), a ausência de microcalcificações deve ser considerada como evidência de CR. Dos seus 14 casos de carcinomas com imagem radiológica típica de CR, 11 apresentaram microcalcificações. Por outro lado, não encontraram microcalcificações em qualquer dos seus cinco casos de CR. Estes resultados não têm encontrado concordância com vários trabalhos da literatura(1,13,19,25 - 27). Não é incomum encontrar microcalcificações na mamografia em CR, pois elas são detectadas freqüentemente no exame histológico, com relato de prevalência, em dois estudos patológicos, de 63%(28) e 46%(29). Portanto, enquanto tem sido bastante registrado que microcalcificações histológicas são comumente encontradas na CR e que são visíveis na radiografia do espécime cirúrgico, não parece surpreendente que essas microcalcificações possam aparecer em mamografias de alta qualidade técnica. Trabalhos mais recentes têm mostrado que microcalcificações são detectadas na mamografia em 25% a 45% dos casos(1,13,18,19,23,30). Neste estudo, microcalcificações foram detectadas, em 14 (25%) dos 56 casos, nas incidências craniocaudal, médio-lateral e adicional com ampliação, e em 20 casos (35,7%) na radiografia com ampliação do espécime cirúrgico. As características das microcalcificações foram amorfas e de baixa densidade em 18 casos e pleomórficas em dois. O porquê são mais freqüentemente visualizadas na radiografia do espécime cirúrgico poderia ser explicado pelas suas características, como partículas finas e de baixa densidade, com todas as influências na melhora da qualidade da imagem que observamos em radiografias realizadas com baixa quilovoltagem(31). Não foi observada relação entre a presença ou ausência de microcalcificações e associação de hiperplasia atípica e câncer. O aparente aumento do número de microcalcificações detectadas na mamografia provavelmente é um reflexo da melhora na qualidade e tecnologia do equipamento, e a presença ou ausência de microcalcificações não poderá ser um critério para ajudar no diagnóstico diferencial de CR e carcinoma. Tem sido bem demonstrado, por vários autores(1,8,30,32), que achados sugestivos de CR/LEC na mamografia podem representar carcinomas que mimetizam achados de imagens clássicas dessa entidade, como também não é possível afastar a possibilidade de malignidade associada à CR. Frouge et al.(1), em 40 lesões sugestivas de CR na mamografia, encontraram 20 CRs, 12 carcinomas e oito CRs com carcinoma infiltrativo. Alleva et al.(8), em 22 casos nos quais a CR/LEC foi suspeitada baseada na mamografia, encontraram 13 lesões benignas e nove malignas. King et al.(30), em 39 casos sugestivos de CR na mamografia, encontraram nove CRs, um CR + carcinoma ductal in situ e 17 carcinomas (um carcinoma ductal in situ, três carcinomas tubulares, dois carcinomas lobulares infiltrativos e dez carcinomas ductais infiltrativos). A presença de centro radiolúcido dentro da CR não exclui malignidade. Embora alguns aspectos mamográficos clássicos possam sugerir a presença de CR/LEC, o diagnóstico diferencial final de carcinoma deve ser baseado em evidências histológicas, e a biópsia cirúrgica deve ser aconselhada para qualquer lesão estrelada detectada na mamografia. CR/LECs foram detectadas à ultra-sonografia em 17 (33,3%) pacientes. A alteração mais freqüente foi área hipoecóica irregular com sombra acústica posterior (14 casos), e nódulo hipoecóico irregular com eixo ântero-posterior maior que o craniopodálico e sombra acústica posterior (três casos). A presença de alteração ultra-sonográfica aumentou a suspeição da lesão mamográfica, e nos sete casos classificados na categoria 5, seis tiveram alteração ultra-sonográfica, fato este relatado por Cohen e Sferlazza(16) e Ung et al.(13). Monypenny et al. (citados por Finlay et al.(20)) referiram que as CRs eram usualmente invisíveis ou tinham aparência não específica. Finlay et al.(20), em 24 casos de CR, identificaram 21 à ultra-sonografia, mas não encontraram aspectos específicos que poderiam diferenciá-las de carcinoma. Mais recentemente, Cohen e Sferlazza(16) defenderam que a CR era freqüentemente visível à ultra-sonografia, identificando oito dos 12 casos de CR (nenhum câncer associado). Em seis dos oito casos a aparência sonográfica da CR foi mais suspeita quando comparada com a aparência na mamografia. Tem sido documentado que não existem critérios que possibilitem identificar CR/LEC à ultra-sonografia ou diferenciá-la de carcinomas tubulares, pela semelhança na apresentação dessas duas entidades(20,26). Sheppard et al.(24), em estudo retrospectivo de 17 carcinomas tubulares, identificaram 15 na ultra-sonografia como nódulos hipoecóicos irregulares, com sombra acústica posterior em 14 casos, aspectos estes idênticos aos observados na CR desta série. As localizações pré-cirúrgicas foram guiadas por ultra-sonografia em todos os 17 casos, com todas as vantagens que este método proporciona. Quando uma distorção arquitetural é detectada na mamografia, devemos recomendar estudo histopatológico, independentemente da ultra-sonografia, pois achados negativos com este método não afastam a possibilidade de CR/LEC. Não foi observado aumento na incidência de hiperplasia atípica e carcinoma, com base no tamanho da CR/LEC. Dos seis casos associados a carcinoma infiltrativo, três ocorreram em lesões entre 3 e 7 mm e três em lesões entre 11 e 12 mm. Dos cinco casos associados a hiperplasia ductal atípica, quatro ocorreram em lesões entre 4 e 9 mm e um em lesão de 11 mm; dos quatro casos associados a neoplasia lobular, três ocorreram em lesões entre 2 e 9 mm e um em lesão de 15 mm. Sloane e Mayers(22), em 126 casos de CR/LEC, encontraram relação entre a presença de hiperplasia atípica e carcinoma com o tamanho da lesão, sendo incomum esta associação em lesões menores que 6 - 7 mm; no entanto, observou-se que esta relação não foi progressiva, pois a incidência de malignidade não cresceu com o aumento no tamanho. No nosso estudo foi encontrada relação entre a presença de carcinoma e a idade da paciente, numa relação estatisticamente significante (p = 0,032). Hiperplasia atípica ou carcinoma não foram encontrados em nenhuma paciente abaixo de 40 anos de idade, três hiperplasias ductais atípicas e duas neoplasias lobulares foram observadas em pacientes entre 40 e 49 anos, e os seis casos de carcinoma associados à CR ocorreram em pacientes acima de 50 anos. A idade acima, na qual a incidência de hiperplasia atípica e carcinoma aumentaram significativamente, é aquelas na qual a incidência de câncer de mama geralmente aumenta. Portanto, parece que a formação de CR predispõe à transformação maligna do epitélio mamário, pelos mesmos fatores relacionados à idade e que ocorre em mulheres que não exibem estas lesões(22). Os dúctulos e lóbulos ao redor da área central da CR/LEC podem apresentar uma ampla variedade de alterações histológicas(14,29,33), podendo ser não-proliferativas (metaplasia apócrina, ectasia ductal, infiltrado inflamatório e cistos), proliferativas sem atipia (hiperplasia ductal típica e adenose), proliferativas com atipias e carcinomas. As mais freqüentes são as não-proliferativas e as proliferativas sem atipias(6,19,29,33,34). Metaplasia apócrina, adenose, ectasia ductal, infiltrado inflamatório e hiperplasia ductal típica foram comumente encontrados nesta série, com freqüências de 42%, 56%, 61,4%, 26,3% e 68,4%, respectivamente, em concordância com vários autores(29,34,35) (Tabela 5). Tem sido amplamente discutida, na literatura, a exata relação entre CR e carcinoma, especialmente os tubulares(8,36). A presença de carcinoma, hiperplasia atípica e neoplasia lobular em algumas CRs tem sido descrita por muitos autores nos últimos 20 anos(1,8,14,18,22,28,35,37), com variação de 13,6% a 53,5%. Na nossa casuística esta associação foi de 26,3%. Alguns autores têm sugerido que o carcinoma tubular provém da CR(28,37,38). Esta possibilidade tem sido fortemente defendida por Fisher et al.(28), Linell et al.(37) e Frouge et al.(1). Dado o exposto, dos seis casos de CR com carcinoma infiltrativo, cinco foram tubulares, indicando forte relação entre essas duas entidades. Porém, se existe de fato progressão da CR para carcinoma tubular, e com que freqüência isto ocorre, permanece indeterminado. Carcinoma ductal in situ, quando presente, e associado a CR, é habitualmente de baixo grau, do tipo cribriforme, sólido e/ou micropapilar. Comedocarcinoma e lesões de grau nuclear III são raramente encontrados(22,35). Nesta nossa casuística os três casos de carcinoma ductal in situ estavam associados a carcinoma tubular e eram não-comedo, de baixo grau, como relatado por Sloane e Mayers(22) e Douglas-Jones e Pace(35). Neoplasia lobular foi a lesão proliferativa mais comumente associada à CR, encontrada por Alvarado-Cabrero e Tavassoli(39). No presente estudo a neoplasia lobular foi encontrada em quatro dos 57 casos. Mais recentemente, Jacobs et al.(40) indicaram que a CR é um fator de risco independente para o desenvolvimento de câncer de mama, com risco relativo de 1,8, sendo o risco maior em pacientes com CR maior que 4 mm (risco relativo de 3,5) e quando hiperplasia atípica coexistir com a CR (risco relativo de 3,5). Baseado nesses dados, parece prudente incluir no laudo histopatológico a presença da CR e o seu tamanho, bem como todas as alterações histológicas associadas. Em acordo com grande número de autores, defendemos que achados sugestivos de CR/LEC na mamografia impõem a realização de biópsia cirúrgica, com a retirada de toda a lesão. A radiografia do espécime cirúrgico deve sempre ser realizada, pois proporciona informação segura de que a lesão foi retirada, como também auxilia o patologista durante o exame macroscópico e na seleção da área a ser amostrada para a microscopia. A lesão inteira deve estar disponível para que o patologista possa fazer diagnóstico acurado. Devido à heterogeneidade patológica dessas lesões, com várias condições malignas e atípicas associadas, a "core" biópsia ou a mamotomia podem levar a um diagnóstico falso-negativo benigno(11). Também está indicada a biópsia cirúrgica caso a CR/LEC seja diagnosticada pela "core" biópsia. Médicos especialistas em doenças da mama devem estar conscientes da limitação da mamografia no diagnóstico da CR, nos desafios de se fazer um diagnóstico histopatológico acurado e no aumento do risco para o desenvolvimento de câncer de mama em pacientes com CR(30).
Referências 1.Frouge C, Tristant H, Guinebretiére JM, et al. Mammographic lesions suggestive of radial scars: microscopic findings in 40 cases. Radiology 1995;195:623 - 5. [ ] 2.Patel A, Steel Y, McKenzie J, Letcher M, Della Rovere GQ, Morgan MWE. Radial scars: a review of 30 cases. Eur J Surg Oncol 1997;23:202 - 5. [ ] 3.Azavedo E, Svane G. Radial scars detected mammographically in a breast cancer screening programme. Eur J Radiol 1992;15:18 - 21. [ ] 4.Ciatto S, Morrone D, Catarzi S, et al. Radial scars of the breast: review of 38 consecutive mammographic diagnoses. Radiology1993;187:757 - 60. [ ] 5.Tabar L, Dean PB. Teaching atlas of mammography. Stuttgart: Thieme-Verlag, 1985. [ ] 6.Rosen PP. Breast pathology. Philadelphia: Lippincott Williams & Wilkins, 1997. [ ] 7.Sewell CW. Pathology of benign and malignant breast disorders. Radiol Clin North Am 1995;33:1067 - 82. [ ] 8.Alleva DQ, Smetherman DH, Farr GH Jr, Cederbom GJ. Radial scar of the breast: radiologic-pathologic correlation in 22 cases. RadioGraphics 1999;19 Spec No:S27 - 35. [ ] 9.Orel SG, Kay N, Reynolds C, Sullivan DC. BI-RADS categorization as a predictor of malignancy. Radiology 1999;211:845 - 50. [ ] 10.Koch HA, Azevedo CM, Boechat AL, et al. Radiologia da mama - qualidade em mamografia. Radiol Bras 1996;29:257 - 69. [ ] 11.Oliveira C, Luna M, Almeida L. Lesões impalpáveis da mama. Procedimentos invasivos. Rio de Janeiro: Revinter, 2000. [ ] 12.Pathology reporting in breast cancer screening. Royal College of Pathologists Working Group. J Clin Pathol 1991;44:710 - 25. [ ] 13.Ung OA, Lee WB, Greenberg ML, Bilous M. Complex sclerosing lesion: the lesion is complex, the management is straightforward. Aust N Z J Surg 2001;71:35 - 40. [ ] 14.Tavassoli FA. Pathology of the breast. Norwalk, CT: Appleton & Lange, 1992. [ ] 15.Adler DD, Helvie MA, Oberman HA, Ikeda DM, Bhan AO. Radial sclerosing lesion of the breast: mammographic features. Radiology 1990;176:737 - 40. [ ] 16.Cohen MA, Sferlazza SJ. Role of sonography in evaluation of radial scars of the breast. AJR 2000;174:1075 - 8. [ ] 17.Mitnick JS, Vazquez MF, Harris MN, Roses DF. Differentiation of radial scar from scirrhous carcinoma of the breast: mammographic-pathologic correlation. Radiology 1989;173:697 - 700. [ ] 18.Sabate JM, Gomez A, Villalba V, Torrubia S, Fernandez A, Lerma E. Radial scar revisited: spectrum of radiologic and pathological findings in 95 patients. Radiological Society of North America. Scientific Exhibits SPACE 0187BR. Chicago, RSNA, 1999. [ ] 19.Bonzanini M, Gilioli E, Brancato B, Pellegrini M, Mauri MF, Dalla Palma PD. Cytologic features of 22 radial scar/complex sclerosing lesions of the breast, three of which associated with carcinoma: clinical, mammographic and histologic correlation. Diagn Cytopathol 1997;17:353 - 62. [ ] 20.Finlay ME, Liston JE, Lunt LG, Young JR. Assessment of the role of ultrasound in the differentiation of radial scars and stellate carcinomas of the breast. Clin Radiol1994;49:52 - 5. [ ] 21.Wallis MG, Devakumar R, Hosie KB, James KA, Bishop HM. Complex sclerosing lesions (radial scars) of the breast can be palpable. Clin Radiol 1993;48:319 - 20. [ ] 22.Sloane JP, Mayers MM. Carcinoma and atypical hyperplasia in radial scars and complex sclerosing lesions: importance of lesion size and patient age. Histopathology 1993;23:225 - 31. [ ] 23.Orel SG, Evers K, Yeh IT, Troupin RH. Radial scar with microcalcifications: radiologic-pathologic correlation. Radiology 1992;183:479 - 82. [ ] 24.Sheppard DG, Whitman GJ, Huynh PT, Sahin AA, Fornage BD, Stelling CB. Tubular carcinoma of the breast: mammographic and sonographic features. AJR 2000;174:253 - 7. [ ] 25.Heywang-Kobrunner SH, Schreer I, Dershaw DD. Diagnostic breast imaging. Mammography, sonography, magnetic resonance imaging and interventional procedures. New York: Thieme Med Publ, 1997. [ ] 26.Philpotts LE, Shaheen NA, Jain KS, Carter D, Lee CH. Uncommon high-risk lesions of the breast diagnosed at stereotactic core-needle biopsy: clinical importance. Radiology 2000;216:831 - 7. [ ] 27.Reiff DB, Cooke J, Griffin M, Given-Wilson R. Ductal carcinoma in situ presenting as a stellate lesion on mammography. Clin Radiol 1994;49:396 - 9. [ ] 28.Fisher ER, Palekar AS, Kotwal N, Lipana N. A nonencapsulated sclerosing lesion of the breast. Am J Clin Pathol 1979;71:240 - 6. [ ] 29.Nielsen M, Jensen J, Andersen JA. An autopsy study of radial scar in the female breast. Histopathology 1985;9:287 - 95. [ ] 30.King TA, Scharfenberg JC, Smetherman DH, Farkas EA, Bolton JS, Fuhrman GM. A better understanding of the term radial scar. Am J Surg 2000;180:428 - 32. [ ] 31.Kopans DB. Breast imaging. 2nd ed. Philadelphia: Lippincott Williams & Wilkins, 1998. [ ] 32.Dessole S, Meloni GB, Capobianco G, Becchere M, Soro D, Canalis GC. Radial scar of the breast: mammographic enigma in pre- and postmenopausal women. Maturitas 2000;34:227 - 31. [ ] 33.Wellings SR, Alpers CE. Subgross pathologic features and incidence of radial scars in the breast. Hum Pathol 1984;15:475 - 9. [ ] 34.Andersen JA, Gram JB. Radial scar in the female breast. A long-term follow-up study of 32 cases. Cancer 1984;53:2557 - 60. [ ] 35.Douglas-Jones AG, Pace DP. Pathology of R4 spiculated lesions in the breast screening programme. Histopathology 1997;30:214 - 20. [ ] 36.Rosiello DC, Sanders LM, Titus JM, Kalisher L. Breast imaging case of the day. Radial scar with micro- and macrocalcifications in association with sclerosing adenosis. RadioGraphics 1997;17:232 - 5. [ ] 37.Linell F, Ljungberg O, Andersson I. Breast carcinoma. Aspects of early stages, progression and related problems. Acta Pathol Microbiol Scand (Suppl.) 1980;(272):1 - 233. [ ] 38.Tukel S, Koçak S, Aydintug S, Erekul S, Akyar G. Radial scar and tubular carcinoma of the breast. Australas Radiol 1997;41:190 - 2. [ ] 39.Alvarado-Cabrero I, Tavassoli FA. Neoplastic and malignant lesions involving or arising in a radial scar: a clinicopathologic analysis of 17 cases. Breast J 2000;6:96 - 102. [ ] 40.Jacobs TW, Byrne C, Colditz G, Connolly JL, Schnitt SJ. Radial scars in benign breast-biopsy specimens and the risk of breast cancer. N Engl J Med 1999;340:430 - 6. [ ]
Endereço para correspondência Recebido para publicação em 25/9/2002. Aceito, após revisão, em 26/11/2002.
Trabalho realizado no Centro de Diagnóstico por Imagem e no Hospital Santa Rita de Cássia, Vitória, ES.
O arquivo disponível sofreu correções conforme ERRATA publicada no Volume 36 Número 3 da revista. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554