Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 40 nº 6 - Nov. / Dez. of 2007
Vol. 40 nº 6 - Nov. / Dez. of 2007
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Francisco de Araujo, Rossana Corbo de Melo, Ana Maria de Oliveira Rebelo, Bernardo Maranhão Dantas, Ana Letícia A. Dantas, Eder Augusto de Lucena |
|
|
Descritores: Doença de Graves, Gama-câmara, Hipertireoidismo, Iodoterapia, Iodo-131, Sonda cintilométrica |
|
|
Resumo: VMestre em Biologia (Biociências Nucleares), Técnico em Radioproteção da Universidade do Estado do Rio de Janeiro (UERJ), Rio de Janeiro, RJ, Brasil
INTRODUÇÃO Os primeiros estudos da função tireoidiana foram realizados com o 131I, que até hoje vem sendo utilizado em medicina nuclear na terapia de hipertireoidismo e, principalmente, na ablação da tireóide nos tratamentos de câncer. As doses terapêuticas de 131I são administradas oralmente na forma líquida ou por meio de cápsula(1). As vantagens do iodo radioativo incluem fácil administração, eficácia, baixo custo e ausência de dor. Quando administrado por via oral em solução de iodeto de sódio, o iodo é rapidamente absorvido, concentrado e incorporado pela tireóide nos folículos de armazenamento, com meia-vida efetiva de cinco dias. De acordo com dados publicados pela UNSCEAR(2), 90% dos procedimentos terapêuticos em medicina nuclear utilizam o 131I. As doses terapêuticas apresentam atividades na faixa de 100 MBq (2,7 mCi) a 1.000 MBq (27 mCi) para tratamento de hipertireoidismo e 4 GBq (108 mCi) a 8 GBq (216 mCi) para tratamento de câncer de tireóide(3). A atividade captada pela glândula tireóide após a administração de uma dose de 131I varia de um paciente para outro, dependendo de vários fatores, tais como: "grau" de captação do iodo, massa de "tecido captante", meia-vida efetiva do iodo na tireóide, distribuição da radioatividade no tecido e radiossensibilidade das células. Contudo, existem poucas informações conclusivas na literatura a respeito da dose absorvida por pacientes. Em função da magnitude da atividade administrada para o tratamento com radioiodo, os principais riscos aos quais os pacientes estão expostos são o aumento da probabilidade de desenvolvimento de câncer em diferentes órgãos ou tecidos e, para as mulheres em idade fértil, os efeitos para seus descendentes(4). Para a avaliação realística desses riscos é necessária uma análise biocinética do comportamento do 131I no organismo, seguida do cálculo da dose absorvida pelos pacientes. Não há, até o momento, um consenso sobre um protocolo ideal para tratamento de hipertireoidismo. As discussões são freqüentes acerca de qual protocolo contribuiria com um melhor resultado clínico. Há vários protocolos diferentes em uso para determinar a atividade a ser administrada na terapia de radioiodo para hipertireoidismo, mas nem todos consideram a dose absorvida para a tireóide. Alguns protocolos usam uma atividade administrada fixa (padrão), sem considerar os parâmetros biocinéticos, como o volume da glândula, a meia-vida efetiva do iodo na tireóide e a captação individual(5). Quando se usa atividade padrão de 10 mCi em um paciente com doença de Graves, a dose absorvida na tireóide pode variar de 60 Gy a 600 Gy(5). Nos pacientes em que o iodo apresenta meia-vida efetiva curta, a dose absorvida por unidade de atividade será baixa, e o tratamento possivelmente não será bem sucedido, fazendo-se necessária uma segunda terapia. Para altas doses em pacientes com meia-vida efetiva longa, provavelmente acontecerá uma exposição desnecessária(5). Dentre os defensores do cálculo de dose absorvida, muitos levam em consideração apenas alguns parâmetros: volume da tireóide e captação, somente captação ou apenas o volume. Estes alegam que o cálculo da meia-vida efetiva levaria o paciente a várias visitas ao hospital antes do tratamento, aumentando o custo e acarretando longa espera para iniciar a terapia(5). As causas mais comuns do hipertireoidismo são o bócio difuso tóxico, também conhecido como doença de Graves, o bócio multinodular tóxico e o adenoma tóxico, sendo que a doença de Graves é mais freqüente (80%)(6). A meia-vida efetiva do iodo na tireóide dos pacientes portadores de doença de Graves é baixa, enquanto a captação é alta em relação aos bócios multinodular e uninodular(5). As curvas típicas de retenção do iodo na tireóide mostram que o patamar de captação nos pacientes com bócio difuso tóxico acontece, em média, 12 horas após a entrada do radionuclídeo no organismo. Esta característica é de fundamental importância para o cálculo da meia-vida efetiva no intervalo de tempo entre 14 e 30 horas após a administração do iodo radioativo no paciente. A utilização da instrumentação disponível e os procedimentos de rotina no serviço de medicina nuclear tornam esta metodologia simples, viável, eficaz e de baixo custo.
MATERIAIS E MÉTODOS Confecção do simulador de tireóide A parte experimental deste trabalho foi desenvolvida, inicialmente, no Laboratório de Medidas In Vivo do Instituto de Radioproteção e Dosimetria (IRD), onde foi confeccionado o simulador de tireóide, utilizando-se papel de filtro de 110 mm de diâmetro (Whatman) recortado no tamanho e formato da tireóide(7). Este simulador foi impregnado, posteriormente, com uma massa de 241,86 mg de solução de 131I com atividade especifica de 3,075 MBq/g (83,1 µCi/g) e incerteza total de 1,1%. Esta solução foi previamente calibrada pelo Laboratório Nacional de Metrologia das Radiações Ionizantes do Instituto de Radioproteção e Dosimetria da Comissão Nacional de Energia Nuclear (IRD-CNEN). Dessa forma, a atividade de 131I adicionada ao papel de filtro na data da calibração foi de 743.646,94 Bq (20,1 µCi), compatível com a atividade diagnóstica administrada para testes de captação de 131I (procedimento de rotina) nos pacientes encaminhados para tratamento de hipertireoidismo com iodo radioativo. O simulador a ser utilizado neste estudo foi desenvolvido a partir de um modelo já disponível e empregado para fins de radioproteção(8) (Figura 1).
Otimização e calibração dos sistemas de detecção in vivo de 131I na tireóide Esta etapa foi desenvolvida no Serviço de Medicina Nuclear do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ) e consiste na calibração da gama-câmara Diacam da Siemens, que possui um cristal de NaI(Tl), com espessura de 2" × 2" e 59 fotomultiplicadoras, com colimador de chumbo tipo "pinhole" (Figura 2), e da sonda cintilométrica SCT-13004 (Figura 3). Esta metodologia tem como prioridade a otimização do sistema de detecção in vivo, para o cálculo da eficiência de detecção do 131I na tireóide.
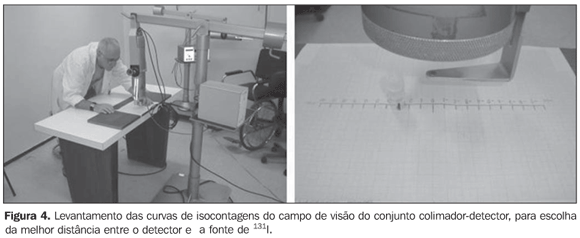
Campo de visão do conjunto colimador-detector Para estabelecer a melhor distância de trabalho entre a fonte e o detector, foram levantadas curvas características do campo de visão do conjunto colimador-detector referentes aos equipamentos envolvidos neste experimento. O método utiliza as curvas de isocontagens ou isorrespostas apresentadas para cada um dos sistemas(9). Essas curvas foram obtidas posicionando-se o detector a distâncias diferentes em relação a uma fonte puntiforme de 131I, trabalhando-se na energia selecionada de 364 keV. Esta fonte é então posicionada em uma mesa sobre uma folha de papel milimetrado, na posição "zero", que coincide com a linha do eixo central do colimador. Para cada uma das distâncias, a fonte puntiforme é movida em passos de 1,0 cm, partindo do ponto "zero" até uma distância de 10,0 cm à direita e à esquerda, perpendicularmente ao eixo central do colimador (Figura 4). Para cada posição da fonte, foram realizadas três medições durante um tempo de 30 segundos cada. Para a obtenção da taxa de contagem foi utilizada a média das três. Para a avaliação do campo de visão do conjunto detector-colimador "pinhole", sem o anel redutor, foram utilizadas cinco distâncias diferentes (42,8 cm, 43,8 cm, 44,8 cm, 45,8 cm e 46,8 cm), medidas com o auxílio de um padronizador de medidas "espaçador" desenvolvido no IRD (Figura 5). Para o conjunto detector-colimador SCT-13004, foram utilizadas três distâncias diferentes (20 cm, 25 cm e 30 cm), medidas com a própria régua que fica acoplada no conjunto (Figura 4). A função da régua e do "espaçador" é manter uma precisão e reprodutibilidade nas medições.
Fator de calibração para gama-câmara e sonda cintilométrica Inicialmente, posicionou-se o simulador de tireóide-pescoço para contagem de radiação de fundos com o simulador de tireóide inerte (sem contaminação), e posteriormente, com o simulador impregnado com a solução de 131I, como descrito anteriormente. O detector foi posicionado, em ambos os casos, a 42,8 cm, 43,8 cm, 44,8 cm, 45,8 cm e 46,8 cm do simulador, realizando-se as contagens em cinco minutos para cada distância. Cada medição foi repetida três vezes, para se obter uma melhor estatística. O mesmo procedimento foi empregado na obtenção do fator de calibração da sonda cintilométrica, variando apenas as distâncias entre o detector e o simulador, que foram de 20 cm, 25 cm e 30 cm. Determinação dos dados biocinéticos A simulação matemática de dados da literatura(5,10) referentes à curva de retenção de iodo na tireóide de pacientes com doença de Graves permitiu avaliar os intervalos de tempo convenientes que possibilitassem o calculo de valores de atividades para a determinação da meia-vida efetiva e da captação inicial do iodo na glândula. A relação entre a dose absorvida pela tireóide e a atividade administrada, necessária para a terapia, foi calculada usando a equação desenvolvida por Marinelli-Quimby(11). D/A = 0,043 Uo Tef/V onde: D/A é a dose absorvida por unidade de atividade administrada (Gy/MBq); Uo é a captação inicial extrapolada para tempo zero (%); Tef é a meia-vida efetiva (dia); V é o volume estimado da tireóide (cm3). A densidade da tireóide foi assumida como 1g/cm3. Foi criada então uma planilha, utilizando-se o programa computacional Microsoft Excel, no qual foram convenientemente trabalhados os valores referentes às variáveis da equação.
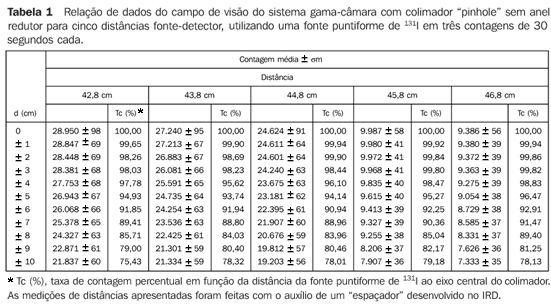
RESULTADOS Determinação das curvas do campo de visão do conjunto colimador-detector Estas curvas permitem estabelecer o campo de visão do conjunto colimador-detector dos equipamentos envolvidos neste experimento, indicando a melhor distância de trabalho entre a fonte e o detector. O método mais informativo de demonstração dessas características apresentadas para cada dispositivo é feito utilizando-se as curvas de isocontagens ou isorrespostas. Nesta região, chamada de "campo de visão", são contabilizadas as contribuições provenientes de qualquer parte da glândula tireóide com uma sensibilidade uniforme, além de reduzir não somente a radiação de fundos do ambiente, mas também a radiação de fundos proveniente de outras partes do corpo do paciente. A Tabela 1 relaciona os valores médios de três contagens para cada posição da fonte em relação ao eixo central do colimador, e os valores percentuais de taxa de contagem relativos à fonte radioativa situada na posição de máxima contagem, com as devidas incertezas associadas.
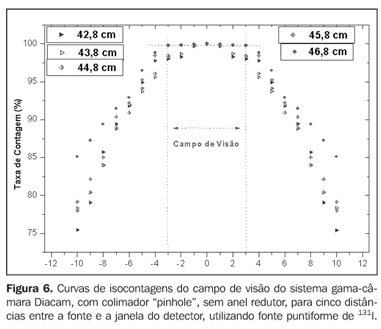
A Figura 6 apresenta a curva de isocontagens do colimador de chumbo do tipo "pinhole" sem o anel redutor, na qual é mostrada a taxa de contagem percentual em função da distância da fonte puntiforme de 131I ao eixo central do colimador.
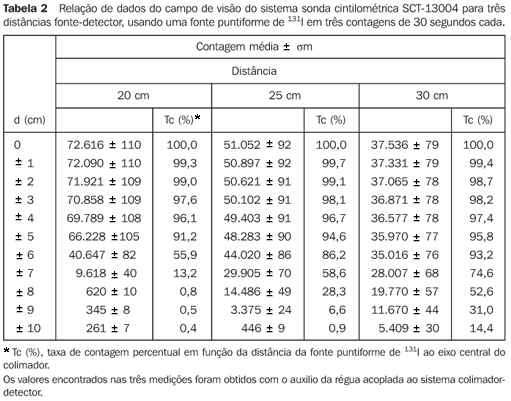
A Tabela 2 relaciona os valores médios de três contagens para cada posição da fonte em relação ao eixo central do colimador, e os valores percentuais de taxa de contagem relativos à fonte radioativa situada na posição de máxima contagem, com as devidas incertezas associadas.
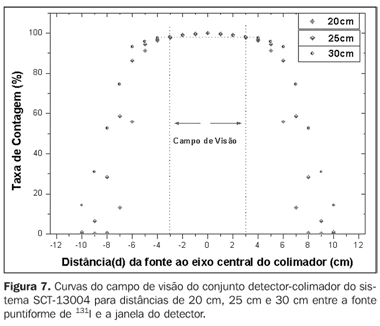
A Figura 7 mostra a curva de isocontagens do detector-colimador do sistema SCT-13004 para distâncias de 20 cm, 25 cm e 30 cm, na qual é mostrada a taxa de contagem percentual em função da distância da fonte puntiforme de 131I ao eixo central do colimador.
Otimização e determinação do fator de calibração Para o sistema gama-câmara Diacam, com colimador de chumbo tipo "pinhole", sem anel redutor ? A Tabela 3 relaciona os fatores de calibração para 131I e suas incertezas associadas às respectivas distâncias do detector ao simulador. Para o sistema gama-câmara Diacam da Siemens, trabalhou-se com o colimador de chumbo do tipo "pinhole" sem o anel redutor e com o padronizador de medidas "espaçador".
Para a sonda cintilométrica SCT-13004 ? A Tabela 4 mostra a variação do fator de calibração do sistema SCT-13004 para distâncias de 20 cm, 25 cm e 30 cm entre a fonte puntiforme de 131I e a janela do detector.
Cálculo dos dados biocinéticos Os dados lançados na planilha (Figura 8) foram trabalhados utilizando recursos oriundos da matemática e da física, na obtenção dos parâmetros biocinéticos.
Nas medições com gama-câmara, ou sonda cintilométrica, para captação do 131I (atividade teste) na tireóide de pacientes portadores de doenças de Graves, coleta-se a taxa de contagens (cpm) em dois testes sucessivos num intervalo de tempo (t), e calcula-se a atividade inicial (A0) e a atividade final (A), para o intervalo de tempo considerado, usando os valores do fator de calibração (FC) obtidos neste trabalho (equação 1). Esses valores serão aplicados na equação (2), para a obtenção do lef (constante de decaimento), e sucessivamente, na equação (3), para o cálculo da meia-vida efetiva no órgão (Tef). A captação inicial (U0) será calculada por extrapolação, usando os valores dos dois testes de captação citados anteriormente. O volume da glândula poderá ser estimado por palpação ou por ultra-sonografia. Esses dados e a correspondente atividade terapêutica serão convenientemente lançados num programa computacional Microsoft Excel, para obtenção da dose absorvida desejada, ou vice-versa, como mostra a planilha da Figura 8.
DISCUSSÃO Pode-se verificar, na Figura 6, que as curvas apresentam uma pequena região plana onde o sistema apresentará, como resultado, o mesmo número de contagens. Esta região plana aumenta em diâmetro à medida que aumenta a distância entre a fonte e a janela do detector. O campo de visão é representado pela região compreendida entre as linhas verticais pontilhadas, e o seu tamanho é indicado no eixo das abscissas. Para os exames de captação de iodo pela tireóide usando o sistema gama-câmara Diacam, as distâncias entre a fonte e o detector de 45,8 cm e 46,8 cm foram as que indicaram melhor resposta de contagens de radiação, por apresentar um campo de visão compatível com o tamanho da glândula, de aproximadamente 6 cm (abscissas ?3 e +3) para pacientes portadores de doença de Graves. As distâncias de 42,8 cm, 43,8 cm e 44,8 cm, apesar de apresentarem número de contagens superior às de 45,8 cm e 46,8 cm, mas tendo campo de visão inferior a 6 cm, o sistema de detecção não contabilizará todas as radiações provenientes da glândula, como podemos observar nas curvas de isocontagens. Para valores acima de 46,8 cm o sistema de detecção contabilizará, além das radiações provenientes da glândula, uma quantidade significativa da radiação de fundos do ambiente, e as provenientes de outras partes do corpo do paciente. Entre as distâncias 45,8 cm e 46,8 cm dá-se preferência à de 45,8 cm, por apresentar maior número de contagens, em virtude de estar mais próximo da fonte, e conseqüentemente, menor incerteza associada. A essa distância está associado o fator de calibração de 4,3 ± 0,17 (cpm/kBq), utilizado neste trabalho. Não obstante, o valor do fator de calibração correspondente à distância de 46,8 cm poderá também ser empregado nos cálculos da relação dose absorvida (Gy) por atividade administrada (MBq), para os pacientes que forem tratados de hipertireoidismo com 131I. O uso desse fator de calibração se dará em função do aumento da glândula (com o campo de visão maior que 6 cm), dependendo da gravidade da doença. Nas curvas de isocontagens apresentadas na Figura 7 pode-se observar que as melhores respostas obtidas para o sistema SCT-13004 se encontram nas distâncias de 25 cm e 30 cm. Neste caso, dá-se preferência para a distância de 25 cm, que, além de proporcionar número maior de contagens, e conseqüentemente, menor incerteza associada, é a mais utilizada nas medidas de captação de iodo na tireóide, nos procedimentos de rotina nos serviços de medicina nuclear. Nessa distância observa-se que o paciente tem melhor conforto, a sensibilidade do sistema é adequada para as medições, em relação à de 30 cm, além de apresentar um campo de visão compatível com o tamanho da glândula dos pacientes portadores de doença de Graves. O fator de calibração encontrado para a distância de 25 cm foi de 39,3 ± 0,78 (cpm/kBq). O simulador de tireóide-pescoço, assim como o protocolo de calibração desenvolvido, mostraram-se adequados aos objetivos do projeto. Tanto a gama-câmara quanto a sonda de captação podem ser utilizadas para a determinação da atividade do 131I na tireóide dos pacientes. Este procedimento será posteriormente aplicado na otimização da atividade individualizada a ser administrada a cada paciente. Esta metodologia torna-se viável e de baixo custo, considerando que o paciente visitará o hospital apenas duas vezes, sendo a primeira visita para receber a atividade teste e a segunda para os procedimentos de captações (%) entre o intervalo de tempo de 14 horas e 30 horas, onde também são coletadas as taxas de contagens necessárias para o cálculo dos dados biocinéticos (meia-vida efetiva do iodo na tireóide e captação inicial), e em seguida a administração da atividade calculada. A metodologia é eficaz e confiável, porque usa todos os parâmetros biocinéticos necessários para o cálculo da dose absorvida pela glândula (dose terapêutica). Agradecimentos Os autores agradecem ao Instituto de Radioproteção e Dosimetria/Comissão Nacional de Energia Nuclear (IRD/CNEN) e ao Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), pelo suporte técnico. Esta pesquisa foi analisada e aprovada pelo Comitê de Ética do HUCFF-UFRJ.
REFERÊNCIAS 1. Thompson MA. Radiation safety precautions in the management of the hospitalized 131I therapy patient. J Nucl Med Technol 2001;29:61?66. [ ] 2. United Nations Scientific Committee on the Effects of Atomic Radiation. UNSCEAR 2000 Report to the General Assembly, with scientific annexes. Volume I: Sources. Vienna, Austria: UNSCEAR, 2000. [ ] 3. International Commission on Radiological Protection. Release of patients after therapy with unsealed radionuclides. ICRP Publication 94. Oxford: Pergamon Press, 2004. [ ] 4. Brandão CDG, Antonucci J, Correa ND, Corbo R, Vaisman M. Efeitos da radioterapia nas gerações futuras de mulheres com carcinoma diferenciado de tireóide. Radiol Bras 2004;37:51?55. [ ] 5. Jönsson H. Radioiodine therapy of hyperthyroidism. Simplified patient-specific absorbed dose planning. Malmö: Department of Radiation Physics, Lund University, 2003. [ ] 6. Nyström E, Berg G, Jansson S, et al. Thyreotoxikos hos vuxna. Klippan, Sweden: Ljungbergs Tryckeri AB, 1999. [ ] 7. International Commission on Radiological Protection. General principles for the radiation protection of workers. ICRP Publication 75. Oxford: Pergamon Press, 1997. [ ] 8. Dantas BM. Bases para a calibração de corpo inteiro utilizando simuladores físicos antropomórficos. (Tese de Doutorado). Rio de Janeiro, RJ: Universidade do Estado do Rio de Janeiro, 1998. [ ] 9. Silva CB. Medida da captação de iodo pela tireóide: análise comparativa entre sistema gama-câmara com colimador tipo "pinhole" e sistema 13S002. (Dissertação de Mestrado). Rio de Janeiro, RJ: Instituto Militar de Engenharia, 2001. [ ] 10. Williams RH. Textbook of endocrinology. 4th ed. Philadelphia-London-Toronto: WB Saunders, 1968. [ ] 11. Marinelli LD, Quimby EH, Hine GJ. Dosage determination with radioactive isotopes II. Practical considerations in therapy and protection. Am J Roentgenol Radium Ther 1948;2:260?281. [ ]
Recebido para publicação em 25/1/2007. Aceito, após revisão, em 7/5/2007.
* Trabalho realizado no Instituto de Radioproteção e Dosimetria/Conselho Nacional de Energia Nuclear (IRD/CNEN), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554