Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 41 nº 6 - Nov. / Dez. of 2008
Vol. 41 nº 6 - Nov. / Dez. of 2008
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Mariana Vieira de Melo da Fonte, Raquel Portugal Guimarães Amaral, Maria Olívia Rodrigues Costa, Maria Concepción Garcia Otaduy, Leandro Tavares Lucato, Umbertina Conti Reed, Sergio Rosemberg, Claudia da Costa Leite |
|
|
Descritores: Meduloblastoma, Neoplasias infratentoriais, Tumores cerebrais pediátricos, Imagem por ressonância magnética, Imagem de difusão por ressonância magnética, Espectroscopia de prótons |
|
|
Resumo: VProfessora Titular do Serviço de Neurologia Infantil do Departamento de Neurologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil
INTRODUÇÃO Os tumores do sistema nervoso central constituem aproximadamente 20% de todas as neoplasias do grupo etário pediátrico, sendo o segundo tipo mais comum de câncer nas crianças, ultrapassado em freqüência apenas pela leucemia(1). O meduloblastoma é um tumor neuroectodérmico primitivo que caracteristicamente ocorre na fossa posterior em crianças(2). É responsável por 30% a 40% dos tumores da fossa posterior na infância, sendo o mais comum, e por 15% a 25% de todos os tumores cerebrais pediátricos. Nos adultos, respondem por 1% dos tumores cerebrais(3). Trata-se de uma neoplasia altamente maligna e de crescimento rápido(4). As variantes histológicas deste tumor incluem: meduloblastoma clássico, meduloblastoma desmoplásico, neuroblastoma cerebelar, meduloblastoma de células gigantes, medulomioblastoma e meduloblastoma melanótico(1). Os exames de imagem possuem papel indispensável no diagnóstico e planejamento terapêutico dos tumores intracranianos. A ressonância magnética (RM), em particular, surgiu como a modalidade de imagem mais freqüentemente utilizada para a avaliação dos tumores intracranianos e continua a ter papel importante e crescente. Técnicas avançadas podem ser integradas às convencionais, melhorando sua acurácia, pois, mais do que informações anatômicas, fornecem dados fisiológicos e bioquímicos. Entre essas técnicas, podemos citar as seqüências de difusão e a espectroscopia de prótons(5). Radiologicamente, os meduloblastomas podem apresentar ampla variedade de formas, assumindo características que podem ser encontradas em outros tumores, como astrocitomas cerebelares, ependimomas ou, ainda, meningiomas. Dessa forma, devem ser considerados no diagnóstico diferencial de qualquer massa da fossa posterior em crianças ou em adultos jovens(6). Levando-se em consideração a freqüência dos meduloblastomas na infância e a dificuldade em se estabelecer um diagnóstico diferencial entre os tumores da fossa posterior nessa faixa etária, propusemo-nos a analisar, retrospectivamente, os exames de RM pré-operatórios de nove pacientes na faixa etária pediátrica, com meduloblastoma, e correlacionar os achados de RM convencional, difusão e espectroscopia de prótons, comparando nossos dados aos da literatura.
MATERIAIS E MÉTODOS Foram analisados, retrospectivamente, os exames de RM pré-operatórios de nove pacientes na faixa etária pediátrica que tinham diagnóstico de meduloblastoma confirmado histopatologicamente, sendo oito destes do subtipo desmoplásico e um do subtipo anaplásico de células gigantes. Estes exames foram realizados no Setor de Ressonância Magnética do Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), num período de quatro anos. Este estudo foi desenvolvido de acordo com os princípios da declaração de Helsinki. Todos os exames foram realizados em aparelhos de 1,5 T (General Electric Medical Systems; Milwaukee, USA), com espessura de corte de 5 mm, utilizando-se as técnicas spin-echo (SE) com seqüência ponderada em T1 (tempo de repetição [TR] /tempo de eco [TE]: 366–500 ms/9–14 ms) nos planos axial em todos os casos e sagital em sete casos; fast spin-echo (FSE) com seqüência ponderada em T2 (TR/TE: 4.500–5.100 ms/99–102 ms) nos planos axial em sete casos, coronal em três casos e axial com saturação de gordura em dois casos; fluid-attenuated inversion recovery (FLAIR) (TR/TE/TI [tempo de inversão]: 8.402–10.002 ms/110–157 ms/2.200 ms), no plano axial em todos os casos. Após a injeção intravenosa do contraste paramagnético (gadolínio) na dose habitual de 0,1 mmol/kg, foi repetida a seqüência ponderada em T1 nos planos axial, coronal e sagital em todos os pacientes. Técnicas avançadas como seqüência de difusão e espectroscopia de prótons foram adquiridas em nove e sete exames, respectivamente. As seqüências de difusão foram adquiridas antes da administração do contraste paramagnético, utilizando valores de b = 0 e 1.000 s/mm², aplicados nas direções X, Y e Z. A espectroscopia foi realizada pelas técnicas stimulated echo acquisition mode (STEAM) (1.500 ms/30 ms) e point resolved spectroscopy (PRESS) (1.500 ms/135 ms), nos sete exames, com voxel único situado na lesão tumoral. A técnica STEAM foi utilizada para avaliação das relações dos metabólitos N-acetil aspartato/creatina (Naa/Cr), colina/creatina (Co/Cr) e mio-inositol/creatina (mI/Cr), enquanto a técnica PRESS foi utilizada para verificação da presença de pico do lactato (Lac). Os exames foram analisados em estação de trabalho Advantage-GE (General Electric Medical Systems; Milwaukee, USA) para reconstrução do mapa do coeficiente de difusão aparente (CDA) e estudo do gráfico da espectroscopia. Foram considerados dados demográficos, como idade e sexo, e os inerentes ao tumor: localização, característica morfológica, intensidade de sinal, realce, disseminação tumoral, características na seqüência de difusão, e achados espectroscópicos (relação Naa/Cr, Co/Cr, mI/Cr e presença de pico do Lac). As relações dos metabólitos Naa/Cr, Co/Cr e mI/Cr foram comparadas a um grupo controle, cujos dados foram obtidos em estudo prévio. A casuística constou de 37 indivíduos normais, 22 do sexo masculino e 15 do sexo feminino, com idade entre 3 e 18 anos, realizando-se estudo espectroscópico com voxel localizado no hemisfério cerebelar. Estes indivíduos não tinham queixas ou sintomas neurológicos, o exame de RM de crânio era normal e seus representantes legais concordaram com a participação neste estudo (Tabela 1)(7).
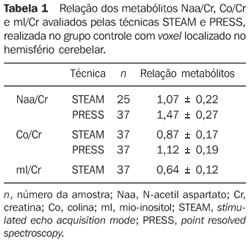
RESULTADOS A casuística foi composta por seis meninas (66,7%) e três meninos (33,3%), com idade entre 2 e 19 anos (média de 8,5 anos), seis deles (66,7%) apresentando idade menor ou igual a 10 anos. O tumor estava localizado na fossa posterior em todos os casos; com epicentro no vermis cerebelar estendendo-se anteriormente ao IV ventrículo em sete (77,8%) (incluindo dois adolescentes de 12 e 19 anos); com acometimento do vermis e hemisfério cerebelar direito em uma criança de quatro anos de idade (11,1%); e na região do IV ventrículo/tronco encefálico em um caso (11,1%). Os tumores eram predominantemente sólidos na maioria dos casos (88,9%). Apresentaram hipossinal nas seqüências ponderadas em T1 e iso/hipersinal nas seqüências ponderadas em T2 e FLAIR em relação à substância cinzenta encefálica. Eram heterogêneos em todos os casos, possivelmente devido à presença de cistos/necrose. O diâmetro máximo da área cística/necrótica atingiu 3,4 cm. Todos os tumores avaliados apresentaram realce pelo contraste paramagnético, de forma heterogênea, variando de moderado a intenso, e de parcial a total (Figura 1).
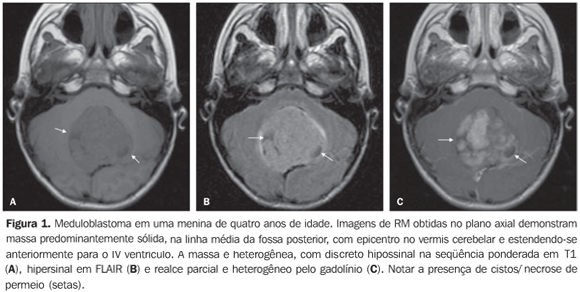
A disseminação liquórica estava presente em seis pacientes (66,7%) na avaliação pré-operatória (Figura 2). Observou-se extensão ao forame de Luschka em quatro casos (44,4%), um deles comprometendo também o forame de Magendie (Tabela 2).
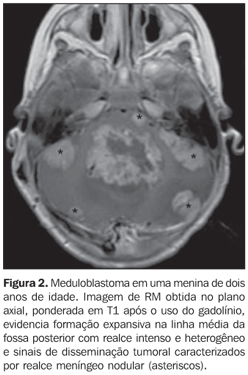
A seqüência de difusão mostrou áreas de restrição à movimentação das moléculas de água em todos os casos analisados (n = 9) (Figura 3).
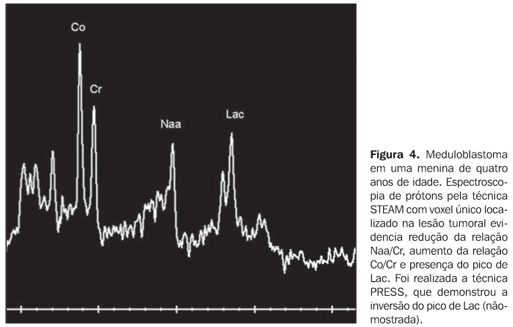
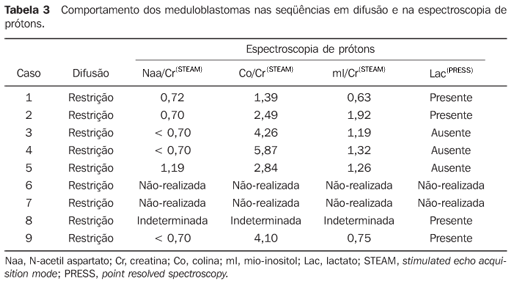
Na espectroscopia de prótons (n = 7), realizada pela técnica STEAM, em um dos pacientes não foi possível a avaliação das relações dos metabólitos, possivelmente devido à heterogeneidade do campo magnético e conseqüente redução da relação sinal/ruído, sendo as relações, neste caso, classificadas como indeterminadas. Nos seis casos restantes a espectroscopia demonstrou redução da relação Naa/Cr em 83,3% dos seis casos, aumento da relação Co/Cr em 100% dos seis casos e aumento da relação mI/Cr em 66,7% dos seis casos (Figura 4).
A espectroscopia pela técnica PRESS evidenciou o pico de Lac em 57,1% dos sete casos analisados (Tabela 3).
DISCUSSÃO Os meduloblastomas são mais freqüentes em crianças e adolescentes, com rápido declínio da incidência na segunda e terceira décadas de vida(8,9). A idade média do diagnóstico nos pacientes com 0 a 19 anos de idade é de 7,9 anos, sendo 57,3% dos casos com idade entre 0 e 10 anos(8). Existe predominância do sexo masculino sobre o feminino, com relação masculino:feminino de 1,5–2:1(8). A variante desmoplásica tipicamente ocorre em adolescentes ou adultos jovens(10,11). Em nosso estudo houve predominância do sexo feminino sobre o masculino, numa razão de 2:1. Tal achado pode estar relacionado à limitações da amostra, relativamente reduzida. Em desacordo com a literatura(10,11), 75% dos casos da variante desmoplásica de nossa casuística ocorreram em pacientes com idade menor ou igual a 10 anos. Este tumor localiza-se, preferencialmente, na linha média da fossa posterior, acometendo o cerebelo em 94,4% dos casos, onde a maioria destes (> 75%) origina-se no vermis cerebelar. O acometimento mais lateral, do hemisfério cerebelar, é típico quando estes tumores manifestam-se em crianças maiores, adolescentes e adultos. Entre 15% e 20% dos meduloblastomas nas crianças estão localizados fora da linha média. Esta diferença na localização parece estar relacionada com a migração de células indiferenciadas do véu medular posterior em uma direção superior e lateral(8,12–14). A variante desmoplásica localiza-se preferencialmente no hemisfério cerebelar(10,11), no entanto, na nossa pequena série, apesar do predomínio da variante desmoplásica, a localização preferencial do meduloblastoma foi no vermis cerebelar. Observamos o tumor centrado no hemisfério cerebelar em apenas um caso (11,1%) do nosso estudo, uma criança de quatro anos de idade. Chama a atenção, todavia, a localização mediana do meduloblastoma nos três adolescentes da nossa casuística. Os meduloblastomas são caracterizados como massas sólidas, homogêneas ou heterogêneas, que sofrem realce pelo meio de contraste, localizadas na fossa posterior, comprimindo ou estendendo-se para o interior do IV ventrículo. No entanto, vários pesquisadores têm descrito achados atípicos, identificados pela tomografia computadorizada (TC) e pela RM(4,6,15,16). Entretanto, não foram observadas diferenças relacionadas às características de sinal e ao realce pelo meio de contraste, nas imagens de RM, entre os subtipos clássico e desmoplásico(16,17). A maioria dos meduloblastomas, segundo Meyers et al.(16), apresenta sinal heterogêneo, relacionado à presença de cistos/necrose, pequenos vasos sanguíneos e/ou calcificações, apresentando de isossinal a hipossinal nas seqüências ponderadas em T1 e isossinal a hipersinal nas seqüências ponderadas em T2. Os achados do nosso estudo são similares aos acima descritos, em que os tumores apresentaram sinal heterogêneo em todos os casos, com predomínio de hipossinal em T1 e iso/hipersinal em T2 e FLAIR. Verificamos, em nosso estudo, a presença de cistos/necrose tumoral em 100% dos casos. Vários autores verificaram a presença de cistos/necrose em meduloblastomas, variando a sua prevalência de 47% a 82% dos casos(4,6,13,18). Esta diferença pode estar relacionada à maior sensibilidade da RM para detecção de pequenos cistos na fossa posterior, quando comparada à TC ou à variação de faixa etária encontrada nos diversos estudos. Em nosso estudo, apenas um tumor foi predominantemente cístico apresentando realce periférico pelo meio de contraste. O realce pelo gadolínio foi heterogêneo e de intensidade variável em 100% dos casos. Na literatura, o grau de realce pelo meio de contraste é bastante variável, sendo o padrão heterogêneo a regra(16). A extensão tumoral através dos forames de saída do IV ventrículo tem sido associada ao ependimoma, em razão das características "plásticas" deste tumor(2,3). No entanto, o meduloblastoma geralmente cresce para dentro do IV ventrículo, preenchendo-o, e pode também se estender através do forame de Magendie e, menos freqüentemente, através dos forames de Luschka(2). De acordo com dados da literatura, em cerca de 15% dos meduloblastomas observa-se extensão tumoral através dos forames de Luschka e/ou Magendie(6,17). Em nosso estudo, observamos extensão ao forame de Luschka em quatro casos (44,4%), um deles comprometendo também o forame de Magendie. Estes achados enfatizam a necessidade de se incluir o meduloblastoma no diagnóstico diferencial dos tumores que acometem os forames de saída do IV ventrículo. Os meduloblastomas são estadiados com base no tamanho e extensão tumoral e na presença ou não de metástases por via liquórica ou fora do sistema nervoso central. Apresentam forte tendência à disseminação por via liquórica para todo o neuroeixo, comprometendo as superfícies ventriculares, o espaço subaracnóide e as raízes nervosas(4,19,20). A disseminação liquórica é identificada em cerca de 20% a 50% dos pacientes no diagnóstico inicial, sendo comuns as metástases difusas e nodulares(20). Em razão da alta incidência de disseminação ao diagnóstico, e tal fato estar relacionado a um pior prognóstico, a avaliação por imagem de todo o neuroeixo é requerida antes do início do tratamento(19). As imagens de RM obtidas após a infusão do gadolínio mostraram ser mais sensíveis para o diagnóstico de disseminação subaracnóide em relação à mielotomografia e à pesquisa de células neoplásicas no líquido cefalorraquidiano(21,22). Segundo Meyers et al.(22), o realce leptomeníngeo (representando tumor subaracnóide) foi o achado mais específico para disseminação tumoral (97%). Observamos, no presente estudo, sinais de disseminação liquórica intracraniana em 66,7% dos casos, representados, em sua maioria, por realce meníngeo linear ou nodular, bem como pela presença de implante intraventricular. Embora os valores do CDA não sejam específicos para prever a histologia de todos os tumores cerebrais, sua aplicação em pacientes pediátricos com tumores de fossa posterior é indicada(23). O CDA é inversamente proporcional à densidade celular, presumivelmente secundário à tortuosidade do espaço intersticial e à resultante limitação na movimentação das moléculas de água. Dessa forma, a alta celularidade da lesão leva ao aumento do sinal na difusão e, conseqüentemente, hipossinal no mapa do CDA(5,23). Rumboldt et al.(23), analisando retrospectivamente 32 pacientes pediátricos com tumores da fossa posterior, estabeleceram um ponto de corte para os valores CDA, em que os valores acima de 1,40 × 10–³ mm²/s foram 100% específicos para astrocitoma pilocítico juvenil, enquanto os valores abaixo de 0,90 × 10–³ mm²/s foram 100% específicos para meduloblastoma e tumor rabdóide/teratóide atípico; medidas entre 1,00 e 1,30 × 10–³ mm²/s foram específicas para a maioria dos ependimomas. Em uma avaliação visual subjetiva do mapa CDA, estes achados se traduzem em proeminente hipersinal do astrocitoma pilocítico juvenil, moderado hipersinal do ependimoma e hipo a isossinal do meduloblastoma e tumor rabdóide/teratóide atípico. Observamos, em 100% dos casos de nossa casuística, por meio de uma avaliação visual subjetiva, áreas de restrição à movimentação das moléculas de água, ou seja, áreas de hipossinal no mapa CDA, provavelmente relacionadas à alta celularidade dos meduloblastomas. A espectroscopia por RM é uma técnica não-invasiva, pela qual se pode obter o perfil bioquímico do tecido cerebral. O Naa é um marcador de densidade e viabilidade neuronal, estando diminuído nas lesões tumorais, supostamente em decorrência da substituição dos neurônios por células neoplásicas. O pico principal do Naa está localizado em 2,02 partes por milhão (ppm). O pico da Co reflete o turnover da membrana celular e está aumentado nos processos em que existe hipercelularidade, como em tumores. Este pico está localizado em 3,22 ppm. O mI é considerado um marcador de célula glial e está localizado em 3,55 ppm. Alterações deste pico são encontradas em distúrbios de osmolaridade, em doenças da substância branca e em neoplasias de baixo grau como o astrocitoma grau II. A Cr é considerada relativamente constante mesmo sob certas condições patológicas, sendo, desta forma, utilizada como referência interna. O pico principal da Cr está localizado em 3,03 ppm. O Lac, que em situações normais está ausente ou em pequenas quantidades, é considerado o produto do metabolismo anaeróbio da glicose, estando aumentado em tumores devido à falha na respiração oxidativa. É visualizado em 1,33 ppm, como um duplo pico invertido nas seqüências com tempo de eco longo (ao redor de 135 ms). Dessa forma, os achados típicos da espectroscopia de prótons para neoplasias primárias são redução no pico do Naa, elevação nos picos da Co e mI e detecção do pico de Lac(5,24). De acordo com Costa(7), o estudo da espectroscopia de prótons permitiu a diferenciação entre os três principais tipos tumorais que acometem a fossa posterior na faixa etária pediátrica. Esse autor concluiu que o meduloblastoma mostrou as maiores relações Co/Cr e Co/Naa comparativamente ao astrocitoma pilocítico e ao ependimoma. No presente estudo, demonstramos redução da relação Naa/Cr em 83,3% dos casos e aumento das relações Co/Cr e mI/Cr em 100% e 66,7% dos casos, respectivamente. Evidenciamos, ainda, o pico de Lac em 57,1% dos tumores. Os achados da difusão e da espectroscopia de prótons devem, sempre, ser correlacionados com as imagens convencionais de RM. O conjunto dos achados macroscópicos obtidos pela RM, somado às características bioquímicas dos meduloblastomas, embora não-específicos, têm sido úteis na tentativa de diferenciação entre os principais tipos tumorais da fossa posterior, melhorando a acurácia diagnóstica. Vale ressaltar a relevância destes achados para estadiamento e planejamento terapêutico adequados, melhorando o prognóstico destes pacientes.
CONCLUSÃO Os meduloblastomas tipicamente se apresentam como tumores predominantemente sólidos, centrados na linha média da fossa posterior, que possuem sinal heterogêneo com predomínio de hipossinal nas seqüências ponderadas em T1 e iso/hipersinal nas seqüências ponderadas em T2. O realce pelo gadolínio é freqüente e heterogêneo e a disseminação liquórica é comum. Observamos, porém, que os achados atípicos relacionados a estes tumores são relativamente comuns, sendo freqüente a presença de cistos/necrose tumoral e a extensão aos forames de saída do IV ventrículo. O achado de restrição à difusão das moléculas de água favorece o diagnóstico de meduloblastoma, enquanto a espectroscopia mostra um padrão de lesão tumoral.
REFERÊNCIAS 1. Becker LE. Pathology of pediatric brain tumors. Neuroimaging Clin N Am. 1999;9:671–90. [ ] 2. Smirniotopoulos JG. The new WHO classification of brain tumors. Neuroimaging Clin N Am. 1999; 9:595–613. [ ] 3. Luh GY, Bird CR. Imaging of brain tumors in the pediatric population. Neuroimaging Clin N Am. 1999;9:691–716. [ ] 4. Sandhu A, Kendall B. Computed tomography in management of medulloblastomas. Neuroradiology. 1987;29:444–52. [ ] 5. Al-Okaili RN, Krejza J, Wang S, et al. Advanced MR imaging techniques in the diagnosis of intraaxial brain tumors in adults. Radiographics. 2006;26:173–89. [ ] 6. Mueller DP, Moore SA, Sato Y, et al. MRI spectrum of medulloblastoma. Clin Imaging. 1992;16: 250–5. [ ] 7. Costa MO. Estudo por imagens convencionais e espectroscopia de prótons por ressonância magnética dos tumores da fossa posterior na faixa etária pediátrica [tese de doutorado]. São Paulo: Faculdade de Medicina da Universidade de São Paulo; 2003. [ ] 8. Roberts RO, Lynch CF, Jones MP, et al. Medulloblastoma: a population-based study of 532 cases. J Neuropathol Exp Neurol. 1991;50:134–44. [ ] 9. Reis Filho JS, Gasparetto EL, Faoro LN, et al. Meduloblastomas: achados clínicos, epidemiológicos e anátomo-patológicos de 28 casos. Arq Neuropsiquiatr. 2000;58:76–80. [ ] 10. Stávale JN, Cruz JRS. Meduloblastoma desmoplásico: fatores histológicos de prognóstico. Arq Neuropsiquiatr. 1993;51:487–90. [ ] 11. Levy RA, Blaivas M, Muraszko K, et al. Desmoplastic medulloblastoma: MR findings. Am J Neuroradiol. 1997;18:1364–6. [ ] 12. Koeller KK, Rushing EJ. From the archives of the AFIP: medulloblastoma: a comprehensive review with radiologic-pathologic correlation. Radiographics. 2003;23:1613–37. [ ] 13. Bourgouin PM, Tampieri D, Grahovac SZ, et al. CT and MR imaging findings in adults with cerebellar medulloblastoma: comparison with findings in children. AJR Am J Roentgenol. 1992; 159:609–12. [ ] 14. Nelson M, Diebler C, Forbes WS. Paediatric medulloblastoma: atypical CT features at presentation in the SIOP II trial. Neuroradiology. 1991; 33:140–2. [ ] 15. Barkovich AJ. Intracranial, orbital, and neck tumors of childhood. In: Barkovich AJ, editor. Pediatric neuroimaging. Philadelphia: Lippincott Williams & Wilkins; 2000. p. 443–580. [ ] 16. Meyers SP, Kemp SS, Tarr RW. MR imaging features of medulloblastomas. AJR Am J Roentgenol. 1992;158:859–65. [ ] 17. Tortori-Donati P, Fondelli MP, Rossi A, et al. Medulloblastoma in children: CT and MRI findings. Neuroradiology. 1996;38:352–9. [ ] 18. Carvalho Neto A, Gasparetto EL, Ono SE, et al. Adult cerebellar medulloblastoma: CT and MRI findings in eight cases. Arq Neuropsiquiatr. 2003; 61:199–203. [ ] 19. Packer RJ, Cogen P, Vezina G, et al. Medulloblastoma: clinical and biologic aspects. Neuro Oncol. 1999;1:232–50. [ ] 20. Osborn AG. Meningeomas e outras neoplasias não gliais. In: Osborn AG, editor. Diagnóstico neurorradiológico. Rio de Janeiro: Revinter; 1999. p. 579–625. [ ] 21. Heinz R, Wiener D, Friedman H, et al. Detection of cerebrospinal fluid metastasis: CT myelography or MR? AJNR Am J Neuroradiol. 1995;16: 1147–51. [ ] 22. Meyers SP, Wildenhain SL, Chang JK, et al. Postoperative evaluation for disseminated medulloblastoma involving the spine: contrast-enhanced MR findings, CSF cytologic analysis, timing of disease occurrence, and patient outcomes. AJNR Am J Neuroradiol. 2000;21:1757–65. [ ] 23. Rumboldt Z, Camacho DLA, Lake D, et al. Apparent diffusion coefficients for differentiation of cerebellar tumors in children. AJNR Am J Neuroradiol. 2006;27:1362–9. [ ] 24. Wang ZJ, Zimmerman RA. Proton MR spectroscopy of pediatric brain metabolic disorders. Neuroimaging Clin N Am. 1998;8:781–807. [ ]
Recebido para publicação em 7/10/2007. Aceito, após revisão, em 12/8/2008.
* Trabalho realizado no Setor de Ressonância Magnética do Instituto de Radiologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InRad/HC-FMUSP), São Paulo, SP, Brasil |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554